Cómo usar TEKAFUM
INSTRUCCIONES para la aplicación médica del medicamento MOVIRICA®(MOVIRICA®)
Composición
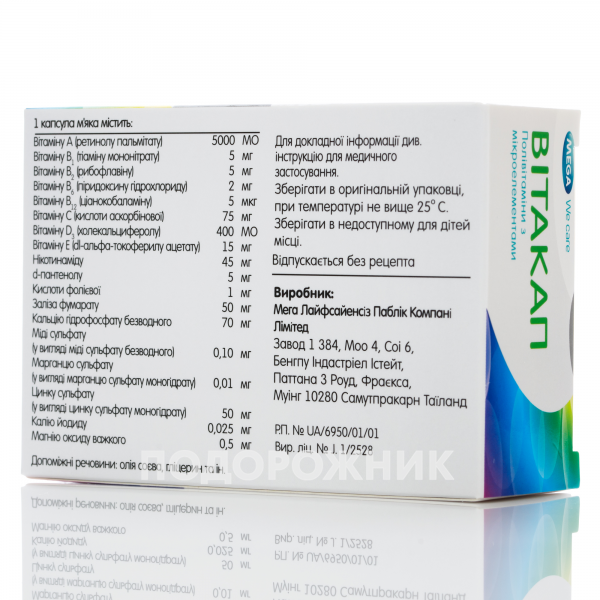
principio activo: pregabalina; 1 cápsula contiene 50 mg, 75 mg o 150 mg de pregabalina; excipientes: lactosa monohidrato; almidón de maíz; talco; cápsula: gelatina, dióxido de titanio (E 171) - para dosificación de 50 mg, 75 mg o 150 mg, óxido de hierro rojo (E 172), óxido de hierro amarillo (E 172), eritrosina (E 127) - para dosificación de 75 mg.
Forma farmacéutica
Cápsulas duras.
Características físico-químicas principales
Cápsulas de 50 mg o 150 mg: cápsulas duras con cuerpo blanco y tapa blanca; cápsulas de 75 mg: cápsulas duras con cuerpo blanco y tapa roja.
Grupo farmacoterapéutico
Antiepilépticos. Otros antiepilépticos.
Código ATC N03A X16.
Propiedades farmacológicas
Farmacodinamia
La pregabalina es un análogo de la gamma-aminobutirato. El mecanismo de acción se debe a que la pregabalina se une a la subunidad auxiliar (proteína α2-δ) de los canales de calcio dependientes de voltaje en el sistema nervioso central (SNC).
La pregabalina es eficaz en el tratamiento del dolor neuropático en la neuropatía diabética, la neuralgia postherpética y la lesión de la médula espinal. En la epilepsia, la reducción de la frecuencia de los ataques de convulsiones se observó en la primera semana de tratamiento; la seguridad y la eficacia son similares cuando se administra la pregabalina 2 o 3 veces al día. En el trastorno de ansiedad generalizada, se ha demostrado una reducción de los síntomas en la escala de Hamilton para la evaluación de la ansiedad (HAM-A) ya en la primera semana de tratamiento con el medicamento. En la fibromialgia, se ha demostrado una reducción del dolor en la escala analógica visual y también se ha demostrado una mejora en los síntomas de la fibromialgia.
Farmacocinética
Absorción. Se absorbe rápidamente después de la administración oral en ayunas y alcanza la concentración máxima en plasma sanguíneo dentro de 1 hora después de la administración. La biodisponibilidad es del 90% o más, y no depende de la dosis. Después de la administración múltiple, el estado de equilibrio se alcanza dentro de 24-48 horas. La ingesta concomitante de pregabalina con alimentos no tiene un efecto significativo en la absorción.
Distribución. Penetra la barrera hematoencefálica, la placenta y el líquido amniótico. El volumen de distribución es de aproximadamente 0,56 l/kg. No se une a las proteínas plasmáticas.
Metabolismo. Experimenta un metabolismo insignificante, el 98% se excreta en la orina en forma inalterada.
Excreción. Se excreta por los riñones, principalmente en forma inalterada, el período de semivida es de 6,3 horas.
Insuficiencia renal. La eliminación de la pregabalina es directamente proporcional a la eliminación de la creatinina, se elimina eficazmente del plasma mediante hemodiálisis. En caso de insuficiencia renal, la dosis del medicamento debe reducirse; después de la hemodiálisis, se debe administrar una dosis adicional.
Insuficiencia hepática. La alteración de la función hepática no puede afectar significativamente la concentración de pregabalina en plasma sanguíneo, ya que la pregabalina se excreta en la orina principalmente en forma inalterada.
Pacientes de edad avanzada. Los pacientes con alteración de la función renal relacionada con la edad pueden necesitar una reducción de la dosis de pregabalina.
Características clínicas
Indicaciones
Dolor neuropático
El medicamento está indicado para el tratamiento del dolor neuropático de origen periférico o central en adultos.
Epilepsia
El medicamento está indicado para adultos como tratamiento adicional para las convulsiones parciales con generalización secundaria o sin ella.
Trastorno de ansiedad generalizada
El medicamento está indicado para el tratamiento del trastorno de ansiedad generalizada en adultos.
Fibromialgia
Contraindicaciones
Hipersensibilidad al principio activo o a cualquier excipiente.
Interacción con otros medicamentos y otras formas de interacción
La pregabalina se excreta principalmente en la orina en forma inalterada, experimenta un metabolismo insignificante en el organismo humano, in vitro no afecta el metabolismo de otros medicamentos y no se une a las proteínas plasmáticas, por lo que las interacciones farmacocinéticas son poco probables.
Estudios in vivo y análisis farmacocinético de población
No se observó in vivo una interacción farmacocinética clínica significativa entre la pregabalina y la fenitoína, la carbamazepina, el ácido valproico, la lamotrigina, la gabapentina, el lorazepam o el etanol. Los medicamentos antidiabéticos orales, los diuréticos, la insulina, el fenobarbital, la tiagabina y el topiramato no tienen un efecto clínicamente significativo en la eliminación de la pregabalina.
Anticonceptivos orales, noretisterona y/o etinilestradiol
La administración concomitante de pregabalina con anticonceptivos orales, noretisterona y/o etinilestradiol no afecta la farmacocinética del estado de equilibrio de ninguno de estos medicamentos.
Medicamentos que afectan el SNC
Puede potenciar el efecto del etanol y el lorazepam. Se han notificado casos de depresión respiratoria, coma y resultado mortal en pacientes que tomaron pregabalina junto con opioides y/o otros medicamentos que deprimen la función del SNC. La pregabalina probablemente aumenta la alteración de las funciones cognitivas y motoras básicas causadas por la oxicodona.
Interacciones en pacientes de edad avanzada
No se han realizado estudios de interacción farmacodinámica con la participación de pacientes de edad avanzada.
Precauciones especiales
Pacientes con diabetes
Los pacientes con diabetes que experimentan un aumento de peso durante el tratamiento con pregabalina pueden necesitar una corrección de la dosis de los medicamentos hipoglucémicos.
Reacciones de hipersensibilidad
En caso de aparición de síntomas de edema angioneurótico (edema facial, edema perioral y edema de las vías respiratorias superiores), se debe suspender inmediatamente la administración de pregabalina.
Reacciones cutáneas graves
Raramente se han notificado reacciones cutáneas graves (síndrome de Stevens-Johnson, necrolisis epidérmica tóxica), que pueden ser mortales, durante el tratamiento con pregabalina. Durante la prescripción del medicamento, los pacientes deben ser informados sobre los signos y síntomas y se debe vigilar cuidadosamente la aparición de reacciones cutáneas. En caso de aparición de signos y síntomas que indiquen estas reacciones, se debe suspender inmediatamente la administración de pregabalina y considerar un tratamiento alternativo (si es necesario).
Mareo, somnolencia, pérdida de conciencia, confusión y alteración mental
La administración de pregabalina se ha asociado con la aparición de mareo y somnolencia, lo que puede aumentar el riesgo de accidentes (caídas) en pacientes de edad avanzada. Se han notificado casos de pérdida de conciencia, confusión y alteración mental, por lo que los pacientes deben ser cautos mientras no se conozcan los posibles efectos de la pregabalina.
Trastornos de la visión
Se han notificado casos de visión borrosa temporal durante el tratamiento con pregabalina, que desaparecía en la mayoría de los casos con la continuación de la terapia. Se han notificado efectos secundarios en los órganos de la visión, incluyendo pérdida de visión, visión borrosa o otros cambios en la agudeza visual, la mayoría de los cuales fueron temporales; estos síntomas desaparecían o disminuían con la suspensión de la administración de pregabalina.
Insuficiencia renal
Se han notificado casos de insuficiencia renal. A veces, este efecto fue reversible después de la suspensión de la administración de pregabalina.
Suspensión de los medicamentos antiepilépticos concomitantes
No hay datos suficientes sobre la suspensión de los medicamentos antiepilépticos concomitantes después de lograr el control de las convulsiones con la adición de pregabalina al tratamiento, para cambiar a la monoterapia con pregabalina.
Síntomas de abstinencia
En algunos pacientes, se han observado síntomas de abstinencia después de la suspensión del tratamiento a corto o largo plazo con pregabalina. Se han notificado casos de insomnio, dolor de cabeza, náuseas, ansiedad, diarrea, síndrome similar a la gripe, nerviosismo, depresión, pensamientos suicidas, dolor, convulsiones, hiperhidrosis y mareo, que indican dependencia física. La aparición de síntomas de abstinencia después de la suspensión de la administración de pregabalina puede indicar dependencia del medicamento. Esta información debe ser comunicada al paciente antes de iniciar el tratamiento. Si se debe suspender la administración de pregabalina, se recomienda hacerlo de forma gradual, durante al menos 1 semana, independientemente de las indicaciones.
Convulsiones, en particular estado epiléptico y convulsiones tónico-clónicas generalizadas
Pueden ocurrir durante el tratamiento con pregabalina o poco después de su suspensión. Los datos sobre la suspensión de la pregabalina después de la administración a largo plazo indican que la frecuencia y la gravedad de los síntomas de abstinencia pueden depender de la dosis.
Insuficiencia cardíaca congestiva
Se han notificado casos de insuficiencia cardíaca congestiva en algunos pacientes que tomaron pregabalina, principalmente durante el tratamiento del dolor neuropático en pacientes de edad avanzada con trastornos cardiovasculares. Se debe administrar con precaución a estos pacientes. La suspensión de la administración de pregabalina puede hacer que este efecto desaparezca.
Tratamiento del dolor neuropático central debido a lesión de la médula espinal
Durante el tratamiento del dolor neuropático central debido a lesión de la médula espinal, la frecuencia de reacciones adversas en general y del sistema nervioso central, especialmente somnolencia, fue más alta. Esto puede estar relacionado con el efecto aditivo de los medicamentos concomitantes (por ejemplo, medicamentos antiespásticos) necesarios para tratar este estado, lo que debe tenerse en cuenta al prescribir pregabalina a estos pacientes.
Depresión respiratoria
Se han notificado casos de depresión respiratoria grave durante el tratamiento con pregabalina. Los pacientes con función respiratoria alterada, enfermedades respiratorias o neurológicas, insuficiencia renal, administración concomitante de depresores del SNC y personas de edad avanzada pueden tener un mayor riesgo de esta reacción adversa grave. Para estos pacientes, puede ser necesario ajustar la dosis.
Pensamientos y comportamiento suicidas
Se han notificado casos de pensamientos y comportamiento suicidas en pacientes que recibieron tratamiento con medicamentos antiepilépticos. Un metaanálisis de estudios clínicos de medicamentos antiepilépticos mostró un aumento leve del riesgo de aparición de estos pensamientos y comportamiento. El mecanismo de aparición de este riesgo es desconocido. Se han notificado casos de pensamientos y comportamiento suicidas en pacientes que recibieron pregabalina. Según los datos del estudio, se ha demostrado un aumento del riesgo de aparición de este comportamiento y suicidio en pacientes que recibieron pregabalina. Los pacientes y las personas que los cuidan deben ser informados de que deben buscar ayuda médica en caso de detectar signos de pensamientos o comportamiento suicidas. Se debe realizar un seguimiento del estado de los pacientes para detectar estos signos y, en caso de aparición, se recomienda suspender la administración de pregabalina y prescribir un tratamiento adecuado (si es necesario).
Empeoramiento de la función del tracto gastrointestinal inferior
Se han notificado casos de empeoramiento de la función del tracto gastrointestinal inferior (obstrucción intestinal, íleo paralítico, estreñimiento) debido a la administración de pregabalina junto con medicamentos que pueden causar estreñimiento, como los analgésicos opioides. Al administrar pregabalina y opioides de forma concomitante, se deben tomar medidas para prevenir el estreñimiento (especialmente en mujeres y pacientes de edad avanzada).
Administración concomitante con opioides
Se debe tener precaución al prescribir pregabalina junto con opioides debido al riesgo de depresión de la función del SNC y al aumento del riesgo de mortalidad con la administración concomitante en comparación con la monoterapia con opioides.
Uso inadecuado, abuso o dependencia
Se han notificado casos de uso inadecuado, abuso y dependencia del medicamento. Se debe administrar con precaución a pacientes con antecedentes de abuso de sustancias; se debe vigilar al paciente para detectar signos de uso inadecuado, abuso o dependencia de la pregabalina (desarrollo de tolerancia, aumento de la dosis prescrita, comportamiento dirigido a obtener el medicamento).
Encefalopatía
La encefalopatía se ha producido principalmente en pacientes con enfermedades concomitantes que pueden causar encefalopatía.
Uso durante el embarazo o la lactancia
Mujeres en edad reproductiva/métodos anticonceptivos
Las mujeres en edad reproductiva deben utilizar métodos anticonceptivos efectivos.
Embarazo
La administración de pregabalina durante el primer trimestre del embarazo puede causar defectos de nacimiento graves. El medicamento atraviesa la placenta. No se debe administrar durante el embarazo, a menos que los beneficios para la mujer embarazada superen los posibles riesgos para el feto.
Lactancia
La pregabalina se excreta en la leche materna, por lo que no se recomienda la lactancia durante el tratamiento con pregabalina.
Fertilidad
No hay datos sobre el efecto de la pregabalina en la fertilidad de las mujeres. No afecta la movilidad de los espermatozoides (según los datos del estudio durante 3 meses de administración de pregabalina a una dosis de 600 mg/día).
Capacidad para influir en la velocidad de reacción al conducir vehículos o utilizar máquinas
La pregabalina puede causar mareo y somnolencia y tener un efecto leve o moderado en la capacidad de conducir vehículos o utilizar máquinas. Se debe evitar conducir vehículos, trabajar con maquinaria compleja y realizar otras actividades potencialmente peligrosas mientras no se conozcan los efectos de la pregabalina en la capacidad para realizar estas actividades.
Vía y dosis de administración
El medicamento se debe tomar por vía oral, independientemente de la ingesta de alimentos. La dosis diaria de 150-600 mg se debe dividir en 2-3 tomas.
Dolor neuropático
El tratamiento se debe iniciar con una dosis de 150 mg/día, dividida en 2-3 tomas. Dependiendo de la respuesta individual y la tolerancia, la dosis se puede aumentar a 300 mg/día después de 3-7 días; si es necesario, hasta una dosis máxima de 600 mg/día después de otros 7 días.
Epilepsia
El tratamiento se debe iniciar con una dosis de 150 mg/día, dividida en 2-3 tomas. Dependiendo de la respuesta individual y la tolerancia, la dosis se puede aumentar a 300 mg/día después de la primera semana de tratamiento; si es necesario, hasta una dosis máxima de 600 mg/día después de otros 7 días.
Trastorno de ansiedad generalizada
El tratamiento se debe iniciar con una dosis de 150 mg/día, dividida en 2-3 tomas.
Se debe revisar periódicamente la necesidad de continuar el tratamiento. Dependiendo de la respuesta individual y la tolerancia, la dosis se puede aumentar a 300 mg/día después de la primera semana de tratamiento y a 450 mg/día después de otra semana de tratamiento; si es necesario, hasta una dosis máxima de 600 mg/día después de otros 7 días.
Fibromialgia
La dosis diaria recomendada es de 300-450 mg/día. El tratamiento se debe iniciar con una dosis de 75 mg dos veces al día (150 mg/día). Dependiendo de la eficacia y la tolerancia, la dosis se puede aumentar a 150 mg dos veces al día (300 mg/día) después de una semana. Para los pacientes que no responden adecuadamente a una dosis de 300 mg/día, se puede aumentar la dosis a 225 mg dos veces al día (450 mg/día).
No se ha demostrado una ventaja adicional con la administración de una dosis de 600 mg/día; se ha observado una menor tolerancia a esta dosis. Dado que los efectos secundarios son dependientes de la dosis, no se recomienda la administración de dosis superiores a 450 mg/día.
Suspensión de la pregabalina
Se debe suspender el tratamiento de forma gradual, durante al menos 1 semana, independientemente de las indicaciones.
Trastornos renales
La pregabalina se excreta del torrente sanguíneo en forma inalterada, principalmente por los riñones, por lo que se debe ajustar la dosis del medicamento en pacientes con trastornos renales.
Se debe reducir la dosis en pacientes con trastornos renales de forma individual, según se indica en la tabla a continuación, según la tasa de filtración glomerular (TFG), que se determina mediante la fórmula:
| Tasa de filtración glomerular (TFG) (ml/min) | Dosis total diaria de pregabalina * | Regimen de dosificación | |
|---|---|---|---|
| Dosis inicial (mg/día) | Dosis máxima (mg/día) | ||
| ≥60 | 150 | 600 | 2 o 3 veces al día |
| ≥30 – <60 | 75 | 300 | 2 o 3 veces al día |
| ≥15 – <30 | 25-50 | 150 | 1 o 2 veces al día |
| <15 | 25 | 75 | 1 vez al día |
| Dosis adicional después de la hemodiálisis (mg) | |||
| 25 | 100 | Dosis única+ | |
* La dosis total diaria (mg/día) se debe dividir en varias tomas según el régimen de dosificación para obtener la dosis para una toma (mg/dosis).
+
La dosis adicional es una dosis única adicional.
Insuficiencia hepática
No se requiere ajuste de la dosis en pacientes con insuficiencia hepática.
Pacientes de edad avanzada
Para los pacientes de edad avanzada, debido a la alteración de la función renal, puede ser necesario reducir la dosis de pregabalina.
Niños
No se ha establecido la seguridad y la eficacia del medicamento en niños menores de 18 años.
Sobredosis
Los efectos secundarios más frecuentes en caso de sobredosis de pregabalina fueron somnolencia, confusión, agitación y agitación. Se han notificado casos de convulsiones y, raramente, de coma. El tratamiento de la sobredosis consiste en medidas de apoyo generales y puede incluir hemodiálisis (ver "Vía y dosis de administración", Tabla 1).
Reacciones adversas
Las reacciones adversas detectadas durante los estudios clínicos fueron de grado leve o moderado, y las más frecuentes fueron mareo y somnolencia.
Las reacciones adversas se presentan por clases de sistemas de órganos y frecuencia de aparición (muy frecuentes (≥ 1/10); frecuentes (≥ 1/100 a < 1/10); poco frecuentes (≥ 1/1000 a < 1/100); raros (≥ 1/10000 a < 1/1000); muy raros (< 1/10000), frecuencia desconocida (no puede estimarse con los datos disponibles).
Las reacciones adversas también pueden estar relacionadas con el curso de la enfermedad subyacente y/o la administración concomitante de otros medicamentos. Durante el tratamiento del dolor neuropático central debido a lesión de la médula espinal, la frecuencia de reacciones adversas en general y del sistema nervioso central, especialmente somnolencia, fue más alta.
Las reacciones adversas notificadas después de la comercialización del medicamento se presentan a continuación y están en cursiva.
Infecciones e infestaciones
Frecuentes: faringitis nasofaríngea.
Trastornos de la sangre y del sistema linfático
Poco frecuentes: neutropenia.
Trastornos del sistema inmunológico
Poco frecuentes: hipersensibilidad.
Raros: edema angioneurótico, reacción alérgica, reacciones anafilactoides.
Trastornos del metabolismo y la nutrición
Frecuentes: aumento del apetito.
Poco frecuentes: pérdida del apetito, hipoglucemia.
Trastornos psiquiátricos
Frecuentes: estado de ánimo eufórico, confusión, irritabilidad, desorientación, insomnio, disminución de la libido.
Poco frecuentes: alucinaciones, ataques de pánico, agitación, excitación, depresión, estado de ánimo deprimido, estado de ánimo elevado, agresividad, cambios de humor, despersonalización, dificultad para encontrar palabras, sueños vívidos, aumento de la libido, anorgasmia, apatía.
Raros: desinhibición, pensamientos y comportamiento suicidas.
Frecuencia desconocida: dependencia de medicamentos.
Trastornos del sistema nervioso
Muy frecuentes: mareo, somnolencia, dolor de cabeza.
Frecuentes: ataxia, trastornos de la coordinación, temblor, disartria, amnesia, deterioro de la memoria, trastornos de la atención, parestesia, hiperestesia, sedación, trastornos del equilibrio, letargia.
Poco frecuentes: síncope, estupor, mioclonus, pérdida de conciencia, hiperactividad psicomotora, discinesia, vértigo postural, temblor intencional, nistagmo, trastornos de las funciones cognitivas, trastornos psíquicos, trastornos del lenguaje, hiporreflexia, hiperestesia, sensación de ardor, ageusia, malestar general, parestesia perioral.
Raros: convulsiones, parosmia, hipocinesia, disgrafía, parkinsonismo, hiperalgia, dependencia, síndrome cerebeloso, síndrome de la rueda dentada, coma, delirio, encefalopatía, síndrome extrapiramidal, síndrome de Guillain-Barré, hipertensión intracraneal, reacciones maníacas, reacciones paranoicas, trastornos del sueño.
Trastornos oculares
Frecuentes: visión borrosa, diplopia, conjuntivitis.
Poco frecuentes: pérdida de la visión periférica, trastornos de la visión, edema de los ojos, defectos del campo visual, disminución de la agudeza visual, dolor en los ojos, astenopia, fotopsia, sequedad en los ojos, aumento de la secreción lagrimal, irritación ocular, blefaritis, trastornos de la acomodación, hemorragia ocular, sensibilidad a la luz, exoftalmos, parálisis del músculo ocular, uveítis.
Raros: pérdida de visión, queratitis, os cilopía, cambio en la percepción de la profundidad visual, midriasis, estrabismo, fotofobia, anisocoria, úlceras de la córnea, exoftalmos, parálisis del músculo ocular, iritis, queratoconjuntivitis, miosis, noche ciega, ooftalmoplejía, atrofia del nervio óptico, edema del disco óptico, ptosis, uveítis.
Trastornos del oído y del aparato vestibular
Frecuentes: vértigo.
Poco frecuentes: hiperacusia.
Trastornos cardiovasculares
Poco frecuentes: taquicardia, bloqueo auriculoventricular de primer grado, bradicardia sinusal, insuficiencia cardíaca congestiva, hipotensión/hipertensión arterial, rubor, hiperemia, sensación de frío en las extremidades.
Raros: prolongación del intervalo QT, taquicardia sinusal, arritmia sinusal.
Trastornos respiratorios, torácicos y mediastínicos
Frecuentes: dolor faringolaríngeo.
Poco frecuentes: disnea, epistaxis, tos, congestión nasal, rinitis, ronquidos, sequedad de la mucosa nasal.
Raros: edema pulmonar, estridor, laringoespasmo, apnea, atelectasia, bronquiolitis, hipo, fibrosis pulmonar, bostezos.
Frecuencia desconocida: depresión respiratoria.
Trastornos gastrointestinales
Frecuentes: vómitos, náuseas, estreñimiento, diarrea, flatulencia, distensión abdominal, sequedad en la boca, gastroenteritis.
Poco frecuentes: enfermedad de reflujo gastroesofágico, hipersalivación, hiperestesia oral, colecistitis, colelitiasis, colitis, hemorragia gastrointestinal, melena, proctalgia, rectorragia.
Raros: ascitis, pancreatitis, disfagia, estomatitis aftosa, úlcera esofágica, absceso periodontal.
Trastornos hepatobiliares
Poco frecuentes: aumento de los niveles de enzimas hepáticas*.
Raros: ictericia.
Muy raros: insuficiencia hepática, hepatitis.
Trastornos de la piel y del tejido subcutáneo
Frecuentes: úlceras por presión.
Poco frecuentes: erupción papulosa, urticaria, hiperhidrosis, prurito, alopecia, sequedad en la piel, eczema, hirsutismo, úlceras cutáneas, erupción vesiculobulosa.
Raros: síndrome de Stevens-Johnson, necrolisis epidérmica tóxica, sudoración fría, dermatitis exfoliativa, dermatitis liqueniforme, melanoza, trastornos de las uñas, pústulas, erupción pustulosa, atrofia cutánea, necrosis cutánea, nódulos cutáneos y subcutáneos.
Trastornos musculoesqueléticos y del tejido conjuntivo
Frecuentes: convulsiones, artralgia, dolor de espalda, dolor en las extremidades, espasmos musculares del cuello.
Poco frecuentes: edema articular, mialgia, calambres musculares, dolor de cuello, rigidez muscular.
Raros: rabdomiolisis.
Trastornos renales y urinarios
Poco frecuentes: incontinencia urinaria, disuria, albuminuria, hematuria, formación de cálculos renales, nefritis.
Raros: insuficiencia renal, oliguria, retención urinaria, insuficiencia renal aguda, glomerulonefritis, pielonefritis.
Trastornos del sistema reproductor y de la mama
Frecuentes: disfunción eréctil, impotencia.
Poco frecuentes: disfunción sexual, retraso de la eyaculación, dismenorrea, dolor en las mamas, leucorrea, menorragia, metrorragia.
Raros: amenorrea, secreción mamaria, aumento de las mamas, ginecomastia, cervicitis, balanitis, epididimitis.
Trastornos generales
Frecuentes: edema periférico, edema, trastornos de la marcha, caídas, sensación de aturdimiento, sensaciones anormales, fatiga aumentada.
Poco frecuentes: edema generalizado, edema facial, opresión en el pecho, dolor, fiebre, sed, escalofríos, astenia, malestar, absceso, inflamación del tejido graso, reacciones de fotosensibilidad.
Raros: granuloma, autolesiones, fibrosis retroperitoneal, shock.
Pruebas de laboratorio
Frecuentes: aumento de peso.
Poco frecuentes: aumento de la creatina quinasa en sangre, aumento de la glucemia en sangre, disminución del número de plaquetas, aumento de la creatinina en sangre, disminución del potasio en sangre, disminución de peso.
Raros: disminución del número de leucocitos en sangre.
* Aumento de los niveles de alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST)
En algunos pacientes, después de la suspensión del tratamiento a corto o largo plazo con pregabalina, se han observado síntomas de abstinencia del medicamento, como insomnio, dolor de cabeza, náuseas, ansiedad, diarrea, síndrome similar a la gripe, convulsiones, nerviosismo, depresión, pensamientos suicidas, dolor, hiperhidrosis y mareo, que indican dependencia física. Esta información debe ser comunicada al paciente antes de iniciar el tratamiento. Los datos sobre la suspensión de la pregabalina después de la administración a largo plazo indican que la frecuencia y la gravedad de los síntomas de abstinencia pueden depender de la dosis.
Niños
El perfil de seguridad de la pregabalina en niños en los estudios clínicos es similar al de los pacientes adultos con epilepsia. Las reacciones adversas más frecuentes fueron somnolencia, pirexia, infecciones del tracto respiratorio superior, aumento del apetito, aumento de peso y faringitis nasofaríngea.
Notificación de reacciones adversas sospechosas
La notificación de reacciones adversas después de la comercialización del medicamento es importante. Esto permite realizar un seguimiento de la relación beneficio/riesgo del medicamento. Los profesionales de la salud y los pacientes o sus representantes legales deben notificar todas las reacciones adversas sospechosas y la falta de eficacia del medicamento a través del sistema de farmacovigilancia en el siguiente enlace: https://aisf.dec.gov.ua.
Fecha de caducidad
3 años.
Condiciones de almacenamiento
Para la dosis de 50 mg
Almacenar en un lugar inaccesible para los niños en el embalaje original a una temperatura no superior a 30 °C.
Para las dosis de 75 mg y 150 mg
Almacenar en un lugar inaccesible para los niños en el embalaje original. No requiere condiciones de almacenamiento especiales.
Envase
7 cápsulas en blister; 2 blisters en caja de cartón.
Categoría de dispensación
Con receta médica.
Fabricante
Atlántic Pharma Productos Farmacéuticos S.A.
Dirección del fabricante y lugar de actividad.
Rúa de Tapada Grande 2, Abrunheira, Sintra, 2710-228, Portugal.
Solicitante
MOVİ HELL S.A.
Dirección del solicitante.
08140, Ucrania, Óblast de Kiev, Raión de Kiev-Sviatoshin, pueblo de Shevchenkove, calle Shevchenko, 162 A.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a TEKAFUMForma farmacéutica: cápsulas, 120 mg, 14 cápsulas en un frascoPrincipio activo: Fumarato de dimetiloFabricante: Амнеал Фармасьютікалз Прайвет ЛімітедRequiere recetaForma farmacéutica: cápsulas, cápsulas de liberación modificada 120mgPrincipio activo: Fumarato de dimetiloFabricante: Сінтон Чилі Лтда.Requiere recetaForma farmacéutica: cápsulas, cápsulas de liberación modificada 240mgPrincipio activo: Fumarato de dimetiloFabricante: Сінтон Чилі Лтда.Requiere receta
Alternativas a TEKAFUM en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a TEKAFUM en España
Alternativa a TEKAFUM en Polonia
Médicos online para TEKAFUM
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de TEKAFUM – sujeta a valoración médica y normativa local.