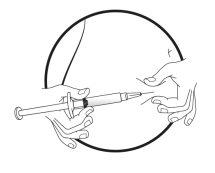
TIVACOMA 30 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG

Cómo usar TIVACOMA 30 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
Tivacoma 30 mg solución inyectable en jeringa precargada EFG
icatibanto
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Tivacoma y para qué se utiliza
- Qué necesita saber antes de empezar a usar Tivacoma
- Cómo usar Tivacoma
- Posibles efectos adversos
- Conservación de Tivacoma
- Contenido del envase e información adicional
1. Qué es Tivacoma y para qué se utiliza
Tivacoma contiene el principio activo icatibanto.
Este medicamento se utiliza para el tratamiento de los síntomas del angioedema hereditario (AEH) en adultos, adolescentes y niños mayores de 2 años.
En el AEH aumentan las concentraciones de una sustancia presente en la sangre llamada bradicinina, lo que produce síntomas como hinchazón, dolor, náuseas y diarrea.
Este medicamento bloquea la actividad de la bradicinina y, por tanto, frena la progresión de los síntomas de una crisis de AEH.
2. Qué necesita saber antes de empezar a usar Tivacoma
No use Tivacoma
- si es alérgico a icatibanto o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico antes de empezar a usar este medicamento:
- Si sufre angina de pecho (disminución del flujo de sangre que llega al corazón).
- Si ha sufrido recientemente un ictus.
Los efectos adversos relacionados con este medicamento son similares a los síntomas de su propia enfermedad. Consulte inmediatamente con su médico si nota que los síntomas de la crisis se agravan después de que le administren este medicamento.
Además:
- Usted o su cuidador deben aprender la técnica de administración de inyecciones subcutáneas (bajo la piel) antes de autoadministrarse o de que su cuidador le administre este medicamento.
- Inmediatamente después de autoadministrarse este medicamento o de que se lo administre su cuidador mientras experimenta una crisis laríngea (obstrucción de la vía aérea superior), deberá buscar atención médica en un centro médico.
- Si sus síntomas no se resuelven tras una inyección de este medicamento autoadministrada o administrada por su cuidador, debe consultar al médico sobre la administración de inyecciones adicionales de este medicamento. En pacientes adultos, se pueden administrar hasta 2 inyecciones adicionales en el plazo de 24 horas.
Niños y adolescentes
No se recomienda el uso de este medicamento en niños menores de 2 años o que pesen menos de 12 kg porque no se ha estudiado en estos pacientes.
Otros medicamento y Tivacoma
Informe a su médico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
No se conocen interacciones de este medicamento con otros medicamentos. Si está tomando algún medicamento que sea un inhibidor de la enzima de conversión de la angiotensina (IECA) (por ejemplo: captopril, enalapril, ramipril, quinapril, lisinopril) para reducir la presión arterial o por cualquier otro motivo, informe a su médico antes de utilizar este medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de empezar a usar este medicamento.
Si se encuentra en período de lactancia, no debe amamantar a su hijo durante las 12 horas siguientes a la última administración de este medicamento.
Conducción y uso de máquinas
No conduzca ni maneje máquinas si se siente cansado o mareado como consecuencia de la crisis de AEH o después de utilizar este medicamento.
Tivacoma contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) de sodio por jeringa; esto es, esencialmente “exento de sodio”.
3. Cómo usar Tivacoma
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
Si nunca se le ha administrado este medicamento previamente, la primera dosis siempre deberá ser inyectada por personal médico o de enfermería. El médico le dará el alta cuando considere seguro que se marche a casa. Tras analizarlo con su médico o enfermero, y tras aprender la técnica para inyecciones subcutáneas (bajo la piel), usted mismo o la persona que lo cuida puede administrarle este medicamento si tiene una crisis de AEH. Es importante inyectar este medicamento por vía subcutánea (bajo la piel) tan pronto como advierta una crisis de angioedema. El personal sanitario le enseñará a usted y a su cuidador el modo de inyectar este medicamento en forma segura, siguiendo las instrucciones del prospecto.
¿Cuándo y con qué frecuencia debe usar Tivacoma?
Su médico ha determinado la dosis exacta de este medicamento y le dirá con qué frecuencia debe utilizarse.
Adultos
- La dosis recomendada de este medicamento es de una inyección (3 ml, 30 mg) administrada por vía subcutánea (debajo de la piel) tan pronto como usted advierta la crisis de angioedema (por ejemplo, con aumento de la hinchazón cutánea, sobre todo en la cara y el cuello, o aumento del dolor abdominal).
- Si no nota una mejoría de los síntomas, después de seis horas, debe buscar asesoramiento médico sobre la administración de inyecciones adicionales de este medicamento. En adultos, se pueden administrar hasta 2 inyecciones adicionales en el plazo de 24 horas.
- No debe recibir más de 3 inyecciones en un período de 24 horas y si necesita más de 8 inyecciones en un mes, debe buscar asesoramiento médico.
Niños y adolescentes de 2 a 17 años
- La dosis recomendada de este medicamento es una inyección de 1 ml hasta un máximo de 3 ml en función del peso corporal por vía subcutánea (bajo la piel) tan pronto como presente síntomas de una crisis de angioedema (por ejemplo, un aumento de la hinchazón cutánea, sobre todo en la cara y el cuello, o aumento del dolor abdominal).
- Consulte la sección de las instrucciones de uso para ver la dosis que debe inyectar.
- Si no está seguro sobre la dosis que debe inyectar, consulte a su médico, farmacéutico o enfermero.
- Si sus síntomas empeoran o no mejoran, debe buscar asesoramiento médico inmediatamente.
¿Cómo debe administrarse Tivacoma?
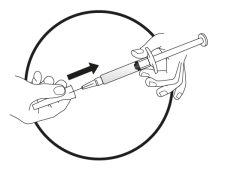
Este medicamento se administra mediante inyección subcutánea (debajo de la piel). Cada jeringa debe utilizarse sólo una vez.
Este medicamento se inyecta con una aguja corta en el tejido graso situado debajo de la piel del abdomen (tripa).
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
Las siguientes instrucciones paso a paso están previstas para:
- autoadministración (adultos)
- administración por parte de un cuidador o un profesional sanitario para adultos, adolescentes o niños mayores de 2 años (que pesen 12 kg como mínimo).
Las instrucciones incluyen los siguientes pasos principales:
- Información general
2a) Preparación de la jeringa para niños y adolescentes (2-17 años) que pesen 65 kg o menos
2b) Preparación de la jeringa y la aguja para la inyección (todos los pacientes)
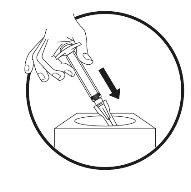
- Preparación del lugar de la inyección
- Inyección de la solución
- Desecho de los materiales de la inyección
Instrucciones paso a paso para la inyección
- Información general
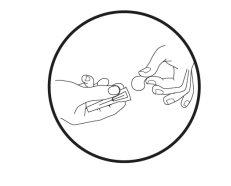
- Limpie el área (superficie) de trabajo que se vaya a utilizar antes de empezar el proceso.
- Lávese las manos con agua y jabón.
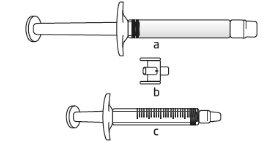
- Retire la jeringa precargada de la bandeja.
- Desenrosque y retire la tapa del extremo de la jeringa precargada.
- Deje la jeringa precargada una vez desenroscada la tapa.
2a) Preparación de la jeringa para niños y adolescentes (2-17 años) que pesen 65 kg o menos: | ||||||||||
Información importante para profesionales sanitarios y cuidadores: Cuando la dosis es inferior a 30 mg (3 ml), se necesita el siguiente equipo para extraer la dosis adecuada (ver información a continuación):
El volumen de inyección requerido en ml se debe preparar en una jeringa graduada de 3 ml vacía (ver tabla a continuación). Tabla 1: Pauta posológica para niños y adolescentes
Los pacientes que pesen más de 65kgusarán todo el contenido de la jeringa precargada (3 ml).
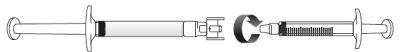
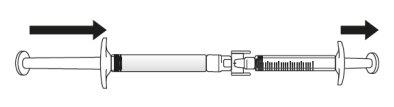
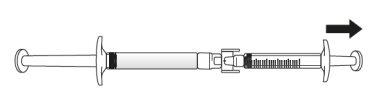
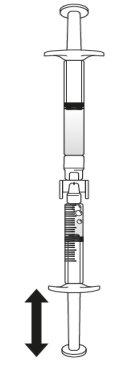
Transferir la solución de icatibanto a la jeringa graduada:
Si hay aireen la jeringa graduada:
Empuje el émbolo de la jeringa graduada para que el aire se transfiera de nuevo a la jeringa precargada (puede que este paso deba repetirse varias veces).
| ||||||||||
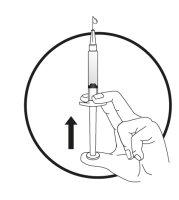
2b) Preparación de la jeringa y la aguja para la inyección:Todos los pacientes (adultos, adolescentes y niños) | ||||||||||
|
|
|
|
|
|
|
|
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Casi todos los pacientes que reciben este medicamento experimentarán una reacción en el lugar de la inyección (como irritación de la piel, hinchazón, dolor, picor, enrojecimiento de la piel y sensación de ardor). Estos efectos suelen ser leves y desaparecen sin necesidad de ningún tratamiento adicional.
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
Reacciones adicionales en el lugar de la inyección (sensación de presión, moratón, disminución de la sensibilidad y/o entumecimiento, aumento de la erupción cutánea con picazón y calor).
Frecuentes (pueden afectar hasta 1 de cada 10 personas): Nauseas
Dolor de cabeza
Mareo
Fiebre
Picor
Erupción
Enrojecimiento de la piel
Pruebas de función hepática anormales
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles): Ronchas (urticaria)
Informe a su médico inmediatamente si observa que los síntomas de la crisis empeoran después de haber recibido este medicamento.
Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Tivacoma
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25?C. No congelar.
No utilice este medicamento si observa que el envase de la jeringa o de la aguja está dañado o si observa signos visibles de deterioro; por ejemplo, si la solución está turbia, si contiene partículas flotantes o si ha cambiado el color de la solución.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Tivacoma
El principio activo es icatibanto. Cada jeringa precargada contiene 30 miligramos de icatibanto (en forma de acetato). Los demás componentes son cloruro sódico (para ajustar el PH), ácido acético glacial, hidróxido sódico (para ajustar el PH) y agua para preparaciones inyectables.
Aspecto de Tivacoma y contenido del envase
Tivacoma se presenta como solución inyectable transparente e incolora en una jeringa de vidrio precargada de 3 ml con tapón de émbolo.
El envase contiene una aguja hipodérmica (25 G, 16 mm).
Este medicamento está disponible en envase unitario de una jeringa precargada con una aguja o en envase múltiple de tres jeringas precargadas con tres agujas.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
Day Zero ehf.
Reykjavíkurvegi 62
220 Hafnarfjördur
Islandia
Responsable de la fabricación
Merckle GmbH
Ludwig-Merckle-Strasse 3
89143, Blaubeuren
Alemania
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Suecia: | Tivacoma |
España: | Tivacoma 30 mg solución inyectable en jeringa precargada EFG |
Fecha de la última revisión de este prospecto: Diciembre 2021
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a TIVACOMA 30 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFGForma farmacéutica: INYECTABLE, 30 mgPrincipio activo: IcatibantoRequiere recetaForma farmacéutica: INYECTABLE, 30 mgPrincipio activo: IcatibantoFabricante: Accord Healthcare S.L.U.Requiere recetaForma farmacéutica: INYECTABLE, 30 mgPrincipio activo: IcatibantoFabricante: Laboratoire AguettantRequiere receta
Médicos online para TIVACOMA 30 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de TIVACOMA 30 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes




 Si no está seguro sobre el volumen de solución que debe extraer, consulte a su médico, farmacéutico o enfermero
Si no está seguro sobre el volumen de solución que debe extraer, consulte a su médico, farmacéutico o enfermero Evite tocar los extremos del conector y las puntas de las jeringas, para prevenir la contaminación
Evite tocar los extremos del conector y las puntas de las jeringas, para prevenir la contaminación