
Rixubis 3000UI/vial polvo y disolvente para solucion inyectable

Cómo usar Rixubis 3000UI/vial polvo y disolvente para solucion inyectable
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
RIXUBIS250UI Polvo ydisolvente para solución inyectable
RIXUBIS500UI Polvo ydisolvente para solución inyectable
RIXUBIS1000UI Polvo ydisolvente para solución inyectable
RIXUBIS2000UI Polvo ydisolvente para solución inyectable
RIXUBIS3000UI Polvo ydisolvente para solución inyectable
nonacog gamma (factor IX humano de coagulación recombinante)
Lea todo el prospecto detenidamente antes de empezar ausar este medicamento porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es RIXUBIS y para qué se utiliza
- Qué necesita saber antes de empezar a usar RIXUBIS
- Cómo usar RIXUBIS
- Posibles efectos adversos
- Conservación de RIXUBIS
- Contenido del envase e información adicional
1. Qué es RIXUBIS y para qué se utiliza
RIXUBIS contiene el principio activo nonacog gamma y es un factor IX humano de coagulación. El Factor IX es un componente normal de la sangre humana necesario para su correcta coagulación, RIXUBIS se utiliza en pacientes con hemofilia B (enfermedad de Christmas, un trastorno hereditario de la sangre causado por una deficiencia de factor IX). Actúa sustituyendo el factor IX que falta para permitir que la sangre del paciente se coagule.
RIXUBIS se utiliza para el tratamiento y la prevención de hemorragias en pacientes con hemofilia B de todos los grupos de edad.
2. Qué necesita saber antes de empezar a usar RIXUBIS
No use RIXUBIS
- si es alérgico a nonacog gamma o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
- si es alérgico a las proteínas de hámster
Advertencias yprecauciones
Es posible que se produzcan reacciones de hipersensibilidad de tipo alérgico con RIXUBIS. Detenga la perfusión y póngase en contacto inmediatamente con su médico o busque atención médica urgente si experimenta los primeros signos de las reacciones de hipersensibilidad/alergia como habón urticarial, erupción, tirantez en el pecho, sibilancia, presión arterial baja o anafilaxia (reacción alérgica grave que puede ocasionar dificultad para tragar y/o respirar, cara y/o manos rojas o hinchadas). Es posible que su médico deba tratarle inmediatamente en caso de estas reacciones. Es posible que su médico también le realice un análisis de sangre para comprobar si ha desarrollado anticuerpos neutralizantes de la actividad (inhibidores) frente al medicamento, ya que los inhibidores pueden desarrollarse junto con las alergias. Los pacientes con inhibidores de factor IX pueden tener un mayor riesgo de anafilaxia durante el tratamiento posterior con factor IX.
Consulte inmediatamente a su médico si la hemorragia no se detiene de la manera esperada o si experimenta un aumento significativo del uso de RIXUBIS para controlar una hemorragia. Su médico le realizará un análisis de sangre para comprobar si ha desarrollado anticuerpos neutralizantes de la actividad (inhibidores) frente a RIXUBIS. El riesgo de desarrollar inhibidores es mayor en pacientes a los que no se ha tratado anteriormente con un medicamento sustituto de factor IX o en las primeras fases del tratamiento, es decir, en el caso de niños pequeños.
La producción de factor IX en el cuerpo la controla el gen de factor IX. Los pacientes que tienen mutaciones específicas de su gen de factor IX, como por ejemplo una eliminación mayor, tal vez tengan más probabilidades de tener inhibidores de factor IX y una reacción alérgica en las primeras fases con cualquier concentrado de factor IX. Por tanto, si se sabe que usted tiene tal mutación, su médico le controlará con mayor cuidado para detectar signos de una reacción alérgica.
Si padece enfermedad hepática o cardiaca, o si se ha sometido recientemente a una intervención quirúrgica importante, informe a su médico, ya que existe un mayor riesgo de complicaciones en la coagulación de la sangre.
Se han notificado casos de trastornos renales (síndrome nefrótico) tras la administración de dosis elevadas de factor IX en pacientes con hemofilia B que tenían inhibidores de factor IX y antecedentes de reacciones alérgicas.
Siempre que sea posible, anote el nombre del medicamento y el número de lote cada vez que utilice RIXUBIS (por ejemplo, en su diario) para mantener un registro de los medicamentos y los lotes que ha utilizado.
Uso de RIXUBIS con otros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento. No se han notificado interacciones de RIXUBIS con otros medicamentos.
Embarazo, lactancia yfertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. La hemofilia B aparece en muy raras ocasiones en mujeres.
Conducción yuso de máquinas
La influencia de RIXUBIS sobre la capacidad para conducir y utilizar máquinas es nula.
RIXUBIS contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por vial, es decir, prácticamente no tiene sodio. Sin embargo, dependiendo de su peso corporal y de su dosis de RIXUBIS, usted podría recibir más de un vial. Esto se debe tener en cuenta si sigue una dieta pobre en sodio.
3. Cómo usar RIXUBIS
El tratamiento con RIXUBIS lo iniciará por un médico con experiencia en el tratamiento de pacientes con hemofilia B.
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
Su médico decidirá la dosis de RIXUBIS que se le administrará. Esta dosis y la duración dependerán de la gravedad de su deficiencia de factor IX, de la ubicación y la extensión de la hemorragia, así como de su estado clínico, la edad y la rapidez con la que su cuerpo consume el factor IX, que se debe comprobar con regularidad.
Su médico o enfermero le administrarán RIXUBIS mediante perfusión intravenosa (IV) después de reconstituir el polvo con el disolvente suministrado. Usted o cualquier otra persona pueden también administrar la inyección de RIXUBIS, pero únicamente después de recibir la formación adecuada.
Reconstitución y administración
- Para la reconstitución, utilice únicamente el disolvente y el dispositivo de reconstitución (BAXJECT II) incluidos en el envase.
- Para la administración se requiere el uso de una jeringa luer lock.
- No utilizar si el equipo BAXJECT II, el sistema estéril de protección o su envase está dañado o muestra algún signo de deterioro.
Reconstitución
Utilizar técnica aséptica:
- Si el medicamento se encuentra en la nevera, sacar de la nevera los viales de polvo y de disolvente de RIXUBIS y esperar a que alcancen la temperatura ambiente (entre 15 °C y 30 °C).
- Lavar las manos con jabón y agua templada.
- Quitar los protectores de los viales de polvo y disolvente.
- Limpiar los tapones con las toallitas impregnadas de alcohol. Colocar los viales en una superficie plana y limpia.
- Abrir el envoltorio del equipo BaxJect II quitando la tapa de papel sin tocar el interior (Fig. a). No sacar el equipo del envoltorio.
- Dar la vuelta al envoltorio e insertar la punta de plástico a través del tapón del disolvente. Coger el envoltorio por su extremo y sacar el equipo BaxJect II de su envoltorio (Fig. b). No quitar el protector azul del equipo BAXJECT II.
- Con Baxject II unido al vial de disolvente, invertir el sistema de tal forma que el vial de disolvente esté en la parte superior del equipo. Insertar la punta de plástico blanca dentro del tapón del vial de polvo RIXUBIS. El vacío hará que el disolvente penetre en el vial de polvo RIXUBIS (Fig. c).
- Agitar con suavidad hasta que todo el material se haya disuelto. El medicamento se disuelve rápidamente (en unos 2 minutos). Asegúrese de que RIXUBIS esté completamente disuelto, si no es así, toda la solución reconstituida no pasará a través del filtro del equipo. Deben inspeccionarse visualmente los medicamentos reconstituidos para detectar partículas o decoloración antes de la administración. La solución debe ser transparente o ligeramente opalescente. No utilizar soluciones turbias o con depósitos.
Fig. aFig. bFig. c



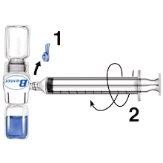
No refrigerar la preparación después de la reconstitución.
Utilizar inmediatamente.
Administración
Utilizar técnica aséptica:
- Quitar el protector azul del equipo BAXJECT II. No introducir aire en la jeringa. Conectar la jeringa al equipo BAXJECT II (Fig. d).
- Invertir el sistema (el vial con la solución reconstituida en la parte superior). Introducir la solución reconstituida en la jeringa, tirando del émbolo hacia atrás lentamente (Fig. e).
- Desconectar la jeringa.
- Conectar una aguja de perfusión con aletas a la jeringa. Inyectar por vía intravenosa. La solución se debe administrar lentamente, a una velocidad determinada de acuerdo al nivel de comodidad del paciente, que no exceda de 10 ml por minuto.
Fig. dFig. e
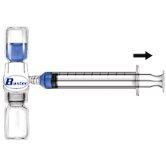
Siempre que sea posible, anote el nombre del medicamento y el número de lote cada vez que utilice RIXUBIS (por ejemplo, en su diario) para mantener un registro de los medicamentos y los lotes que ha utilizado.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Si usa más RIXUBIS del que debe
Siga exactamente las instrucciones de administración de RIXUBIS indicadas por su médico. En caso de duda, consulte de nuevo a su médico. Si se inyecta una dosis mayor de RIXUBIS de la recomendada, consulte con su médico lo antes posible.
Si olvidó usar RIXUBIS
No se inyecte una dosis doble para compensar las dosis olvidadas. Adminístrese la siguiente inyección como está establecido y continúe como le había indicado su médico.
Si interrumpe el tratamiento con RIXUBIS
No deje de usar RIXUBIS sin consultarlo con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Es posible que se produzcan reacciones de hipersensibilidad de tipo alérgico con RIXUBIS. Entre estas reacciones se incluyen sensaciones de ardor y punzadas en el lugar de perfusión, escalofríos, rubefacción, letargia, inquietud, cosquilleo, habón urticarial, picor y sarpullido, presión arterial baja, frecuencia cardiaca rápida, tirantez en el pecho, sibilancia, hinchazón de la garganta, anafilaxia (reacción alérgica grave), dolor de cabeza, náuseas y vómitos. Consulte inmediatamente a su médico si experimenta estos signos. Es posible que su médico deba tratarle inmediatamente en caso de estas reacciones (ver sección 2 ‘Advertencias y precauciones’).
Se han observado los siguientes efectos adversos con RIXUBIS:
Efectos adversos frecuentes(pueden afectar hasta a 1 de cada 10 pacientes)
- alteración del gusto
- dolor en las extremidades.
Efectos adversos con frecuencia desconocida(no se puede estimar la frecuencia a partir de los datos disponibles)
- reacciones alérgicas (hipersensibilidad).
No se han observado con este medicamento problemas ocasionados por una coagulación excesiva de la sangre (episodios tromboembólicos), pero pueden ocurrir con cualquier producto de factor IX. Entre estos, se incluyen ataques al corazón, coágulos de sangre en las venas o en el pulmón.
Comunicaciónde efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata deposibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de RIXUBIS
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el embalaje exterior y la etiqueta del vial después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar por debajo de 30ºC.
No congelar.
Utilice la solución reconstituida inmediatamente.
No utilice RIXUBIS si la solución no es incolora y transparente.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de RIXUBIS
- El principio activo es nonacog gamma (factor IX humano de coagulación recombinante). Cada vial contiene nominalmente 250, 500, 1000, 2000 o 3000 UI, correspondientes a una concentración de 50, 100, 200, 400 o 600 UI/ml después de la reconstitución con 5 ml de disolvente.
- Los demás componentes del polvo son sacarosa, manitol, cloruro de sodio, cloruro de calcio, L‑histidina, polisorbato 80.
Vial de disolvente: 5 ml de agua esterilizada para preparaciones inyectables.
Aspecto del producto ycontenido del envase
RIXUBIS se proporciona como polvo y disolvente para solución inyectable.
El contenido del envase es el siguiente:
- un vial de polvo RIXUBIS 250, 500, 1000, 2000 o 3000 UI en un vial de vidrio con un tapón de caucho
- un vial de 5 ml de agua esterilizada para preparaciones inyectables en un vial de vidrio con un tapón de caucho
- un BAXJECT II (equipo de reconstitución sin agujas)
Titular de la autorización de comercialización
Baxalta Innovations GmbH
Industriestrasse 67
A‑1221 Vienna
Tel.: 800 66838470E-mail: [email protected]
Responsable de la fabricación
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B‑7860 Lessines
Bélgica
Fecha de la última revisión de este prospecto 01/2020
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Esta información está destinada únicamente a profesionales del sector sanitario:
Supervisión del tratamiento
Durante el tratamiento, se recomienda la determinación adecuada de los niveles de factor IX para calcular la dosis que se debe administrar y la frecuencia de las perfusiones repetidas. Los pacientes individuales pueden diferir en su respuesta al factor IX con diferentes semividas y recuperaciones. La dosis basada en el peso corporal puede requerir un ajuste en pacientes con bajo peso o sobrepeso. En el caso particular de intervenciones quirúrgicas importantes, es indispensable una supervisión precisa de la terapia de sustitución mediante análisis de la coagulación (actividad del factor IX de plasma).
Para garantizar que se ha alcanzado el nivel plasmático de actividad de factor IX deseado, se aconseja realizar un control exhaustivo utilizando un ensayo adecuado de actividad de factor IX y, si es necesario, se deben aplicar los ajustes adecuados a la dosis y la frecuencia de las perfusiones repetidas. Al utilizar el ensayo in vitrode coagulación en una etapa basado en el tiempo de la tromboplastina (aPTT) para determinar la actividad del factor IX en muestras sanguíneas de pacientes, los resultados de actividad del factor IX pueden verse significativamente afectados por el tipo de reactivo de aPTT y el estándar de referencia utilizado en el ensayo. Esto es importante especialmente al cambiar el laboratorio y/o los reactivos utilizados en el ensayo.
Posología
La dosis y la duración de la terapia de sustitución depende de la gravedad de la deficiencia de factor IX, de la ubicación y la extensión de la hemorragia, así como el estado clínico, la edad y los parámetros farmacocinéticos de factor IX del paciente, como la recuperación incremental y semivida.
El número de unidades de factor IX administradas se expresa en unidades internacionales (UI), que están relacionadas con el estándar actual de la OMS para productos de factor IX. La actividad de factor IX en el plasma se expresa como un porcentaje (relativo al plasma humano normal) o en unidades internacionales (relativas a un estándar internacional para el factor IX en el plasma).
Una unidad internacional de actividad de factor IX es equivalente a la cantidad de factor IX existente en un ml de plasma humano normal.
Población adulta
Tratamiento a demanda El cálculo de la dosis necesaria de factor IX se basa en el hallazgo empírico de que 1 unidad internacional de factor IX por kg de peso corporal incrementa la actividad de factor IX del plasma en 0,9 UI/dl (intervalo de 0,5 a 1,4 UI/dl) o 0,9% de actividad normal en pacientes de 12 años de edad y mayores (para obtener información adicional, ver sección 5.2).
La dosis necesaria se determina utilizando la siguiente fórmula:
Unidades requeridas | = | peso corporal (kg) | x | aumento deseado de factor IX (%) o (UI/dl) | x | recíproco de recuperación observada (dl/kg) |
Para una recuperación incremental de 0,9 UI/dl por UI/kg, la dosis se calcula de la siguiente manera:
Unidades requeridas | = | peso corporal (kg) | x | aumento deseado de factor IX (%) o (UI/dl) | x | 1,1 dl/kg |
La cantidad que se debe administrar y la frecuencia de la administración deben estar siempre orientadas a la eficacia clínica en el caso concreto.
En el caso de los episodios hemorrágicos siguientes, la actividad de factor IX no debe ser inferior al nivel de actividad plasmática dada (en % del normal o UI/dl) en el periodo correspondiente. Se puede utilizar la siguiente tabla como guía de dosificación en episodios hemorrágicos y cirugía:
Grado de hemorragia / tipo de procedimiento quirúrgico | Nivel de factor IX requerido (%) o(UI/dl) | Frecuencia de dosis (horas) / duración de la terapia (días) |
Hemorragia Hemartrosis incipiente o hemorragia muscular u oral Hemartrosis más extensa, hemorragia muscular o hematoma Hemorragia con riesgo vital. | 20 – 40 30 – 60 60 – 100 | Repetir cada 24 horas. Al menos 1 día, hasta que el episodio hemorrágico, según indique el dolor, se resuelva o se logre la curación. Repetir perfusión cada 24 horas durante 3 – 4 días o más, hasta que cese el dolor y la incapacidad aguda. Repetir perfusión cada 8 a 24 horas hasta superar el peligro. |
Cirugía Cirugía menor incluyendo extracción dental | 30 – 60 | Cada 24 horas, al menos 1 día, hasta lograr la curación. |
Operación importante | 80 – 100 (pre y postoperatorio) | Repetir perfusión cada 8 a 24 horas hasta que se consiga una curación adecuada de la herida, y luego al menos otros 7 días de terapia para mantener una actividad de factor IX del 30% al 60% (UI/dl). |
Es especialmente importante una supervisión cuidadosa de la terapia de sustitución en los casos de operación importante o hemorragia potencialmente mortal.
Profilaxis
Para la profilaxis de larga duración frente a hemorragias en pacientes con hemofilia B grave, las dosis normales son de 40 a 60 UI de factor IX por kilogramo de peso corporal a intervalos de 3 a 4 días para los pacientes de 12 años de edad y mayores. En algunos casos, dependiendo de los parámetros farmacocinéticos, la edad, el fenotipo de hemorragia y la actividad física del paciente, es posible que se necesiten intervalos de dosificación más cortos o dosis más altas.
Perfusión continua
No administre RIXUBIS mediante perfusión continua.
Población pediátrica
Pacientes de 12 a 17 años de edad:
La posología es la misma para los adultos y los pacientes pediátricos de 12 a 17 años.
Pacientes menores de 12 años:
Tratamiento a demanda:
El cálculo de la dosis de factor IX requerida se basa en el hallazgo empírico de que 1 unidad internacional de factor IX por kg de peso corporal incrementa la actividad de factor IX del plasma en 0,7 UI/dl (intervalo de 0,31 a 1,0 UI/dl) o 0,7% de la actividad normal en pacientes de menos de 12 años de edad (para obtener información adicional, ver sección 5.2).
La dosificación requerida se determina mediante la siguiente fórmula:
Pacientes de menos de 12 años de edad:
Unidades requeridas | = | peso corporal (kg) | x | aumento deseado de factor IX (%) o (UI/dl) | x | recíproco de recuperación observada (dl/kg) |
Para una recuperación incremental de 0,7 UI/dl por UI/kg, la dosis se calcula de la siguiente manera:
Unidades requeridas | = | peso corporal (kg) | x | aumento deseado de factor IX (%) o (UI/dl) | x | 1,4 dl/kg |
Se puede utilizar la misma tabla para los adultos como guía de dosificación en episodios hemorrágicos y cirugía (ver anterior).
Profilaxis:
El intervalo de dosis recomendadas para pacientes pediátricos de menos de 12 años de edad es de 40 a 80 UI/kg a intervalos de 3 a 4 días. En algunos casos, dependiendo de los parámetros farmacocinéticos, la edad, el fenotipo de la hemorragia y la actividad física del paciente, es posible que se necesiten intervalos de dosificación más cortos o dosis más altas.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a Rixubis 3000UI/vial polvo y disolvente para solucion inyectableForma farmacéutica: INYECTABLE, 1.000 UIPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requiere recetaForma farmacéutica: INYECTABLE, 2.000 UIPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requiere recetaForma farmacéutica: INYECTABLE, 250 UIPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requiere receta
Médicos online para Rixubis 3000UI/vial polvo y disolvente para solucion inyectable
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de Rixubis 3000UI/vial polvo y disolvente para solucion inyectable, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















