PROKAM 50 MG POLVO PARA SOLUCION INYECTABLE

Cómo usar PROKAM 50 MG POLVO PARA SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
Prokam50 mg polvo para solución inyectable
Cefuroxima
Lea todo el prospecto detenidamente antes de que se le administre este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted,y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Prokam y para qué se utiliza
- Qué necesita saber antes de que le administren Prokam
- Cómo se administra Prokam
- Posibles efectos adversos
- Conservación de Prokam
- Contenido del envase e información adicional
1. Qué es Prokam y para qué se utiliza
- Prokam contiene una sustancia activa, cefuroxima (como cefuroxima sódica) que pertenece a un grupo de antibióticos denominados cefalosporinas. Los antibióticos se utilizan para eliminar las bacterias o gérmenes que causan infecciones.
Los antibióticos se utilizan para tratar infecciones bacterianas y no sirven para tratar infecciones víricas como la gripe o el catarro.
Es importante que siga las instrucciones relativas a la dosis, el intervalo de administración y la duración del tratamiento indicadas por su médico.
No guarde ni reutilice este medicamento. Si una vez finalizado el tratamiento le sobra antibiótico, devuélvalo a la farmacia para su correcta eliminación. No debe tirar los medicamentos por el desagüe ni a la basura.
- Este medicamento se utilizará si se le va a efectuar una cirugía de catarata (opacidad del cristalino).
- A fin de prevenir una infección del ojo, el cirujano oftalmólogo le inyectará este medicamento en el ojo al final de la operación de catarata.
2. Qué necesita saber antes de que le administren Prokam
No useProkam
- Si es alérgico (hipersensible) a la cefuroxima o a cualquiera de los antibióticos del grupo de las cefalosporinas.
Advertencias y precauciones
Informe a su médico,farmacéutico o enfermero antes de empezar a usar Prokam:
- si es alérgico a otros antibióticos como la penicilina,
- si tiene riesgo de sufrir una infección debida a bacterias denominadas Staphylococcus aureusresistentes a meticilina,
- si tiene riesgo de sufrir una infección grave,
- si se le ha diagnosticado una catarata complicada,
- si está previsto efectuarle una cirugía combinada en el ojo,
- si tiene una enfermedad grave de la tiroides.
Prokam solamente se administra como una inyección en el ojo (inyección intracameral).
Prokam solamente debe administrarse en condiciones asépticas (significando limpieza y ausencia de gérmenes) propios de la cirugía de catarata.
Cada vial de Prokam debe utilizarse para un solo paciente.
Uso de Prokam con otros medicamentos
Comunique a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento
Embarazo ylactancia
- Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de que se le administre este medicamento.
- Se le administrará Prokam solamente en el caso en el cual el beneficio supere los potenciales riesgos.
Prokam contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, esto es, esencialmente “exento de sodio”.
3. Cómo se administra Prokam
- Las inyecciones de Prokam se administrarán por un cirujano oftálmico al final de la cirugía de catarata.
- Prokam se presenta como un polvo estéril, el cual se disuelve en solución salina para inyección antes de su administración.
Si se le administra demasiado, o muy poco Prokam
Este medicamento se le administrará por un profesional sanitario. Si cree que se ha olvidado una dosis o que ha recibido demasiado medicamento, informe a su médico o enfermero.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
En caso de sobredosis o ingestión accidental consulte inmediatamente a su médico o farmacéutico o llame al Servicio de Información Toxicológica, teléfono: 91 562 04 20, indicando el medicamento y la cantidad ingerida.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Prokam puede producir efectos adversos, aunque no todas las personas los sufran.
Los siguientes efectos adversos son muy raros (pueden afectar hasta a 1 de cada 10.000 personas):
- Reacción alérgica grave que causa dificultad para respirar o desvanecimientos.
El siguiente efecto adverso se ha notificado con una frecuencia no conocida (no puede estimarse a partir de los datos disponibles):
- Edema macular (visión borrosa o distorsionada cerca o en el centro de su campo de visión).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamento de uso humano.: www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Prokam
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del vial y el cartonaje después de CAD. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25ºC. Mantener el vial en el embalaje exterior para protegerlo de la luz.
Para un solo uso.
Tras la reconstitución: se debe utilizar inmediatamente el producto.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición deProkam
El principio activo es cefuroxima (en forma de cefuroxima sódica).
Cada vial contiene 50 mg de cefuroxima.
Tras la reconstitución, 0,1 ml de solución contiene 1 mg de cefuroxima.
No hay otros componentes.
Aspecto deProkamy contenido del envase
Prokam es un polvo para solución inyectable blanco a casi blanco, contenido en un vial de vidrio.
Cada caja contiene uno, o diez o veinte viales o diez viales junto con diez agujas con filtro estéril de 5 micras. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
LABORATOIRES THEA
12 rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
Francia
Representante local:
Laboratorios THEA S.A.
C/ Enric Granados, nº 86-88, 2ª planta
08008 Barcelona
Responsable de la fabricación:
BIOPHARMA S.R.L.
Via Delle Gerbere, 22/30 Santa Palomba
00134 ROMA
Italia
o
LABORATOIRES THEA
12 rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
Francia
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Austria, Bélgica, República Checa, Dinamarca, Finlandia, Francia, Alemania, Italia, Islandia, Luxemburgo, Países Bajos, Noruega, Polonia, Portugal, Rumania, República Eslovaca, Eslovenia, Suecia, Reino Unido …………………………………………………Aprokam
Chipre, Grecia, España…………………………………………………………..Prokam
Irlanda…………………………………………………………………………….APROK
Fecha de la última revisión de esteprospecto:Agosto 2019
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
Esta información está destinada únicamente a profesionales del sector sanitario:
Incompatibilidades
En la bibliografía no hay referencias de incompatibilidades con los productos usados habitualmente en la cirugía de catarata. Este medicamento no debe mezclarse con otros, excepto los mencionados a continuación [solución de cloruro de sodio 9 mg/ml (0,9%) para inyección].
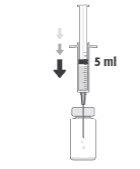
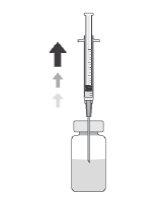
Cómo preparar y administrar Prokam
Vial de un solo uso, solamente para uso intracameral.
Tras la reconstitución, Prokam debe administrarse mediante inyección intraocular en la cámara anterior del ojo (inyección intracameral), por un cirujano oftálmico, en las condiciones asépticas recomendadas de la cirugía de catarata.
Debe inspeccionarse visualmente la solución reconstituida, utilizándose solamente si es una solución incolora a amarillenta y sin partículas visibles.
Tras la reconstitución, el producto debe utilizarse inmediatamente y no debe reutilizarse.
La dosis recomendada para cefuroxima es 1 mg en 0,1 ml de solución para inyección de cloruro de sodio 9 mg/ml (0,9%).
NO INYECTAR MÁS DE LA DOSIS RECOMENDADA.
El vial es para un solo uso.
Solamente un vial para cada paciente. Pegar la etiqueta desprendible del vial en la documentación del paciente.
Para preparar Prokampara la administración intracameral, seguir las instrucciones siguientes: | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tras su uso, desechar el sobrante de la solución reconstituida. No guardarla para un posterior uso. |
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. Desechar las agujas utilizadas en un contenedor para objetos punzantes.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a PROKAM 50 MG POLVO PARA SOLUCION INYECTABLEForma farmacéutica: COLIRIO, 3,35 mg azitromicina dihidratoPrincipio activo: AzitromicinaFabricante: Laboratoires TheaRequiere recetaForma farmacéutica: COLIRIO, 0,3 % gentamicinaPrincipio activo: GentamicinaFabricante: Ntc S.R.L.Requiere recetaForma farmacéutica: GEL OFTALMICO, 10 MG/GPrincipio activo: Fusidico acidoFabricante: Amdipharm LimitedRequiere receta
Médicos online para PROKAM 50 MG POLVO PARA SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de PROKAM 50 MG POLVO PARA SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes