PERGOVERIS 150 UI/75 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Cómo usar PERGOVERIS 150 UI/75 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Pergoveris 150 UI/75 UI polvo y disolvente para solución inyectable
folitropina alfa/lutropina alfa
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Pergoveris y para qué se utiliza
- Qué necesita saber antes de empezar a usar Pergoveris
- Cómo usar Pergoveris
- Posibles efectos adversos
- Conservación de Pergoveris
- Contenido del envase e información adicional
1. Qué es Pergoveris y para qué se utiliza
Qué es Pergoveris
Pergoveris contiene dos principios activos diferentes denominados “folitropina alfa” y “lutropina alfa”. Ambos pertenecen a la familia de hormonas llamadas “gonadotropinas”, las cuales están implicadas en la reproducción y la fertilidad.
Para qué se utiliza Pergoveris
Este medicamento se utiliza para estimular el desarrollo de los folículos (cada uno conteniendo un óvulo) en los ovarios con el fin de ayudarla a quedarse embarazada. Está destinado al uso en mujeres adultas (18 años de edad o más) con niveles bajos (déficit grave) de “hormona foliculoestimulante” (FSH) y “hormona luteinizante” (LH). Normalmente, estas mujeres son infértiles.
Cómo actúa Pergoveris
Los principios activos de Pergoveris son copias de las hormonas naturales FSH y LH. En el cuerpo:
- la FSH estimula la producción de óvulos
- la LH estimula la liberación de los óvulos.
Al sustituir las hormonas ausentes, Pergoveris permite a las mujeres con niveles bajos de FSH y LH desarrollar un folículo, a partir del cual se liberará un óvulo, después de una inyección de la hormona “gonadotropina coriónica humana (hCG)”. Esto ayuda a las mujeres a quedarse embarazadas.
2. Qué necesita saber antes de empezar a usar Pergoveris
Antes de iniciar el tratamiento debe valorarse su fertilidad y la de su pareja por parte de un médico experimentado en el tratamiento de los trastornos de la fertilidad.
No use Pergoveris:
- si es alérgico a la hormona foliculoestimulante (FSH), a la hormona luteinizante (LH) o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- si tiene un tumor cerebral (en el hipotálamo o en la hipófisis).
- si tiene ovarios grandes o bolsas de líquido en el interior de los ovarios (quistes ováricos) de origen desconocido.
- si tiene hemorragia vaginal inexplicable.
- si tiene cáncer de ovarios, de útero o de mama.
- si tiene una afección que imposibilitaría un embarazo normal, como menopausia precoz, malformaciones de los órganos sexuales o tumores benignos en el útero.
No utilice este medicamento si alguna de las condiciones anteriores le aplica a usted. Si no está segura, consulte a su médico, farmacéutico o enfermero antes de empezar a usar este medicamento.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Pergoveris.
Porfiria
Consulte a su médico antes de iniciar el tratamiento, si usted o cualquier miembro de su familia padece porfiria (una incapacidad para degradar las porfirinas que puede transmitirse de padres a hijos).
Informe inmediatamente a su médico si:
- su piel se vuelve frágil y le salen ampollas con facilidad, especialmente en las zonas expuestas al sol con frecuencia.
- tiene dolor de estómago, de brazos o piernas.
En estos casos, su médico puede recomendarle interrumpir el tratamiento.
Síndrome de hiperestimulación ovárica (SHO)
Este medicamento estimula sus ovarios, lo que aumenta el riesgo de experimentar síndrome de hiperestimulación ovárica (SHO). Esto ocurre cuando sus folículos se desarrollan demasiado y se convierten en quistes de gran tamaño. Si tiene dolor en la región pélvica, aumenta de peso rápidamente, tiene náuseas o vómitos o dificultad para respirar, consulte inmediatamente con su médico, quien puede ordenarle interrumpir el tratamiento (ver en la sección 4, en “Efectos adversos más graves”).
En caso de que no ovule y si se respetan la dosis y la pauta posológica recomendadas, el SHO grave es menos probable que ocurra. El tratamiento con Pergoveris rara vez causa SHO grave. Esto es más probable si se administra el medicamento que se usa para la maduración folicular final (que contiene gonadotropina coriónica humana, hCG) (ver detalles en la sección 3, en “Qué cantidad se debe usar”). En caso de desarrollar SHO, su médico puede no recetarle hCG en este ciclo de tratamiento y aconsejarle que se abstenga de realizar el coito o que utilice un método anticonceptivo de barrera durante al menos 4 días.
Su médico asegurará un control cuidadoso de la respuesta ovárica, mediante ecografías y análisis de sangre (determinaciones del estradiol), antes y durante el tratamiento.
Embarazo múltiple
Si usa Pergoveris, tiene un riesgo más alto de quedarse embarazada de más de un niño a la vez (“embarazo múltiple”, generalmente gemelos) que si se queda embarazada por concepción natural. El embarazo múltiple puede causar complicaciones médicas para usted y sus bebés. Usted puede reducir el riesgo de embarazo múltiple usando la dosis correcta de Pergoveris a las horas correctas.
Para minimizar el riesgo de embarazo múltiple, se recomienda realizar ecografías y análisis de sangre.
Aborto
Si se somete a estimulación de sus ovarios para producir óvulos, la probabilidad de tener un aborto es mayor que en el promedio de las mujeres.
Embarazo ectópico
Las mujeres que han sufrido alguna vez bloqueo o daños de las trompas de Falopio (enfermedad tubárica) presentan riesgo de embarazo con implantación del embrión fuera del útero (embarazo ectópico). Esto es así tanto si el embarazo es por concepción espontánea como si se logra mediante tratamientos de fertilidad.
Problemas de coagulación de la sangre (episodios tromboembólicos)
Consulte a su médico antes de empezar a usar Pergoveris si usted o algún miembro de su familia ha sufrido alguna vez coágulos de sangre en la pierna o en el pulmón, infarto de miocardio o ictus. Podría tener un riesgo más alto de sufrir coágulos de sangre graves o de empeoramiento de los coágulos existentes con el tratamiento con Pergoveris.
Tumores de los órganos sexuales
Se han comunicado tumores en los ovarios y en otros órganos sexuales, tanto benignos como malignos, en mujeres que han sido sometidas a múltiples pautas para el tratamiento de la infertilidad.
Reacciones alérgicas
Se han comunicado casos aislados de reacciones alérgicas no graves a Pergoveris. Si usted ha tenido alguna vez este tipo de reacción con un medicamento similar, consulte a su médico antes de empezar a usar Pergoveris.
Niños y adolescentes
Pergoveris no debe utilizarse en niños y adolescentes menores de 18 años de edad.
Otros medicamentos y Pergoveris
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
No use Pergoveris con otros medicamentos en la misma inyección, excepto con folitropina alfa, si se la prescribe su médico.
Embarazo y lactancia
No use Pergoveris si está embarazada o en periodo de lactancia.
Conducción y uso de máquinas
No se espera que este medicamento afecte a su capacidad para conducir o utilizar máquinas.
Pergoveris contiene sodio
Pergoveris contiene menos de 1 mmol de sodio (23 mg) por dosis; esto es, esencialmente “exento de sodio”.
3. Cómo usar Pergoveris
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Uso de este medicamento
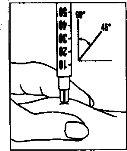
- Pergoveris está diseñado para ser inyectado justo debajo de la piel (por vía subcutánea). Para minimizar la irritación cutánea, seleccione un lugar de inyección diferente cada día.
- Se presenta en forma de polvo y líquido, que debe mezclar y usar de forma inmediata.
- Su médico o enfermero le enseñará a preparar e inyectarse este medicamento. Ellos supervisarán su primera inyección.
- Si están conformes con que pueda administrarse Pergoveris con seguridad, en adelante podrá preparar e inyectarse el medicamento usted misma en casa. Cuando lo haga, lea y siga atentamente las instrucciones descritas a continuación en la sección “Cómo preparar y usar el polvo y disolvente de Pergoveris”.
Qué cantidad se debe usar
La dosis inicial habitual es de 1 vial de Pergoveris cada día.
- En función de la respuesta, su médico puede decidir añadir diariamente una dosis de un preparado de folitropina alfa autorizado a la inyección de Pergoveris. En este caso, normalmente la dosis de folitropina alfa se incrementa cada 7 ó 14 días en 37,5-75 UI.
- El tratamiento continúa hasta que se obtenga la respuesta deseada. Esto sucede cuando ha desarrollado un folículo adecuado, evaluado mediante ecografías y análisis de sangre.
- Pueden ser necesarias hasta cinco semanas.
Cuando se obtenga la respuesta deseada, se le administrará una inyección única de gonadotropina coriónica humana (hCG) de 24 a 48 horas después de su última inyección de Pergoveris. El mejor momento para mantener relaciones sexuales es el mismo día de la inyección de hCG y al día siguiente. Como alternativa, también puede realizarse inseminación intrauterina u otro procedimiento de reproducción médicamente asistida, a criterio de su médico.
Si se obtiene una respuesta excesiva, se interrumpirá su tratamiento y no le administrarán hCG (ver en la sección 2, en “Síndrome de hiperestimulación ovárica (SHO)”). En este caso, su médico le recetará una dosis de folitropina alfa más baja en el ciclo siguiente.
Cómo preparar y usar el polvo y disolvente de Pergoveris
Antes de comenzar la preparación, lea primero íntegramente estas instrucciones:
Póngase la inyección a la misma hora cada día.
- Lávese las manos y busque un lugar limpio
- Es importante que sus manos y los materiales que utilice estén lo más limpios posible
- Un lugar adecuado es una mesa limpia o una superficie de la cocina
- Reúna y disponga todo lo que vaya a necesitar
- 1 vial que contiene el polvo de Pergoveris
- 1 vial que contiene el agua para preparaciones inyectables (disolvente)
No se suministra en el envase:
- 2 torundas empapadas en alcohol
- 1 jeringa vacía para inyección
- 1 aguja para la preparación
- 1 aguja fina para la inyección debajo de la piel
- un recipiente para objetos cortantes para desechar con precaución los envases de vidrio y las agujas
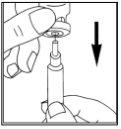
- Preparación de la solución
|
|
|
|
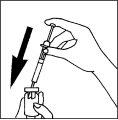
- Preparación de la jeringa para la inyección
|
|
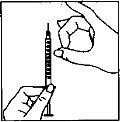
- Inyección de la dosis
|
|
- Después de la inyección
Deseche todo el material: Una vez finalizada la inyección, deseche inmediatamente todas las agujas y viales vacíos en el recipiente para objetos cortantes. Debe desecharse cualquier porción de la solución no utilizada.
Si usa más Pergoveris del que debe
Se desconocen los efectos de una sobredosis de Pergoveris; sin embargo, puede esperarse que se produzca un SHO. No obstante, esto sólo ocurrirá si se administra hCG (ver en la sección 2, en “Síndrome de hiperestimulación ovárica (SHO)”).
Si olvidó usar Pergoveris
No use una dosis doble para compensar las dosis olvidadas. Póngase en contacto con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos más graves
Consulte a su médico inmediatamente si advierte alguno de los efectos adversos que se listan a continuación. El médico podría decirle que deje de usar Pergoveris.
Reacciones alérgicas
Las reacciones alérgicas, como erupción cutánea, enrojecimiento de la piel, ampollas, hinchazón de la cara con dificultad para respirar, a veces pueden ser graves. Este efecto adverso es muy raro.
Síndrome de hiperestimulación ovárica (SHO)
- Dolor pélvico, acompañado de náuseas o vómitos. Pueden ser síntomas del síndrome de hiperestimulación ovárica (SHO). Es posible que sus ovarios hayan reaccionado de forma excesiva al tratamiento y se hayan desarrollado quistes ováricos o bolsas de líquido de gran tamaño (ver en la sección 2 en “Síndrome de hiperestimulación ovárica (SHO)”). Este efecto adverso es frecuente. Si le ocurre esto, su médico tendrá que explorarla lo antes posible.
- El SHO puede agravarse con ovarios claramente aumentados de tamaño, disminución de la producción de orina, aumento de peso, dificultad para respirar y/o posible acumulación de líquido en el abdomen o en el pecho. Este efecto adverso es poco frecuente (puede afectar hasta 1 de cada 100 personas).
- Las complicaciones del SHO como torsión ovárica o coagulación de la sangre se dan en raras ocasiones (pueden afectar hasta 1 de cada 1 000 personas).
- Los problemas de coagulación de la sangre graves (episodios tromboembólicos), normalmente con SHO grave, se dan muy raramente. Esto podría causar dolor en el pecho, sensación de falta de aire, ictus o infarto de miocardio. En casos raros esto también podría suceder independientemente del SHO (ver en la sección 2 en “Problemas de coagulación de la sangre (episodios tromboembólicos)”).
Otros efectos adversos
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
- bolsas de líquido en el interior de los ovarios (quistes ováricos)
- dolor de cabeza
- reacciones locales en el lugar de inyección como dolor, picor, moratones, hinchazón o irritación.
Frecuentes (pueden afectar hasta 1 de cada 10 personas)
- diarrea
- dolor en el pecho
- náuseas o vómitos
- dolor abdominal o pélvico
- calambres o distensión abdominal
Muy raros (pueden afectar hasta 1 de cada 10 000 personas)
- el asma puede empeorar.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Pergoveris
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en los viales y en la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25 ºC. Conservar en el embalaje original para protegerlo de la luz.
El medicamento debe administrarse inmediatamente después de la reconstitución.
No utilice Pergoveris si observa signos visibles de deterioro.
La solución reconstituida no debe administrarse si contiene partículas o no es límpida.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Pergoveris
Los principios activos son folitropina alfa y lutropina alfa.
- Un vial contiene 150 UI de folitropina alfa (equivalente a 11 microgramos) y 75 UI de lutropina alfa (equivalente a 3 microgramos).
- Tras la reconstitución, cada ml de la solución contiene 150 UI de folitropina alfa y 75 UI de lutropina alfa por mililitro.
Los demás componentes son:
- Sacarosa, hidrogenofosfato de disodio dihidrato, dihidrogenofosfato de sodio monohidrato, metionina y polisorbato 20, así como ácido fosfórico concentrado e hidróxido sódico para ajuste del pH.
Aspecto del producto y contenido del envase
- Pergoveris se presenta como un polvo y disolvente para solución inyectable.
- El polvo es una pastilla liofilizada de color blanco a blanquecino en un vial de vidrio con tapón de goma de bromobutilo que contiene 150 UI (equivalente a 11 microgramos) de folitropina alfa y 75 UI (equivalente a 3 microgramos) de lutropina alfa.
- El disolvente es un líquido claro e incoloro en un vial de vidrio que contiene 1 ml de agua para preparaciones inyectables.
- Pergoveris se presenta en envases que contienen 1, 3 y 10 viales de polvo junto con el mismo número de viales de disolvente (1, 3 y 10 viales). Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Merck Europe B.V., Gustav Mahlerplein 102, 1082 MA Amsterdam, Países Bajos
Responsable de la fabricación
Merck Serono S.p.A, Via delle Magnolie 15 (Zona industriale), 70026 Modugno (Bari), Italia
Fecha de la última revisión de este prospecto: {MM/AAAA}.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a PERGOVERIS 150 UI/75 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 300 UI/150 UIPrincipio activo: combinationsFabricante: Merck Europe B.V.Requiere recetaForma farmacéutica: INYECTABLE, 450 UI/225 UIPrincipio activo: combinationsFabricante: Merck Europe B.V.Requiere recetaForma farmacéutica: INYECTABLE, 900 UI/450 UIPrincipio activo: combinationsFabricante: Merck Europe B.V.Requiere receta
Médicos online para PERGOVERIS 150 UI/75 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de PERGOVERIS 150 UI/75 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes