
MENOPUR 75 UI POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE

Cómo usar MENOPUR 75 UI POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
Menopur75 Unidades Internacionales polvo y disolvente para solución inyectable
Lea todo el prospecto detenidamente antes de empezar a utilizar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a usted, y no debe dárselo a otras personas aunque presenten los mismos síntomas de enfermedad que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. (Ver sección 4).
Contenido del prospecto
- Qué es Menopur y para qué se utiliza
- Qué necesita saber antes de empezar a usar Menopur
- Cómo usar Menopur
- Posibles efectos adversos
- Conservación de Menopur
- Contenido del envase e información adicional
1. Qué es Menopur y para qué se utiliza
Menopurse presenta en forma de polvo que debe mezclarse con líquido (disolvente) antes de su uso. Se administra como una inyección debajo de la piel o en el músculo.
Menopur contiene dos hormonas llamadas hormona folículo estimulante (FSH) y hormona luteinizante (LH). La FSH y LH son hormonas naturales producidas tanto en hombres como en mujeres. Ayudan a que los órganos reproductores funcionen normalmente. La FSH y LH en Menopur se obtienen de la orina de mujeres posmenopáusicas. El principio activo está altamente purificado y se conoce como menotropina.
Menopur se utiliza para tratar la esterilidad femenina en las dos situaciones siguientes:
i Mujeres que no pueden quedarse embarazadas porque sus ovarios no producen óvulos (incluyendo síndrome de ovario poliquístico). Menopur se usa en mujeres que han sido tratadas con un medicamento llamado citrato de clomifeno para tratar su infertilidad, pero este medicamento no les ha causado efecto.
iiMujeres en programas de reproducción asistida (TRA) (incluyendo fecundación in vitro/transferencia embrionaria (FIV/TE), transferencia intratubárica de gametos (GIFT); e inyección intracitoplasmática de espermatozoides (ICSI)). Menopur ayuda a los ovarios a desarrollar muchos sacos de óvulos (folículos) donde un óvulo pueda desarrollarse (desarrollo folicular múltiple).
2. Que necesita saber antes de empezar a usar Menopur
Antes de comenzar el tratamiento con Menopur, usted y su pareja deben ser evaluados por un médico para ver las causas del problema de infertilidad. En particular, se le deberán controlar las siguientes enfermedades para que puedan administrarle el tratamiento más adecuado:
- Mal funcionamiento de la glándula tiroides y de la corteza de las glándulas suprarrenales
- Altos niveles de una hormona llamada prolactina (hiperprolactinemia)
- Tumores en la hipófisis (una glándula localizada en la base del cerebro)
- Tumores en el hipotálamo (un área localizada bajo la parte del cerebro llamada tálamo).
Si sabe que padece de alguna de las enfermedades listadas arriba, por favor comuníqueselo a su médico antes de comenzar el tratamiento con Menopur.
No use Menopur:
- Si es alérgico (hipersensible) a la Menopur o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si tiene un tumor en el útero, ovarios, mamas, o algunas partes del cerebro como el hipotálamo-hipófisis
- Si tiene sacos de quistes de líquido (quistes ováricos) en los ovarios o ovarios agrandados (a menos que sea causado por una enfermedad de ovario poliquístico)
- si tiene malformaciones en los órganos sexuales o matriz (útero)
- si presenta sangrado vaginal de causa desconocida
- si tiene fibromas (tumores benignos) en el útero (matriz)
- si está embaraza o en periodo de lactancia
- si tiene menopausia precoz.
Advertencias y precauciones
Informe a su médico si tiene:
- Dolor en el abdomen
- Hinchazón del abdomen
- Náuseas
- Vómitos
- Diarrea
- Ganancia de peso
- Dificultad para respirar
- Disminución de la orina.
Consulte directamente con su médico, incluso si los síntomas se desarrollan algunos días después de que se haya administrado la última inyección. Estos pueden ser signos de altos niveles de actividad en los ovarios que pueden convertirse en graves.
Si estos síntomas se vuelven graves, el tratamiento de infertilidad debe retirarse y debe recibir tratamiento en un hospital.
Manteniendo la dosis recomendada y un seguimiento cuidadoso del tratamiento se reducirá la probabilidad de padecer estos síntomas.
Si deja de usar Menopurpuede experimentar aún estos síntomas. Por favor contacte con su médico inmediatamente si sufre cualquiera de estos síntomas.
Mientras esté en tratamiento con este medicamento, su médico normalmente le realizará ecografíasy algunas veces análisis de sangrepara controlar su respuesta al tratamiento.
Cuando se está tratado con hormonas como Menopur se puede incrementar el riesgo de:
- Embarazo ectópico (embarazo fuera de la matriz) si tiene historial de enfermedad en las trompas de Falopio
- Aborto
- Embarazo múltiple (gemelos, trillizos, etc.)
- Malformaciones congénitas (defectos físicos presentados en el bebé al nacer).
Algunas mujeres que han sido tratadas con varios medicamentos por infertilidad han desarrollado tumores en los ovarios y otros órganos reproductores. No se conoce aún si el tratamiento con hormonas como este Menopur causan estos problemas.
Es más probable que se formen coágulos dentro de los vasos sanguíneos (venas o arterias) en mujeres embarazadas. El tratamiento de infertilidad puede incrementar la probabilidad de que esto ocurra, especialmente si usted tiene sobrepeso o enfermedad de coagulación de la sangre conocida (trombofilia) o si usted o algún familiar (consanguíneo) ha tenido problemas de coagulación. Si piensa que esto le puede suceder, informe a su médico.
Uso en niños
Menopur no tiene indicaciones adecuadas para su uso en niños.
Otros medicamentos y Menopur
Comunique a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
El citrato de clomifeno es otro medicamento usado en el tratamiento de infertilidad. Si Menopur se usa al mismo tiempo que el citrato de clomifeno, el efecto en los ovarios se puede incrementar.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, o cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Menopur no está indicado en ningún caso para tratar mujeres embarazadas o en periodo de lactancia.
Conducción y uso de máquinas
Es muy raro que Menopur afecte a la capacidad de conducir y utilizar máquinas.
Información importante sobre alguno de los componentes de Menopur:
Menopur contiene menos de 1 mmol de sodio (23 mg) por dosis, por tanto está esencialmente libre de sodio.
3. Cómo usar Menopur
Siga exactamente las instrucciones de administración de Menopur indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
- Mujeres que no ovulan (no producen óvulos):
El tratamiento comenzará dentro de los 7 días iniciales del ciclo menstrual (día 1 es el primer día del periodo). El tratamiento deberá administrarse cada día durante al menos 7 días.
La dosis inicial es normalmente 75-150 UI diarias (1-2 viales), que podrá ajustarse de acuerdo a la respuesta individual de la paciente (hasta un máximo de 225 UI, 3 viales de polvo). Esta dosis individual deberá administrarse al menos 7 días antes de ajustarse la dosis por el médico. El incremento de dosis recomendada es 37,5 UI por ajuste, y no deberá exceder 75 UI. El ciclo de tratamiento se deberá abandonar si no responde adecuadamente después de 4 semanas.
Cuando se obtenga una respuesta óptima, se administrará una inyección única de otra hormona llamada gonadotropina coriónica humana (hCG), de 5.000 a 10.000 UI, un día después de la última inyección de Menopur. Se recomienda a la paciente tener coitos el mismo día y el día siguiente a la administración de gonadotropina coriónica humana. Se puede realizar inseminación intrauterina (inyección de esperma directamente en la matriz) alternativamente. Su médico deberá seguir su progreso muy de cerca durante al menos 2 semanas después de la administración de hCG.
Su médico controlará el efecto del tratamiento de Menopur. Dependiendo del progreso, su médico decidirá interrumpir el tratamiento con Menopur y no administrarle la inyección de hCG. En este caso, debe utilizar un método anticonceptivo (preservativo) o no tener relaciones sexuales hasta que comience el próximo periodo.
ii. Mujeres en programas de reproducción asistida:
Si usted está también recibiendo tratamiento con agonistas de GnRH, el tratamiento con Menopur deberá comenzar aproximadamente 2 semanas después de iniciar el tratamiento con agonistas de GnRH.
Si usted está también recibiendo tratamiento con antagonistas de GnRH, el tratamiento con Menopur deberá comenzar el día 2 ó 3 del ciclo menstrual (día 1 es el primer día del periodo).
Menopur se administrará diariamente durante al menos 5 días. La dosis inicial recomendada de Menopur es 150-225 UI (2-3 viales de polvo).
Esta dosis puede incrementarse de acuerdo con su respuesta al tratamiento hasta un máximo de 450 UI (6 viales) al día. La dosis no deberá incrementarse más de 150 UI por ajuste. Normalmente, el tratamiento no se recomienda durante más de 20 días.
Si hay suficientes sacos de óvulos (folículos), se administrará una inyección única de un medicamento llamado gonadotropina coriónica humana (hCG) a una dosis de hasta 10.000 UI para inducir la ovulación (liberación de un óvulo).
Su médico deberá seguir su progreso muy de cerca durante al menos 2 semanas después de la administración de hCG.
Su médico controlará el efecto del tratamiento de Menopur. Dependiendo del progreso, su médico decidirá interrumpir el tratamiento con Menopur y no administrarle la inyección de hCG. En este caso, debe utilizar un método anticonceptivo (preservativo) o no tener relaciones sexuales hasta que comience el próximo periodo.
INSTRUCCIONES DE USO:
Si su médico le dice que se inyecte Menopur usted mismo, deberá seguir cualquier indicación que le proporcione.
La primera inyección de este medicamento deberá administrarse bajo la supervisión de un médico o enfermera.
RECONSTITUCIÓN DE MENOPUR
Menopur se proporciona como un polvo y se debe reconstituir antes de su inyección. El disolvente (líquido) que debe usarse para reconstituir este medicamento se proporciona junto con el polvo. Menopur sólo debe reconstituirse inmediatamente antes de su uso. Se debe reconstituir como se muestra a continuación:
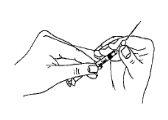 Ajuste firmemente la aguja larga y delgada (aguja de preparación/ reconstitución) a la jeringa.
Ajuste firmemente la aguja larga y delgada (aguja de preparación/ reconstitución) a la jeringa.
- Abra la ampolla del líquido (disolvente) con el punto mirando hacia usted.
- Inserte la aguja en la ampolla de disolvente.
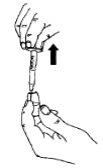 Retire todo el líquido de la ampolla a la jeringa.
Retire todo el líquido de la ampolla a la jeringa.
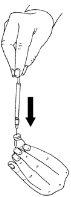
- Inserte la aguja a través del tapón de goma del vial de polvo e inyecte suavemente todoel líquido. Hágalo en un lado del vial, para evitar la formación de burbujas.
- El polvo se disolverá rápidamente (en 2 minutos) formando una solución transparente. Aunque esto normalmente ocurre cuando se han añadido solo unas pocas gotas del disolvente, se debe añadir toda la cantidad de disolvente de la ampolla.
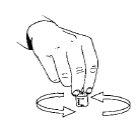
- Para ayudar a la disolución del polvo, remueva la solución. No agitar,ya que puede causar burbujas de aire. No debe utilizarla solución reconstituida si contiene partículas o si no está transparente.
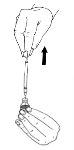
- Retire la solución con la jeringa.
Si se le ha prescrito más de un vial de Menopur polvo para inyección, puede retirar la solución (la primera disolución de Menopur) de nuevo en la jeringa e inyectarlo en un segundo vial de polvo. Puede realizarse esto hasta en tres viales de polvo en total, pero sólo se debe hacer como le haya comentado el médico.
INYECCIÓN DE MENOPUR
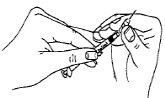
- Una vez tenga su dosis prescrita retirada en la jeringa, cambie la aguja (de preparación/ reconstitución) por una aguja corta y delgada (aguja de inyección).
- Coloque la jeringa boca arriba y golpéela suavemente para que las burbujas de aire se queden en la parte superior. Empuje despacio el émbolo hasta que salga todo el aire y aparezca en la punta de la aguja una gota de la solución.
- Su médico o enfermera le dirá donde inyectarse (por ejemplo en parte frontal del muslo, abdomen etc.).
- Desinfecte el lugar de la inyección.
- Para inyectar, pellizque la piel para producir un pliegue, e inserte la aguja en un movimiento rápido a 90 grados del cuerpo. Presione el émbolo para inyectar la disolución, y después retire la a
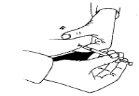 guja.
guja.
- Tras retirar la aguja, aplique presión al lugar de inyección para evitar el sangrado. Un masaje cuidadoso en el lugar de inyección ayudará a dispersar la solución bajo la piel.
- No tirar el material usado en la basura; deberá desecharse correctamente.
Si usa más Menopur del que debe
En caso de sobredosis o si se traga la solución por accidente, consulte inmediatamente a su médico o farmacéutico o llame al Servicio de Información Toxicológica, teléfono 91 562 04 20, indicando el medicamento y la cantidad utilizada.
Si olvidó usar Menopur,no se administre una dosis doble para compensar las dosis olvidadas. Por favor, dígaselo a su médico o farmacéutico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico
4. Posibles efectos adversos
Al igual que todos los medicamentos Menopurpuede producir efectos adversos, aunque no todas las personas los sufran.
El tratamiento con Menopur puede causar altos niveles de actividad en los ovarios, que pueden dar lugar a una enfermedad llamada Síndrome del Hiperestimulación Ovárica (SHO), especialmente en mujeres con ovarios poliquísticos. Los síntomas incluyen: distensión y molestia en el abdomen, náusea, vómito, diarrea, ganancia de peso. En algunos casos graves de SHO se han notificado como complicaciones raras la acumulación de fluido en el abdomen, pelvis y/o en la cavidad pleural, dificultad para respirar y disminución de la cantidad de orina. formación de coágulos de sangre en los vasos sanguíneos (tromboembolismo) y torsión de los ovarios. Si experimenta cualquiera de estos síntomas, por favor contacte inmediatamente con su médico, incluso si se desarrollan algunos días después de la administración de la última inyección.
Pueden producirse reacciones alérgicas (hipersensibilidad), cuando se usa este medicamento. Los síntomas de estas reacciones pueden incluir: erupción, picor, hinchazón de la garganta y dificultad para respirar.Si experimenta cualquiera de estos síntomas contacte inmediatamente con su médico.
Los siguientes efectos adversos frecuentes afectan entre 1 y 10 de cada 100 pacientes tratados):
- Dolor abdominal
- Dolor de cabeza
- Nauseas
- Hinchazón (plenitud) abdominal
- Dolor pélvico
- Hiperestimulación de los ovarios que dan como resultado altos niveles de actividad (Síndrome de Hiperestimulación Ovárica)
- Reacciones locales en el lugar de inyección (como dolor enrojecimiento, contusión, hinchazón y/o irritación).
Los siguientes efectos adversos poco frecuentes afectan entre 1 y 10 de cada 1.000 pacientes tratados:
- Vómitos
- Molestia en el abdomen
- Diarrea
- Fatiga
- Mareo
- Sacos de fluido dentro de los ovarios (quiste ovárico)
- Complicaciones en las mamas (incluye dolor de pecho, tensión mamaria, molestia en las mamas, dolor del pezón e hinchazón del pecho)
- Sofocos
Los siguientes efectos adversos raros afectan entre 1 y 10 de cada 10.000 pacientes tratados:
- Acné
- Erupción cutánea
Además de los efectos adversos indicados arriba se han comunicado tras la comercialización de Menopur y con una frecuencia desconocida, los siguientes efectos adversos:
- Alteraciones en la visión
- Fiebre
- Sentirse mal
- Reacciones alérgicas
- Incremento del peso
- Dolor en el músculo y articulaciones (por ejemplo dolor de espalda, cuello, brazos y piernas)
- Torsión de los ovarios como una complicación del incremento de la actividad de los ovarios debido a la hiperestimulación.
- Prurito
- Urticaria
- Coágulos de sangre como una complicación del incremento de actividad de los ovarios debido a una hiperestimulación.
Si experimenta algún efecto adverso, hable con su médico o enfermero. Esto incluye cualquier efecto secundario no mencionado en este prospecto.
Comunicación de efectos adversos.
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. Tambien puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano https:www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
.
5. Conservación de Menopur
No conservar a temperatura superior a 25 º C. No congelar.
Conservar en el embalaje exterior para protegerlo de la luz.
Para uso inmediato y único después de la reconstitución.
Mantener fuera de la vista y del alcance de los niños
No utilice Menotropina Ferring después de la fecha de caducidad que aparece en la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición deMenopur
El principio activo es menotropina altamente purificada (gonadotropina menopáusica humana, hMG) que corresponde a 75 UI de actividad hormona folículo estimulante (FSH) y 75 UI de actividad hormona luteinizante (LH).
Los demás componentes del polvo son: lactosa monohidrato, polisorbato 20, hidróxido de sodio y ácido clorhídrico.
Los componentes del disolvente son: cloruro de sodio, ácido clorhídrico diluido, hidróxido de sodio y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Menopur es un polvo y disolvente para solución inyectable.
El envase contiene cinco o diez viales de vidrio transparente que contiene un polvo liofilizado apelmazado blanco a grisáceo. El envase, además, contiene un número igual de ampollas de vidrio transparente que contiene el disolvente, solución transparente incolora, para su reconstitución.
Puede que solamente estén comercializados algunos tamaños de envase
Titular de la Autorización de Comercialización y responsable de la fabricación:
Titular de la autorización de comercialización
Ferring, S.A.U
C/ del Arquitecto Sánchez Arcas nº3, 1º
28040 Madrid
España
Responsable de la fabricación:
FERRING GmbH
Wittland 11,
D-24109 Kiel
Alemania
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeocon los siguientes nombres:
Bélgica, Irlanda, Luxemburgo, Eslovaquia: Menotrophin Ferring
República Checa: Menotrophin Ferring-Léciva
Bulgaria, Croacia, Chipre, Dinamarca, Estonia, Finlandia, Alemania, Grecia, Hungria, Islandia, Letonia, Lituania, Malta, Noruega, Portugal, Rumania, Eslovenia, España, Suecia: Menopur
Italia: Meropur
Fecha de la última revisión de este prospecto mayo 2025.
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a MENOPUR 75 UI POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLEForma farmacéutica: INYECTABLE, -Principio activo: human menopausal gonadotrophinFabricante: Angelini Pharma Espana S.L.Requiere recetaForma farmacéutica: INYECTABLE, 1200 UIPrincipio activo: human menopausal gonadotrophinFabricante: Ferring S.A.Requiere recetaForma farmacéutica: INYECTABLE, 1.200 UIPrincipio activo: human menopausal gonadotrophinFabricante: Ferring S.A.U.Requiere receta
Médicos online para MENOPUR 75 UI POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de MENOPUR 75 UI POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes






