LYFNUA 45 MG COMPRIMIDOS RECUBIERTOS CON PELICULA

Cómo usar LYFNUA 45 MG COMPRIMIDOS RECUBIERTOS CON PELICULA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
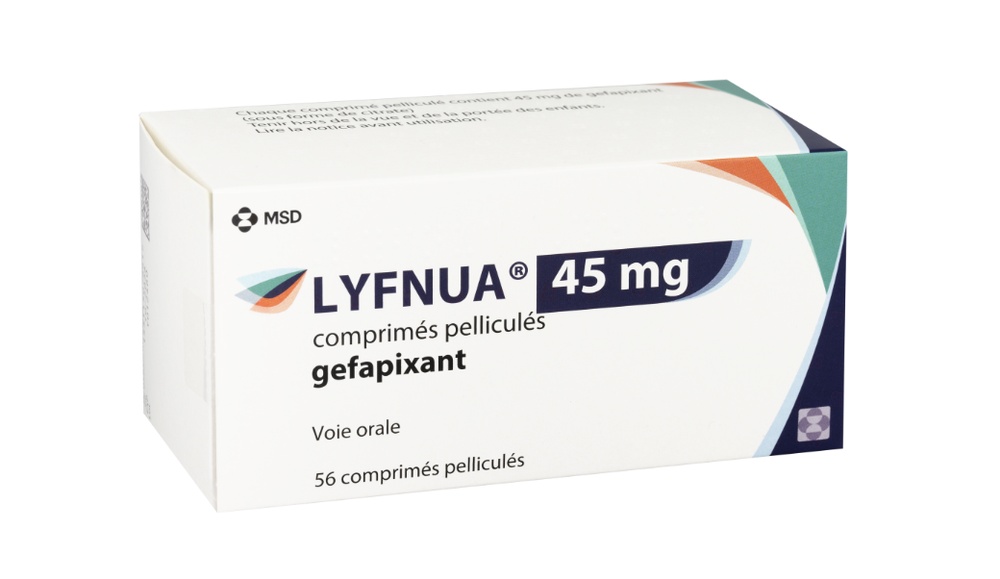
Lyfnua 45mg comprimidos recubiertos con película
gefapixant
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Lyfnua y para qué se utiliza
- Qué necesita saber antes de empezar a tomar Lyfnua
- Cómo tomar Lyfnua
- Posibles efectos adversos
- Conservación de Lyfnua
- Contenido del envase e información adicional
1. Qué es Lyfnua y para qué se utiliza
Lyfnua contiene el principio activo gefapixant.
Lyfnua es un medicamento que se utiliza en adultos para la tos crónica (tos que dura más de 8 semanas) y:
- la tos no desaparece incluso después de utilizar otros medicamentos o
- se desconoce la razón de la tos.
El principio activo de Lyfnua, gefapixant, bloquea la acción de los nervios que provocan la tos anormal.
2. Qué necesita saber antes de empezar a tomar Lyfnua
No tome Lyfnua
- sí es alérgicoa gefapixant o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar y mientras esté tomando Lyfnua si:
- es alérgicoa medicamentos que contienen sulfonamida
- tiene apnea del sueño– en la que su respiración se detiene y vuelve a empezar mientras duerme
- desarrolla una infección aguda del pulmón/sistema respiratorio inferior (por ejemplo, neumonía o bronquitis)
- percibe un cambio en el sabor de las cosas, pérdida del gustoo menos capacidad para saborear, que continúa incluso después de dejar de tomar Lyfnua.
Niños y adolescentes
No dé este medicamento a niños y adolescentes menores de 18 años de edad. Esto es porque no se ha estudiado en este grupo de edad.
Otros medicamentos y Lyfnua
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
Embarazo y lactancia
Se desconoce si Lyfnua pueden dañar al feto. Por lo tanto, es mejor evitar el uso de Lyfnua si está embarazada.
Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de tomar este medicamento.
Los estudios en animales han demostrado que Lyfnua puede pasar a la leche materna. No se puede descartar un riesgo para su bebé. Usted y su médico deben decidir de forma conjunta si tomar Lyfnua o elegir la lactancia.
Conducción y uso de máquinas
Es posible que se sienta mareado después de tomar Lyfnua. Si esto ocurre, no conduzca ni utilice herramientas o máquinas hasta que deje de sentirse mareado.
Lyfnua contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por comprimido; esto es, esencialmente “exento de sodio”.
3. Cómo tomar Lyfnua
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Qué cantidad tomar
La dosis recomendada de Lyfnua es:
- un comprimido de 45 mg dos veces al día.
Adultos con problemas renales
Su médico puede cambiar la cantidad y la frecuencia con la que toma Lyfnua si:
- tiene insuficiencia renal grave y no está en diálisis.
Como se toma
Trague el comprimido entero. No parta, machaque ni mastique el comprimido.
Puede tomar el comprimido con o sin alimentos.
Si toma más Lyfnua del que debe
Si toma demasiado Lyfnua, contacte con un médico o farmacéutico inmediatamente.
Si olvidó tomar Lyfnua
Si olvida una dosis, sáltese esa dosis y tome la siguiente dosis a la hora programada.
No tome una dosis doble para compensar las dosis olvidadas.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los posibles efectos adversos son:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
- cambio en el sabor de las cosas (como sabor a: metálico, amargo o salado)
- tener menos capacidad degustativa
- pérdida del gusto
Frecuentes(pueden afectar a hasta 1 de cada 10 personas)
- sensación de ganas de vomitar (náuseas)
- sabor diferente de las cosas a como sabían antes
- tos (empeoramiento, aumento)
- boca seca
- infección de las vías respiratorias superiores (una infección en la parte superior de las vías respiratorias, que incluye la nariz y la garganta)
- diarrea
- dolor en la boca o la garganta
- tener menos hambre de lo habitual
- sentirse mareado
- dolor en la zona alta del abdomen (vientre)
- indigestión
- sensaciones inusuales en la boca (por ejemplo, hormigueo o sensación de picor)
- pérdida de sensibilidad en la boca
- aumento de la producción de saliva
- insomnio (dificultad para dormir)
- dolor de cabeza
Poco frecuentes(pueden afectar a hasta 1 de cada 100 personas)
- piedras en la vejiga, en la orina o en el riñón
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Lyfnua
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el blíster y la caja después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
No utilice este medicamento si observa que el envase está dañado o muestra signos de manipulación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Lyfnua
El principio activo es gefapixant. Cada comprimido recubierto con película contiene 45 mg de gefapixant (como citrato).
Los demás componentes son sílice (coloidal anhidra) (E 551), crospovidona (E 1202), hipromelosa (E 464), estearato de magnesio (E 470b), manitol (E 421), celulosa microcristalina (E 460), fumarato de estearilo y sodio. Los comprimidos están recubiertos con película con un material de recubrimiento que contiene los siguientes componentes: hipromelosa (E 464), dióxido de titanio (E 171), triacetina (E 1518) y óxido de hierro rojo (E 172). Los comprimidos están pulidos con cera de carnauba (E 903).
Aspecto del producto y contenido del envase
Lyfnua es un comprimido de color rosa, redondo y convexo, grabado con “777” en una cara y liso en la otra.
Lyfnua está disponible en blísteres de PVC/PE/PVdC de color blanco, opacos, con cubierta de lámina de aluminio de abertura a presión.
Lyfnua está disponible en envases de 28, 56 y 98 comprimidos recubiertos con película en blísteres no perforados (14 comprimidos por placa) y envases múltiples con 196 (2 envases de 98) comprimidos recubiertos con película en blísteres no perforados.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Merck Sharp & Dohme B.V.
Waarderweg 39
2031 BN Haarlem
Países Bajos
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien MSD Belgium Tél/Tel: +32(0)27766211 | Lietuva UAB Merck Sharp & Dohme Tel. +370 5 2780 247 |
| Luxembourg/Luxemburg MSD Belgium Tél/Tel: +32(0)27766211 |
Ceská republika Merck Sharp & Dohme s.r.o. Tel: +420 233 010 111 | Magyarország MSD Pharma Hungary Kft. Tel.: +36 1 888 5300 |
Danmark MSD Danmark ApS Tlf.: + 45 4482 4000 | Malta Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) |
Deutschland MSD Sharp & Dohme GmbH Tel.: +49 (0) 89 20 300 4500 | Nederland Merck Sharp & Dohme B.V. Tel: 0800 9999000 (+31 23 5153153) |
Eesti Merck Sharp & Dohme OÜ Tel: +372 614 4200 | Norge MSD (Norge) AS Tlf: +47 32 20 73 00 |
Ελλ?δα MSD Α.Φ.Ε.Ε. Τηλ: +30 210 98 97 300 | Österreich Merck Sharp & Dohme Ges.m.b.H. Tel: +43 (0) 1 26 044 |
España Merck Sharp & Dohme de España, S.A. Tel: +34 91 321 06 00 | Polska MSD Polska Sp. z o.o. Tel: +48 22 549 51 00 |
France MSD France Tél: + 33 (0) 1 80 46 40 40 | Portugal Merck Sharp & Dohme, Lda Tel: +351 21 4465700 |
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 | România Merck Sharp & Dohme Romania S.R.L. Tel: +40 21 529 29 00 |
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 | Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o. Tel: +386 1 520 4201 |
Ísland Vistor ehf. Sími: + 354 535 7000 | Slovenskárepublika Merck Sharp & Dohme, s. r. o. Tel: +421 2 58282010 |
Italia MSD Italia S.r.l. Tel: 800 23 99 89 (+39 06 361911) | Suomi/Finland MSD Finland Oy Puh/Tel: +358 (0)9 804 650 |
Κ?προς Merck Sharp & Dohme Cyprus Limited Τηλ.: 800 00 673 (+357 22866700) | Sverige Merck Sharp & Dohme (Sweden) AB Tel: +46 77 5700488 |
Latvija SIA Merck Sharp & Dohme Latvija Tel: + 371 67025300 |
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: https://www.ema.europa.eu
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a LYFNUA 45 MG COMPRIMIDOS RECUBIERTOS CON PELICULAForma farmacéutica: SOLUCIÓN/SUSPENSIÓN ORAL, 60 mgPrincipio activo: LevodropropizinaFabricante: Alfasigma Espana S.L.No requiere recetaForma farmacéutica: SOLUCIÓN/SUSPENSIÓN ORAL, 2,13 mg/mlPrincipio activo: pentoxyverineFabricante: Opella Healthcare Spain S.L.No requiere recetaForma farmacéutica: SOLUCIÓN/SUSPENSIÓN ORAL, 12,5 mg/ml + 9,09 mg/ml + 10 mg/mlPrincipio activo: combinationsFabricante: Kwizda Pharma GmbhNo requiere receta
Médicos online para LYFNUA 45 MG COMPRIMIDOS RECUBIERTOS CON PELICULA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de LYFNUA 45 MG COMPRIMIDOS RECUBIERTOS CON PELICULA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes