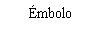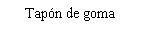LUCENTIS 10 MG/ML SOLUCION INYECTABLE EN JERINGA PRECARGADA


Cómo usar LUCENTIS 10 MG/ML SOLUCION INYECTABLE EN JERINGA PRECARGADA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto:información para el paciente
Lucentis 10mg/ml solución inyectable en jeringa precargada
ranibizumab
Lea todo el prospecto detenidamente antes deque le administren este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Lucentis y para qué se utiliza
- Qué necesita saber antes de que le administren Lucentis
- Cómo se administra Lucentis
- Posibles efectos adversos
- Conservación de Lucentis
- Contenido del envase e información adicional
1. Qué es Lucentis y para qué se utiliza
Qué es Lucentis
Lucentis es una solución que se inyecta en el ojo. Lucentis pertenece a un grupo de medicamentos denominados agentes antineovascularización. Contiene el principio activo denominado ranibizumab.
Para qué se utiliza Lucentis
Lucentis se utiliza en adultos para tratar varias enfermedades oculares que causan alteración de la visión.
Estas enfermedades son el resultado de una lesión en la retina (capa sensible a la luz en la parte posterior del ojo) provocada por:
- El crecimiento de vasos sanguíneos anómalos, que pierden líquido. Esto se observa en enfermedades como la degeneración macular asociada a la edad (DMAE) y la retinopatía diabética proliferativa (RDP, una enfermedad provocada por la diabetes). También puede ir asociado con la neovascularización coroidea (NVC) debida a miopía patológica (MP), estrías angioides, corioretinopatía serosa central o NVC inflamatoria.
- Edema macular (hinchazón del centro de la retina). La causa de este hinchazón puede ser la diabetes (una enfermedad conocida como edema macular diabético (EMD)) o un bloqueo de las venas retinianas de la retina (una enfermedad conocida como oclusión de la vena de la retina (OVR)).
Cómo actúa Lucentis
Lucentis reconoce y se une de forma específica a una proteína denominada factor de crecimiento endotelial vascular A (VEGF-A) humano presente en los ojos. En exceso, el VEGF-A causa el crecimiento de vasos sanguíneos anómalos e hinchazón en el ojo que puede ocasionar una alteración de la visión en enfermedades como DMAE, EMD, RDP, OVP, MP y NVC. Mediante la unión al VEGF-A, Lucentis puede impedir que actúe y prevenir dicho crecimiento e hinchazón anómalos.
En estas enfermedades, Lucentis puede ayudar a estabilizar y, en muchos casos, mejorar su visión.
2. Qué necesita saber antes de que le administren Lucentis
No le deben administrar Lucentis
- Si es alérgico al ranibizumab o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- Si tiene una infección en el ojo o alrededor del mismo.
- Si tiene dolor o enrojecimiento (inflamación intraocular grave) en el ojo.
Advertencias y precauciones
Consulte a su médico antes de que le administren Lucentis
- Lucentis se administra mediante una inyección en el ojo. Ocasionalmente, tras el tratamiento con Lucentis puede aparecer una infección en la parte interna del ojo, dolor o enrojecimiento (inflamación), desprendimiento o desgarro de una de las capas situadas en el fondo del ojo (desprendimiento o desgarro de la retina y desprendimiento o desgarro del epitelio pigmentario de la retina), o enturbiamiento del cristalino (catarata). Es importante identificar y tratar tal infección o desprendimiento de retina lo antes posible. Informe inmediatamente a su médico si nota signos como dolor en el ojo o aumento de las molestias en el ojo, si empeora el enrojecimiento en el ojo, visión borrosa o disminución de la visión, un aumento del número de pequeñas manchas en la visión o aumento de la sensibilidad a la luz.
- En algunos pacientes, después de la inyección la presión en el ojo puede aumentar durante un corto periodo de tiempo. Es posible que usted no se de cuenta de ello, por lo que puede que su médico le realice un seguimiento de la presión ocular después de cada inyección.
- Informe a su médico si ha tenido enfermedades en los ojos o ha recibido algún tratamiento en los ojos anteriormente, o si ha sufrido un accidente cerebrovascular o ha tenido signos pasajeros de accidente cerebrovascular (debilidad o parálisis de un miembro o cara, dificultad en el habla o en la comprensión). Esta información se tendrá en consideración para evaluar si Lucentis es el tratamiento apropiado para usted.
Para consultar información más detallada sobre los efectos adversos que podrían ocurrir durante el tratamiento con Lucentis, ver sección 4 (“Posibles efectos adversos”).
Niños y adolescentes (menores de 18años)
No se recomienda el uso de Lucentis en niños y adolescentes, ya que no se ha establecido en estos grupos de edad.
Otros medicamentos y Lucentis
Informe a su médico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
- Las mujeres que pudieran quedarse embarazadas deben utilizar un método anticonceptivo eficaz durante el tratamiento y durante al menos los tres meses posteriores a la última inyección de Lucentis.
- No hay experiencia en el uso de Lucentis en mujeres embarazadas. Lucentis no se debe usar durante el embarazo salvo que el beneficio potencial supere el riesgo potencial para el feto. Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes del tratamiento con Lucentis.
- Pequeñas cantidades de Lucentis pueden pasar a la leche materna, por lo que no se recomienda el uso de Lucentis durante la lactancia. Consulte a su médico o farmacéutico antes del tratamiento con Lucentis.
Conducción y uso de máquinas
Después del tratamiento con Lucentis usted puede experimentar visión borrosa temporalmente. Si esto le ocurre, no conduzca ni use máquinas hasta que este síntoma desaparezca.
3. Cómo se administra Lucentis
Lucentis se administra por el oftalmólogo en forma de inyección única en el ojo bajo anestesia local. La dosis habitual de una inyección es 0,05 ml (que contiene 0,5 mg de principio activo). La jeringa precargada contiene más cantidad que la dosis recomendada de 0,5 mg. El volumen extraíble no se administrará en su totalidad. El exceso de volumen se debe expulsar antes de la inyección. Si se inyecta todo el volumen de la jeringa precargada puede dar lugar a una sobredosis.
El intervalo entre dos dosis aplicadas en el mismo ojo debe ser como mínimo de cuatro semanas. Todas las inyecciones serán administradas por un oftalmólogo.
Para prevenir una infección, antes de la inyección su médico le lavará el ojo cuidadosamente. Su médico también le administrará un anestésico local para reducir o prevenir cualquier dolor que pudiera sentir con la inyección.
El tratamiento se inicia con una inyección de Lucentis cada mes. Su médico controlará la enfermedad de su ojo y dependiendo de cómo responda al tratamiento, decidirá si necesita o no recibir más tratamiento y cuándo necesita ser tratado.
Al final del prospecto en el apartado “Cómo preparar y administrar Lucentis” se dan instrucciones detalladas de uso.
Pacientes de edad avanzada (65años y mayores)
Lucentis puede utilizarse en personas de 65 años de edad o más, y no es necesario un ajuste de la dosis.
Antes de interrumpir el tratamiento con Lucentis
Si usted se está planteando interrumpir el tratamiento con Lucentis, acuda a la siguiente consulta y coméntelo antes con su médico. Su médico le aconsejará y decidirá durante cuánto tiempo deberá ser tratado con Lucentis.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos asociados con la administración de Lucentis se deben o al propio medicamento o al procedimiento de inyección y la mayoría afectan al ojo.
A continuación se describen los efectos adversos más graves:
Efectos adversos graves frecuentes(pueden afectar hasta 1 de cada 10 pacientes): Desprendimiento o desgarro de una capa en la parte interna del ojo (desprendimiento o desgarro de la retina), que da como resultado destellos de luz con partículas flotantes que progresan a una pérdida de visión transitoria o a un enturbiamiento del cristalino (catarata).
Efectos adversos graves poco frecuentes(pueden afectar hasta 1 de cada 100 pacientes): Ceguera, infección del globo ocular (endoftalmitis) con inflamación de la parte interna del ojo.
Los síntomas que podría experimentar son dolor o aumento de las molestias en el ojo, si empeora el enrojecimiento en el ojo, visión borrosa o disminución de la visión, un aumento del número de pequeñas manchas en la visión o aumento de la sensibilidad a la luz. Informe a su médico inmediatamente si presenta alguno de estos efectos adversos.
A continuación se describen los efectos adversos comunicados más frecuentemente:
Efectos adversos muy frecuentes(pueden afectar a más de 1 de cada 10 pacientes)
Los efectos adversos oculares incluyen: Inflamación del ojo, sangrado en la parte posterior del ojo (hemorragia en la retina), alteraciones visuales, dolor en el ojo, pequeñas partículas o manchas en la visión (partículas flotantes), sangre en el ojo, irritación del ojo, sensación de tener algo dentro del ojo, aumento de la producción de lágrima, inflamación o infección en el borde de los párpados, ojo seco, enrojecimiento o picor en el ojo y aumento de la presión en el ojo.
Los efectos adversos no oculares incluyen: Dolor de garganta, congestión nasal, goteo nasal, dolor de cabeza y dolor en las articulaciones.
A continuación se describen otros efectos adversos que pueden ocurrir tras el tratamiento con Lucentis:
Efectos adversos frecuentes
Los efectos adversos oculares incluyen: Disminución de la nitidez de la visión, hinchazón de una sección del ojo (úvea, córnea), inflamación de la córnea (parte delantera del ojo), pequeñas marcas en la superficie del ojo, visión borrosa, sangrado en el lugar de inyección, sangrado en el ojo, secreción del ojo con picor, enrojecimiento e hinchazón (conjuntivitis), sensibilidad a la luz, molestias en el ojo, hinchazón del párpado, dolor en el párpado.
Los efectos adversos no oculares incluyen: Infección de las vías urinarias, recuento de glóbulos rojos bajo (con síntomas tales como cansancio, dificultad al respirar, mareo, palidez), ansiedad, tos, náuseas, reacciones alérgicas tales como erupción, urticaria, picor y enrojecimiento de la piel.
Efectos adversos poco frecuentes
Los efectos adversos oculares incluyen: Inflamación y sangrado en la parte anterior del ojo, acúmulo de pus en el ojo, cambios en la parte central de la superficie ocular, dolor o irritación en el lugar de inyección, sensación anormal en el ojo, irritación del párpado.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Lucentis
- Mantener este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en la caja después de CAD y en la etiqueta de la jeringa precargada después de EXP. La fecha de caducidad es el último día del mes que se indica.
- Conservar en nevera (entre 2°C y 8°C). No congelar.
- Antes de usar, la bandeja sellada se puede conservar a temperatura ambiente (25°C) durante un máximo de 24 horas.
- Conservar la jeringa precargada en su bandeja sin abrir en la caja para protegerla de la luz.
- No utilice ningún envase que esté dañado.
6. Contenido del envase e información adicional
Composición de Lucentis
- El principio activo es ranibizumab. Cada ml contiene 10 mg de ranibizumab. Una jeringa precargada contiene 0,165 ml, equivalente a 1,65 mg de ranibizumab. Esto aporta una cantidad utilizable que proporciona una dosis única de 0,05 ml, que contiene 0,5 mg de ranibizumab.
- Los demás componentes son α,α-trehalosa dihidrato; hidrocloruro de histidina monohidrato; histidina; polisorbato 20; agua para inyectables.
Aspecto del producto y contenido del envase
Lucentis es una solución inyectable contenida en una jeringa precargada. La jeringa precargada contiene 0,165 ml de una solución acuosa, estéril, transparente, de incolora a amarillo pardusco pálido. La jeringa precargada contiene más cantidad que la dosis recomendada de 0,5 mg. El volumen extraíble no se administrará en su totalidad. El exceso de volumen se debe expulsar antes de la inyección. Si se inyecta todo el volumen de la jeringa precargada puede dar lugar a una sobredosis.
El tamaño de envase es de una jeringa precargada, envasada en una bandeja contenedora sellada. La jeringa precargada es para un solo uso.
Titular de la autorización de comercialización
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlanda
Responsable de la fabricación
Novartis Pharma GmbH
Roonstrasse 25
90429 Nuremberg
Alemania
Novartis Manufacturing NV
Rijksweg 14
2870 Puurs-Sint-Amands
Bélgica
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nürnberg
Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 | Lietuva SIA Novartis Baltics Lietuvos filialas Tel: +370 5 269 16 50 |
Novartis Bulgaria EOOD Teπ.: +359 2 489 98 28 | Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
Ceská republika Novartis s.r.o. Tel: +420 225 775 111 | Magyarország Novartis Hungária Kft. Tel.: +36 1 457 65 00 |
Danmark Novartis Healthcare A/S Tlf: +45 39 16 84 00 | Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
Deutschland Novartis Pharma GmbH Tel: +49 911 273 0 | Nederland Novartis Pharma B.V. Tel: +31 88 04 52 111 |
Eesti SIA Novartis Baltics Eesti filiaal Tel: +372 66 30 810 | Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
Ελλáδα Novartis (Hellas) A.E.B.E. Τηλ: +30 210 281 17 12 | Österreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
España Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 | Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 | Portugal Novartis Farma - Produtos Farmacêuticos, S.A. Tel: +351 21 000 8600 |
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 | România Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 | Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
Ísland Vistor hf. Sími: +354 535 7000 | Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
Italia Novartis Farma S.p.A. Tel: +39 02 96 54 1 | Suomi/Finland Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200 |
Κúπρος Novartis Pharma Services Inc. Τηλ: +357 22 690 690 | Sverige Novartis Sverige AB Tel: +46 8 732 32 00 |
Latvija SIA Novartis Baltics Tel: +371 67 887 070 |
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Esta información está destinada únicamente a profesionales sanitarios:
Ver también la sección 3 “Cómo se administra Lucentis”.
Cómo preparar y administrar Lucentis
Jeringa precargada para un solo uso. Únicamente para vía intravítrea.
Lucentis debe ser administrado por un oftalmólogo que tenga experiencia en la administración de inyecciones intravítreas.
En la DMAE exudativa, en la NVC, en la RDP y en la alteración visual debida a EMD o a edema macular secundario a OVR la dosis recomendada de Lucentis es 0,5 mg administrada en forma de inyección intravítrea única. Esto corresponde a un volumen de inyección de 0,05 ml. El intervalo entre dos dosis inyectadas en el mismo ojo debe ser como mínimo de cuatro semanas.
El tratamiento se inicia con una inyección al mes hasta alcanzar la agudeza visual máxima y/o no haya signos de actividad de la enfermedad, es decir ningún cambio en la agudeza visual ni en otros signos y síntomas de la enfermedad bajo tratamiento continuado. En pacientes con DMAE exudativa, EMD, RDP y OVR inicialmente pueden ser necesarias tres o más inyecciones consecutivas administradas mensualmente.
A partir de ese momento, los intervalos de monitorización y tratamiento se deben determinar según criterio médico y en base a la actividad de la enfermedad, valorada mediante la agudeza visual y/o parámetros anatómicos.
Se debe interrumpir el tratamiento con Lucentis si bajo criterio del médico, los parámetros visuales y anatómicos indican que el paciente no se está beneficiando del tratamiento continuado.
La monitorización para determinar la actividad de la enfermedad puede incluir examen clínico, control funcional o técnicas de imagen (p. ej. tomografía de coherencia óptica o angiografía con fluoresceína).
Si se está tratando a los pacientes de acuerdo a un régimen de tratar y extender, una vez se ha alcanzado la agudeza visual máxima y/o no hay signos de actividad de la enfermedad, los intervalos de tratamiento se pueden espaciar de forma gradual hasta que vuelvan a aparecer signos de actividad de la enfermedad o alteración visual. En el caso de la DMAE exudativa el intervalo de tratamiento no debe espaciarse en más de dos semanas cada vez y en el caso del EMD se puede espaciar hasta un mes cada vez. Para la RDP y la OVR, los intervalos de tratamiento también pueden espaciarse de forma gradual, sin embargo los datos que hay no son suficientes para determinar la duración de estos intervalos. Si vuelve a aparecer actividad de la enfermedad, se debe acortar el intervalo de tratamiento de manera consecuente.
El tratamiento de la alteración visual debida a NVC se debe determinar para cada paciente de forma individualizada en base a la actividad de la enfermedad. Algunos pacientes pueden necesitar sólo una inyección durante los primeros 12 meses; otros pueden necesitar tratamiento con mayor frecuencia, incluyendo una inyección mensual. En el caso de NVC secundaria a miopía patológica (MP), muchos pacientes pueden necesitar sólo una o dos inyecciones durante el primer año.
Lucentis y fotocoagulación con láser en EMD y edema macular secundario a oclusión de la rama venosa retiniana (ORVR)
Existe alguna experiencia con Lucentis administrado concomitantemente con fotocoagulación con láser. Cuando se administren en el mismo día, Lucentis debe ser administrado como mínimo 30 minutos después de la fotocoagulación con láser. Lucentis puede administrarse en pacientes que han recibido fotocoagulación con láser previamente.
Lucentis y la terapia fotodinámica con verteporfina en la NVC secundaria a MP
No hay experiencia en la administración concomitante de Lucentis y verteporfina.
Antes de la administración de Lucentis se debe comprobar visualmente la ausencia de partículas y decoloración.
El procedimiento de inyección deberá llevarse a cabo bajo condiciones asépticas, que incluyen el lavado quirúrgico de las manos, el uso de guantes estériles, un campo estéril, un blefarostato estéril para los párpados (o equivalente) y la disponibilidad de una paracentesis estéril (en caso necesario). Antes de realizar el procedimiento de inyección intravítrea, se deberá evaluar detalladamente la historia clínica del paciente en cuanto a reacciones de hipersensibilidad. Antes de la inyección se debe administrar una anestesia adecuada y un microbicida tópico de amplio espectro para desinfectar la piel de la zona periocular, párpado y superficie ocular, de acuerdo con la práctica local.
La jeringa precargada es para un solo uso. La jeringa precargada es estéril. No use el producto si el envase está deteriorado. La esterilidad de la jeringa precargada sólo se puede garantizar si la bandeja se mantiene sellada. No use la jeringa precargada si la solución ha cambiado de color, está turbia o contiene partículas.
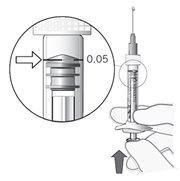
La jeringa precargada contiene más cantidad que la dosis recomendada de 0,5 mg. El volumen extraíble de la jeringa precargada (0,1 ml) no se administrará en su totalidad. El exceso de volumen se debe expulsar antes de la inyección. Si se inyecta todo el volumen de la jeringa precargada puede dar lugar a una sobredosis. Para expulsar las burbujas de aire y el exceso de medicamento, presione lentamente el émbolo hasta que el borde inferior de la cúpula que forma el extremo del tapón de goma quede alineado con la línea negra de dosificación de la jeringa (equivalente a 0,05 ml, es decir, 0,5 mg de ranibizumab).
Para la inyección intravítrea, se debe usar una aguja para inyección estéril 30G x ½″.
Para la preparación de Lucentis para administración intravítrea, siga las instrucciones de uso:
Introducción | Lea todas las instrucciones detenidamente antes de usar la jeringa precargada. La jeringa precargada es para un solo uso. La jeringa precargada es estéril. No usar el producto si el envase está deteriorado. La apertura de la bandeja sellada y los siguientes pasos se deben realizar bajo condiciones asépticas. Nota: La dosis a administrar se debe ajustar a 0,05ml. | |
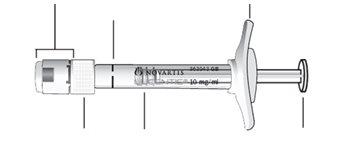
Descripción de la jeringa precargada |
| |
Preparar |
| |
Comprobar la jeringa |
| |
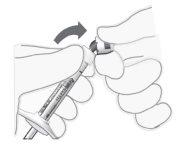
Quitar la cápsula de cierre de la jeringa |
|
Figura2
Figura3 |
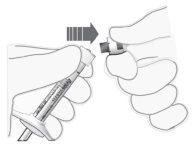
Conectar la aguja |
Nota: No secar la aguja en ningún momento. |
Figura4Figura5 |
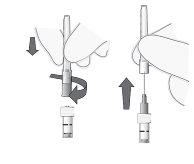
Extraer las burbujas de aire |
|
Figura6 |
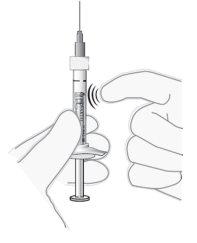
Ajustar la dosis |
Nota: El émbolo no está unido al tapón de goma – esto es para evitar la entrada de aire en la jeringa. |
Figura7 |
Inyección | El procedimiento de inyección debe llevarse a cabo bajo condiciones asépticas.
|
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a LUCENTIS 10 MG/ML SOLUCION INYECTABLE EN JERINGA PRECARGADAForma farmacéutica: INYECTABLE, 10 MG/MLPrincipio activo: RanibizumabFabricante: Samsung Bioepis Nl B.V.Requiere recetaForma farmacéutica: INYECTABLE, 10 MG/MLPrincipio activo: RanibizumabFabricante: Novartis Europharm LimitedRequiere recetaForma farmacéutica: INYECTABLE, 10 mg/mlPrincipio activo: RanibizumabFabricante: Midas Pharma GmbhRequiere receta
Médicos online para LUCENTIS 10 MG/ML SOLUCION INYECTABLE EN JERINGA PRECARGADA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de LUCENTIS 10 MG/ML SOLUCION INYECTABLE EN JERINGA PRECARGADA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes