
KALYDECO 75 MG GRANULADO EN SOBRE

Cómo usar KALYDECO 75 MG GRANULADO EN SOBRE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
Kalydeco 13,4mg granulado en sobre
Kalydeco 25 mg granulado en sobre
Kalydeco 50 mg granulado en sobre
Kalydeco 59,5mg granulado en sobre
Kalydeco 75 mg granulado en sobre
ivacaftor
Lea todo el prospecto detenidamente antes de que su hijo empiece a tomar este medicamento, porque contiene información importante para su hijo.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte al médico de su hijo o al farmacéutico.
- Este medicamento se le ha recetado solamente a su hijo, y no debe dárselo a otras personas aunque tengan los mismos síntomas que su hijo, ya que puede perjudicarles.
- Si su hijo experimenta efectos adversos, consulte al médico de su hijo o al farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Kalydeco y para qué se utiliza
- Qué necesita saber antes de que su hijo tome Kalydeco
- Cómo tomar Kalydeco
- Posibles efectos adversos
- Conservación de Kalydeco
- Contenido del envase e información adicional
1. Qué es Kalydeco y para qué se utiliza
Kalydeco contiene el principio activo ivacaftor. Ivacaftor actúa a nivel del regulador de la conductancia transmembrana de la fibrosis quística (CFTR, por sus siglas en inglés), una proteína que forma un canal en la superficie celular que permite que partículas tales como el cloruro entren y salgan de la célula. Debido a las mutaciones en el gen CFTR(ver a continuación), el movimiento del cloruro se reduce en las personas con fibrosis quística (FQ). Ivacaftor ayuda a que ciertas proteínas CFTR anómalas se abran con más frecuencia para mejorar la entrada y salida del cloruro de la célula.
Kalydeco granulado está indicado:
- En monoterapia para el tratamiento de bebés y niños de 1 mes o mayores con un peso de 3 kg a menos de 25 kg con fibrosis quística (FQ) y una mutación R117Hen el gen CFTRo una de las siguientes mutaciones de apertura del canal en el gen CFTR: G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549No S549R.
- En combinación con ivacaftor/tezacaftor/elexacaftor granulado en sobre para pacientes de 2 a 6 años que tienen FQ, con al menos una mutación F508delen el gen CFTR. Si le han recetado Kalydeco para tomar con ivacaftor/tezacaftor/elexacaftor, lea el prospecto de ivacaftor/tezacaftor/elexacaftor. Contiene información importante sobre cómo tomar estos dos medicamentos.
2. Qué necesita saber antes de que su hijo tome Kalydeco
No administre Kalydeco a su hijo
- si su hijo es alérgico a ivacaftor o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte al médico de su hijo antes de que empiece a tomar Kalydeco.
- Consulte al médico de su hijo si su hijo tiene o ha tenido anteriormente problemas hepáticos. Puede ser necesario que el médico de su hijo le ajuste la dosis a su hijo.
- Se ha observado un aumento de las enzimas hepáticas en la sangre en algunas personas que toman Kalydeco (solo o en combinación con ivacaftor/tezacaftor/elexacaftor).. Consulte al médico de su hijo inmediatamente si su hijo tiene alguno de los siguientes síntomas, que pueden indicar problemas de hígado:
- Dolor o molestia en la zona superior derecha del estómago (abdomen)
- Piel o blanco de los ojos de color amarillo
- Pérdida de apetito
- Náuseas o vómitos
- Orina oscura
- El médico le hará análisis de sangre a su hijo para comprobar cómo tiene el hígado antes y durante el tratamiento, sobre todo durante el primer año y especialmente si los análisis de sangre indicaron que ha tenido las enzimas hepáticas elevadas en el pasado
- Se ha notificado depresión (incluidas las ideas de suicidio y conductas suicidas) en pacientes que están tomando Kalydeco, principalmente en un esquema combinado con ivacaftor/tezacaftor/elexacaftor, que suele aparecer en los primeros tres meses de tratamiento. Consulte a su médico de inmediato si usted (o alguien que esté tomando este medicamento) experimenta algunos de los siguientes síntomas: estado de ánimo triste o alterado, ansiedad, sensación de malestar emocional o ideas de autolesionarse o suicidarse, que pueden ser signos de depresión.
- Consulte al médico de su hijo si le han dicho que su hijo tiene o ha tenido anteriormente problemas renales.
- No se recomienda Kalydeco en pacientes que han recibido un trasplante de órganos.
- En algunos niños y adolescentes se ha observado una anomalía en el cristalino del ojo (catarata) sin ningún efecto en la visión durante el tratamiento (solo o en combinación con ivacaftor/tezacaftor/elexacaftor). El médico de su hijo le puede realizar algunas exploraciones en los ojos antes y durante el tratamiento.
- Kalydeco se debe utilizar únicamente si su hijo tiene una de las mutaciones en el gen CFTRenumeradas en la sección 1 (Qué es Kalydeco y para qué se utiliza).
Niños
Este medicamento no se debe dar a niños menores de 1 mes, ya que se desconoce si ivacaftor es seguro y eficaz en estos niños.
Este medicamento no se debe dar en combinación con ivacaftor/tezacaftor/elexacaftor a niños menores de 2 años, ya que se desconoce si ivacaftor es seguro y eficaz en ellos.
Otros medicamentos y Kalydeco
Informe al médico de su hijo o al farmacéutico si su hijo está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento. Algunos medicamentos pueden afectar a la forma de actuar de Kalydeco o hacer que haya una mayor probabilidad de efectos adversos. En concreto, informe al médico de su hijo si su hijo está tomando alguno de los medicamentos indicados a continuación. El médico de su hijo puede decidir ajustarle la dosis o que necesite más revisiones.
- Antifúngicos(se utilizan para el tratamiento de las infecciones causadas por hongos). Estos incluyen fluconazol, itraconazol, ketoconazol, posaconazol y voriconazol.
- Antibióticos(se utilizan para el tratamiento de las infecciones causadas por bacterias). Estos incluyen claritromicina, eritromicina, rifabutina, rifampicina y telitromicina.
- Medicamentos para la epilepsia(se utilizan para el tratamiento de las convulsiones o crisis epilépticas). Estos incluyen carbamazepina, fenobarbital y fenitoína.
- Medicamentos a base de plantas.Estos incluyen hierba de san Juan (Hypericum perforatum).
- Inmunosupresores(se utilizan después de un trasplante de órganos). Estos incluyen ciclosporina, everolimus, sirolimus y tacrolimus.
- Glucósidos cardiacos(se utilizan para el tratamiento de algunas afecciones del corazón). Estos incluyen digoxina.
- Anticoagulantes(se utilizan para evitar que se formen coágulos de sangre). Estos incluyen warfarina.
- Medicamentos para la diabetes.Estos incluyen glimepirida y glipizida.
- Medicamentos para reducir la tensión arterial.Estos incluyen verapamilo.
Toma de Kalydeco con alimentos y bebidas
Evite dar a su hijo alimentos o bebidas que contengan pomelo durante el tratamiento con Kalydeco ya que pueden aumentar los efectos adversos de Kalydeco al aumentar la cantidad de ivacaftor en el organismo de su hijo.
Conducción y uso de máquinas
Kalydeco puede hacer que su hijo se maree. Si su hijo se encuentra mareado, se recomienda que no monte en bicicleta o realice cualquier actividad que requiera toda su atención.
Kalydeco contiene lactosa y sodio.
Si el médico de su hijo le ha indicado que su hijo padece una intolerancia a ciertos azúcares, consulte con él antes de que su hijo tome este medicamento.
Kalydeco contiene menos de 1 mmol de sodio (23 mg) por unidad de dosis; esto es, esencialmente “exento de sodio”.
3. Cómo tomar Kalydeco
Siga exactamente las instrucciones de administración de este medicamento indicadas por el médico de su hijo. En caso de duda, consulte de nuevo al médico de su hijo.
El médico de su hijo determinará la dosis correcta para su hijo. Su hijo debe seguir utilizando todos los demás medicamentos, a menos que el médico de su hijo le indique que deje de tomar alguno.
En la Tabla 1 se facilitan las recomendaciones posológicas de Kalydeco.
Tabla1: Recomendaciones posológicas
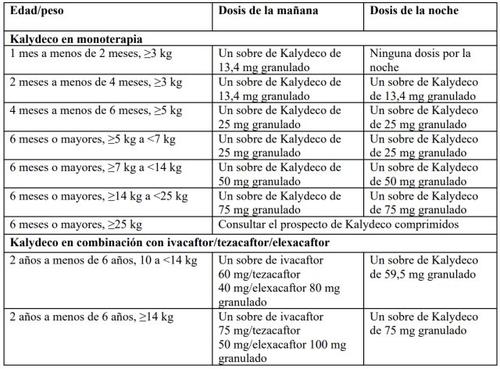
Administre a su hijo el granulado de la dosis de la mañana y el granulado de la dosis de la noche con una diferencia de 12 horas.
Si su hijo tiene problemas hepáticos, puede ser necesario que su médico le reduzca la dosis de Kalydeco, ya que el hígado de su hijo no eliminará el medicamento de su cuerpo tan rápidamente como en los niños que tienen la función hepática normal.
- Problemas hepáticos moderados en niños de 6 meses o mayores:se puede reducir la dosis a la mitad de la dosis indicada en la tabla anterior, es decir, un sobre una vez al día.
- Problemas hepáticos graves en niños de 6 meses o mayores:no está recomendado su uso, pero el médico de su hijo decidirá si es adecuado que su hijo utilice este medicamento, en cuyo caso la dosis (como se indica en la tabla anterior) se debe reducir a un sobre cada dos días.
- Problemas hepáticos en niños de entre 1mes y 6meses de edad:no está recomendado su uso.
Kalydeco se debe tomar por vía oral.
Cada sobre es únicamente de un solo uso.
Administración de Kalydeco a su hijo:
- Sujete el sobre del granulado con la línea para cortar hacia arriba.
- Agite suavemente el sobre para que el contenido se asiente.
- Abra el sobre rompiendo o cortando por la línea para cortar.
- Mezcle todo el contenido de un sobre con 5 ml de un alimento blando o líquido adecuado para la edad. Los alimentos o el líquido deben estar a temperatura ambiente o a una temperatura inferior. Algunos ejemplos de alimentos blandos o líquidos adecuados para la edad incluyen puré de frutas o de verduras, yogur, compota de manzana, agua, leche, leche materna, leche de fórmula o zumo.
- Una vez mezclado, dé el medicamento a su hijo inmediatamente. Si no es posible, déselo en la hora siguiente de haberlo mezclado. Asegúrese de que se toma toda la mezcla inmediatamente.
- Justo antes o justo después de la administración, debe dar a su hijo un alimento o un aperitivo que contenga grasas (a continuación se dan algunos ejemplos).
Las comidas o aperitivos que contienen grasas incluyen las preparadas con mantequilla o aceites o las que contienen huevos. Otros alimentos que contienen grasas son:
- Queso, leche entera, productos lácteos de leche entera, yogur, leche materna, leche de fórmula, chocolate
- Carnes, pescado azul
- Aguacate, humus (puré de garbanzos), productos a base de soja (tofu)
- Frutos secos, barritas o bebidas nutricionales que contienen grasas
Si su hijo toma más Kalydeco del que debe
Su hijo puede presentar efectos adversos, incluidos los mencionados en la sección 4 a continuación. Si es así, consulte con el médico de su hijo o el farmacéutico. Si puede, enséñeles el medicamento de su hijo y este prospecto.
Si olvidó dar Kalydeco a su hijo
Dele la dosis olvidada si han transcurrido menos de 6 horas desde la hora a la que su hijo tenía que haber tomado la dosis. De lo contrario, espere hasta que le toque tomar la siguiente dosis de la forma habitual. No le dé una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Kalydeco de su hijo
Administre Kalydeco a su hijo durante todo el tiempo que le haya recomendado el médico de su hijo. No interrumpa el tratamiento a menos que el médico de su hijo se lo indique. Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte al médico de su hijo o al farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves
Dolor de estómago (abdominal) y aumento de las enzimas hepáticas en la sangre.
Posibles signos de problemas hepáticos
El aumento de las enzimas hepáticas en la sangre es frecuente en los pacientes con FQ y también se ha notificado en pacientes que toman Kalydeco solo o en combinación con ivacaftor/tezacaftor/elexacaftor.
En pacientes que toman Kalydeco en combinación con ivacaftor/tezacaftor/elexacaftor,se han notificado daño hepático y empeoramiento de la función hepáticaen personas con enfermedad hepática grave. El empeoramiento de la función hepática puede ser grave y puede requerir un trasplante.
Los siguientes pueden ser signos de problemas hepáticos:
- Dolor o molestias en la parte superior derecha del estómago (zona abdominal).
- Coloración amarillenta de la piel o de la parte blanca de los ojos.
- Pérdida de apetito.
- Náuseas o vómitos.
- Orina de color oscuro.
Depresión
Los signos de depresión incluyen un estado de ánimo triste o alterado, ansiedad o sensación de malestar emocional.
Informe al médico de su hijo inmediatamentesi experimenta alguno de estos efectos adversos.
Efectos adversos muy frecuentes(pueden afectar a más de 1 de cada 10 personas)
- Infección del tracto respiratorio superior (resfriado común), que incluye dolor de garganta y congestión nasal
- Dolor de cabeza
- Mareos
- Diarrea
- Dolor de estómago o abdominal
- Cambios en el tipo de bacterias en los mocos
- Aumento de las enzimas hepáticas (signos de estrés en el hígado)
- Erupción cutánea
Efectos adversos frecuentes(pueden afectar hasta 1 de cada 10 personas)
- Mucosidad nasal
- Dolor de oído, molestia en el oído
- Pitidos en los oídos
- Enrojecimiento en el interior de los oídos
- Trastorno en el oído interno (sensación de mareo o de que todo da vueltas)
- Problemas de los senos paranasales (congestión sinusal)
- Enrojecimiento en la garganta
- Bulto en la mama
- Ganas de vomitar (náuseas)
- Gripe
- Nivel de azúcar bajo en la sangre (hipoglucemia)
- Respiración anómala (falta de aliento o dificultad respiratoria)
- Ventosidad (flatulencia)
- Granos (acné)
- Picor de piel
- Creatinfosfoquinasa aumentada (signo de descomposición muscular), observado en los análisis de sangre
Efectos adversos poco frecuentes(pueden afectar hasta 1 de cada 100 personas)
- Taponamiento de los oídos
- Inflamación de la mama
- Agrandamiento de las mamas en hombres
- Cambios o dolor en los pezones
- Sibilancia
- Aumentos en la tensión arterial
Frecuencia no conocida(no puede estimarse a partir de los datos disponibles)
- Daño en el hígado (lesión hepática)
- Aumento de la bilirrubina (análisis de sangre hepático)
Efectos adversos adicionales en niños y adolescentes
Los efectos adversos observados en niños y adolescentes son similares a los observados en adultos. Sin embargo, el aumento de las enzimas hepáticas en la sangre es más frecuente en niños pequeños.
Comunicación de efectos adversos
Si su hijo experimenta cualquier tipo de efecto adverso, consulte al médico de su hijo o al farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Kalydeco
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja, el estuche y el sobre después de EXP. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Una vez mezclado, la mezcla ha demostrado ser estable durante una hora.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Kalydeco
Kalydeco 13,4 mg granulado en sobre:
Cada sobre contiene 13,4 mg de ivacaftor.
Kalydeco 25 mg granulado en sobre:
Cada sobre contiene 25 mg de ivacaftor.
Kalydeco 50 mg granulado en sobre:
Cada sobre contiene 50 mg de ivacaftor.
Kalydeco 59,5 mg granulado en sobre:
Cada sobre contiene 59,5 mg de ivacaftor.
Kalydeco 75 mg granulado en sobre:
Cada sobre contiene 75 mg de ivacaftor.
Los demás componentes son: sílice coloidal anhidra, croscarmelosa sódica, succinato acetato de hipromelosa, lactosa monohidrato, estearato de magnesio, manitol, sucralosa y laurilsulfato sódico (E487).
Ver el final de la sección 2: Kalydeco contiene lactosa y sodio.
Aspecto del producto y contenido del envase
Kalydeco 13,4 mg granulado en sobre es un granulado de color blanco a blanquecino.
Kalydeco 25 mg granulado en sobre es un granulado de color blanco a blanquecino.
Kalydeco 50 mg granulado en sobre es un granulado de color blanco a blanquecino.
Kalydeco 59,5 mg granulado en sobre es un granulado de color blanco a blanquecino.
Kalydeco 75 mg granulado en sobre es un granulado de color blanco a blanquecino.
El granulado se suministra en sobres.
Kalydeco 13,4 mg granulado en sobre, Kalydeco 25 mg granulado en sobres, Kalydeco 50 mg granulado en sobres y Kalydeco 75 mg granulado en sobre:
Tamaño de envase de 56 sobres (contiene 4 estuches individuales con 14 sobres cada uno).
Kalydeco 13,4 mg granulado en sobre, Kalydeco 59,5 mg granulado en sobre y Kalydeco 75 mg granulado en sobre:
Tamaño de envase de 28 sobres (contiene 4 estuches individuales con 7 sobres cada uno).
Titular de la autorización de comercialización
Vertex Pharmaceuticals (Ireland) Limited
Unit 49, Block 5, Northwood Court, Northwood Crescent
Dublin 9, D09 T665,
Irlanda
Tel.: +353 (0)1 761 7299
Responsable de la fabricación
Almac Pharma Services (Ireland) Limited
Finnabair Industrial Estate
Dundalk
Co. Louth
A91 P9KD
Irlanda
Almac Pharma Services Limited
Seagoe Industrial Estate
Craigavon
County Armagh
BT63 5UA
Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: https://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a KALYDECO 75 MG GRANULADO EN SOBREForma farmacéutica: COMPRIMIDO, 150 mgPrincipio activo: IvacaftorFabricante: Vertex Pharmaceuticals (Ireland) LimitedRequiere recetaForma farmacéutica: COMPRIMIDO, 150 mgPrincipio activo: IvacaftorFabricante: Vertex Pharmaceuticals (Ireland) LimitedRequiere recetaForma farmacéutica: SOLUCIÓN/SUSPENSIÓN ORAL, 25 mgPrincipio activo: IvacaftorFabricante: Vertex Pharmaceuticals (Ireland) LimitedRequiere receta
Médicos online para KALYDECO 75 MG GRANULADO EN SOBRE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de KALYDECO 75 MG GRANULADO EN SOBRE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes

















