ILUMETRI 100 MG SOLUCION INYECTABLE EN PLUMA PRECARGADA

Cómo usar ILUMETRI 100 MG SOLUCION INYECTABLE EN PLUMA PRECARGADA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Ilumetri 100 mg solución inyectable en pluma precargada
tildrakizumab
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Ilumetri y para qué se utiliza
- Qué necesita saber antes de empezar a usar Ilumetri
- Cómo usar Ilumetri
- Posibles efectos adversos
- Conservación de Ilumetri
- Contenido del envase e información adicional
1. Qué es Ilumetri y para qué se utiliza
Ilumetri contiene el principio activo tildrakizumab. Tildrakizumab pertenece a un grupo de medicamentos denominados inhibidores de interleucinas (IL).
Este medicamento actúa bloqueando la actividad de una proteína llamada IL-23, una sustancia que se encuentra en el organismo y participa en las respuestas inflamatorias e inmunitarias normales y que está presente en grandes cantidades en enfermedades como la psoriasis.
Ilumetri se emplea para tratar una afección de la piel llamada psoriasis en placas, en adultos con enfermedad de moderada a grave.
El uso de Ilumetri le beneficiará porque produce mejoras en las lesiones de la piel y reduce los síntomas.
2. Qué necesita saber antes de empezar a usar Ilumetri
No use Ilumetri:
- Si es alérgico a tildrakizumab o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- Si tiene una infección que su médico considera importante, por ejemplo, tuberculosis activa, que es una enfermedad infecciosa que afecta principalmente a los pulmones.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Ilumetri:
- Si sufre reacciones alérgicas con síntomas como opresión en el pecho, sibilancias, hinchazón de la cara, los labios o la garganta, no se inyecte más Ilumetri y contacte con su médico de inmediato.
- Si actualmente padece una infección o si contrae infecciones de larga duración o de forma repetida.
- Si le han vacunado recientemente o tiene previsto vacunarse.
Si no está seguro de si se encuentra en alguna de las circunstancias anteriores, consulte a su médico, farmacéutico o enfermero antes de utilizar Ilumetri.
Cada vez que reciba un nuevo envase de Ilumetri, es importante que anote la fecha y el número de lote (que aparece en el envase después de “Lote”) y que guarde esta información en un lugar seguro.
Vigilancia de infecciones y reacciones alérgicas
Es posible que Ilumetri pueda causar efectos adversos graves, como por ejemplo infecciones y reacciones alérgicas. Debe estar atento a los signos de estas afecciones mientras utiliza Ilumetri.
Deje de usar Ilumetri e informe a su médico o solicite atención médica de inmediato si observa signos que indiquen una posible infección grave o una reacción alérgica (ver sección 4. Posibles efectos adversos).
Niños y adolescentes
No se recomienda el uso de Ilumetri en niños y adolescentes menores de 18 años de edad, ya que aún no se ha evaluado en este grupo de pacientes.
Otros medicamentos e Ilumetri
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento. Esto incluye vacunas y medicamentos inmunosupresores (medicamentos que afectan al sistema inmunitario).
No deben administrarle ciertos tipos de vacunas (vacunas de microbios vivos) mientras utiliza Ilumetri. No hay datos disponibles sobre el uso simultáneo de Ilumetri y de vacunas vivas.
Embarazo, lactancia y fertilidad
Es preferible evitar el uso de Ilumetri durante el embarazo. Se desconocen los efectos de este medicamento en las mujeres embarazadas.
Si es usted una mujer en edad fértil, es recomendable que no se quede embarazada y debe usar un método anticonceptivo eficaz mientras reciba tratamiento con Ilumetri y durante un mínimo de 17 semanas tras finalizar el tratamiento.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
La influencia de Ilumetri sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
Ilumetri contiene polisorbatos
Este medicamento contiene 0,5 mg de polisorbato 80 (E 433) en cada jeringa precargada, equivalente a 0,5 mg/ml. Los polisorbatos pueden causar reacciones alérgicas. Informe a su médico si tiene cualquier alergia conocida.
3. Cómo usar Ilumetri
Ilumetri se debe utilizar bajo la dirección y supervisión de un médico con experiencia en el diagnóstico y el tratamiento de la psoriasis.
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico. Este medicamento es para un solo uso.
La dosis recomendada de Ilumetri es de 100 mg en inyección subcutánea las semanas 0 y 4 y cada 12 semanas en adelante.
Si es un paciente con carga elevada de la enfermedad o con un peso corporal superior a 90 kg es posible que su médico le recomiende una dosis de 200 mg.
Su médico decidirá la duración del tratamiento con Ilumetri.
Después de haber aprendido correctamente la técnica de la inyección subcutánea, se puede inyectar Ilumetri usted mismo si el médico lo considera apropiado.
Para consultar las instrucciones sobre cómo inyectarse Ilumetri, lea las “Instrucciones de uso” que se encuentran al final de este prospecto.
Consulte a su médico cuándo le tocarán las inyecciones y las visitas de seguimiento.
Uso en niños y adolescentes
No se ha establecido todavía la seguridad y eficacia de Ilumetri en niños y adolescentes menores de 18 años de edad, por lo que no se recomienda el uso de Ilumetri en niños y adolescentes.
Si usa más Ilumetri del que debe
Si se ha administrado más Ilumetri del que debiera o la dosis se ha administrado antes de lo que indica la receta del médico, informe a su médico.
Si olvidó usar Ilumetri
Si se ha olvidado o se ha saltado una inyección de Ilumetri, administrar la dosis lo antes posible. A continuación, reanudar la administración al intervalo habitual.
Si interrumpe el tratamiento con Ilumetri
La decisión de interrumpir el tratamiento con Ilumetri debe tomarla junto con su médico. Es posible que sus síntomas reaparezcan al interrumpir el tratamiento.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves
Si nota alguno de los siguientes síntomas, contacte con su médico inmediatamente:
- Hinchazón de la cara, los labios o la garganta
- Dificultad para respirar
Estos pueden ser signos de una reacción alérgica.
Otros efectos adversos
La mayoría de los siguientes efectos adversos son leves. Si alguno de los siguientes efectos adversos se vuelve intenso, informe a su médico o farmacéutico.
Muy frecuentes(pueden afectar a más 1 de cada 10 personas)
- Infecciones de las vías respiratorias altas
Frecuentes(pueden afectar hasta a 1 de cada 10 personas)
- Gastroenteritis
- Náuseas
- Diarrea
- Dolor en la zona de inyección
- Dolor de espalda
- Dolor de cabeza
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Ilumetri
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta de la pluma precargada después de CAD o EXP. La fecha de caducidad es el último día del mes que se indica.
Conservar el medicamento en la caja original para protegerlo de la luz. No agitar.
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Después de sacar la pluma precargada de la nevera, espere 30 minutos, aproximadamente, para que la solución de Ilumetri en la pluma alcance la temperatura ambiente (máximo 25 ºC). No calentar de ninguna otra manera.
No utilizar si el líquido contiene partículas visibles, está turbio o es claramente marrón.
Una vez sacado de la nevera, no conserve tildrakizumab a más de 25 ºC ni lo refrigere de nuevo.
En el espacio provisto en la caja exterior, anote la fecha en que sacó el medicamento de la nevera y la fecha de eliminación que corresponda. Utilice la pluma antes de que hayan transcurrido 30 días desde que la sacó de la nevera o antes de que alcance la fecha de caducidad, lo que ocurra primero.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Ilumetri
- El principio activo es tildrakizumab. Cada pluma precargada contiene 100 mg de tildrakizumab.
- Los demás componentes son L-histidina, hidrocloruro de L-histidina monohidrato, polisorbato 80 (E 433), sacarosa y agua para preparaciones inyectables.
Aspecto de Ilumetri y contenido del envase
Ilumetri 100 mg solución inyectable (inyección) en pluma precargada es una solución transparente o ligeramente opalescente, entre incolora y ligeramente amarilla.
Ilumetri 100 mg solución inyectable (inyección) en pluma precargada está disponible en envases unitarios con 1 pluma precargada.
Titular de la autorización de comercialización
Almirall, S.A.
Ronda General Mitre, 151
08022 Barcelona, España
Responsable de la fabricación
SUN Pharmaceuticals Industries (Europe) B.V.
Polarisavenue 87
2132JH Hoofddorp, Países Bajos
Industrias Farmacéuticas Almirall, S.A.
Ctra. de Martorell 41-61
08740 Sant Andreu de la Barca, Barcelona, España
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien/ Luxembourg/Luxemburg Almirall N.V. Tél/Tel: +32 (0)2 771 86 37 | Ísland Vistor hf. Sími: +354 535 70 00 |
Eesti/Ελλáδα/ España/ Hrvatska/ Kúπρος/Latvija/Lietuva/ Magyarország/ Malta/ România/ Slovenija Almirall, S.A. Teπ./Tel/Τπλ: +34 93 291 30 00 | Italia Almirall SpA Tel: +39 02 346181 |
Ceská republika/Slovenská republika Almirall s.r.o Tel: +420 739 686 638 | |
Danmark/ Norge/Suomi/Finland/ Sverige Almirall ApS Tlf./Puh/Tel: +45 70 25 75 75 | Nederland Almirall B.V. Tel: +31 (0)30 711 15 10 |
Deutschland Almirall Hermal GmbH Tel: +49 (0)40 72704-0 | Österreich Almirall GmbH Tel: +43 (0)1/595 39 60 |
France Almirall SAS Tél: +33(0)1 46 46 19 20 | Polska Almirall Sp.z o. o. Tel.: +48 22 330 02 57 |
Ireland Almirall, S.A. Tel: +353 1800 849322 | Portugal Amgen Biofarmacêutica, Lda. Tel: +351 21 4220606 |
Fecha de la última revisión de este prospecto:06/2024
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos https://www.ema.europa.eu/.
INSTRUCCIONES DE USO
Tras recibir la formación adecuada en la técnica de inyección subcutánea, podrá inyectarse usted mismo/a este medicamento si el médico lo considera apropiado.
Lea todas las instrucciones, incluyendo Conservación, Advertencias, Partes de la pluma precargada que hallará en la parte superior de estas instrucciones antes de administrar el medicamento.
Conservación La pluma precargada debe conservarse en nevera entre 2 ºC y 8 ºC en el envase original (ver figura A), NO congelar. Conservar en el envase para protegerla de la luz. |
|
Advertencias
Ilumetri es para administración por vía subcutánea exclusivamente.
NO comparta la pluma precargada con otra persona.
NO quite la tapa gris de la aguja hasta que esté listo para inyectar.
NO ponga la mano, los dedos o el pulgar sobre el protector amarillo de la aguja.
Mantenga la pluma precargada y la tapa gris (cuando la quite) fuera del alcance de los niños y las mascotas.
Partes de la pluma precargada
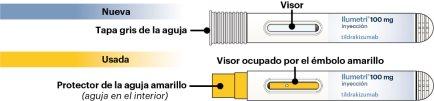
NO utilizar si la tapa gris de la aguja está quitada o dañada.
NO utilizar si el émbolo amarillo es visible en el visor.
Paso 1: Prepárese
1A Saque la pluma precargada de la nevera y espere 30 minutos
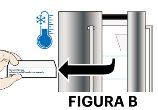
- Saque una pluma precargada de Ilumetri de la nevera (ver figura B).
- Saque la pluma precargada sosteniéndola por la parte central (ver figura C).
- Deje que la pluma precargada se ponga a temperatura ambiente durante al menos 30 minutos antes de inyectar (ver figura D).


NO agite el envase ni la pluma precargada.
NO caliente la pluma precargada de ninguna otra manera, como en el microondas, en agua caliente o a la luz solar directa.
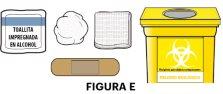
1B Reúna el resto de los materiales necesarios Reúna los materiales siguientes (ver figura E):
|
|
1C Compruebe la pluma precargada
- Compruebe la pluma precargada para asegurarse de que no ha pasado la fecha de caducidad (ver figura F).
- Compruebe el medicamento líquido a través del visor (ver figura G). Debe ser incoloro o ligeramente amarillo.
Es normal ver una o varias burbujas de aire.


NO utilizar si ha pasado la fecha de caducidad.
NO utilizar si el líquido se ve turbio, decolorado o con partículas extrañas.
1D Lávese las manos
|
|
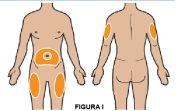
1E Escoja el lugar de la inyección Escoja el lugar de la inyección (ver figura I). Los lugares recomendados son:
Alterne los lugares de inyección en cada administración. NO inyecte en piel sensible, con rojez anómala, con hematomas, endurecida o afectada por psoriasis. |
|
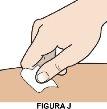
1F Limpie el lugar de la inyección
|
|
NO sople sobre la piel para que se seque.
NO toque el lugar de la inyección una vez limpiado.
Paso 2: Inyecte
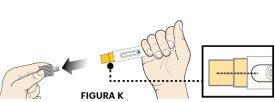
2A Quite la tapa de la aguja
|
|
NO toque el protector de la aguja amarillo.
NO vuelva a poner la tapa gris en la pluma precargada.
NO retuerza ni doble el protector de la aguja al quitarlo, porque podría dañar la aguja.
2B Coloque la pluma precargada
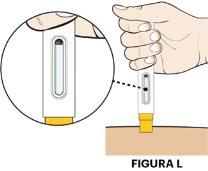
- Sujete la pluma precargada con el visor hacia usted.
- Estire la piel y coloque la pluma precargada recta sobre el lugar de la inyección limpio con el protector de la aguja amarillo plano sobre la piel (ver figura L).
2C Administre la inyección
Para empezar la inyección:
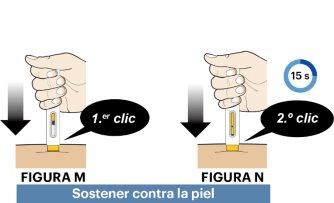
- Apriete y sostenga la pluma precargada contra la piel. Esto hará que el protector de la aguja amarillo ascienda por la pluma precargada (ver figura M).
- Oirá un primer “clic”, que indica que la inyección ha empezado (ver figura M).
- Un segundo “clic” indica que la inyección casi ha terminado (ver figura N). Sostenga la pluma precargada un total de 15 segundos desde el inicio de la inyección para asegurarse de que se ha inyectado todo el medicamento. Cuente despacio quince segundos y asegúrese de haber oído el segundo “clic”.
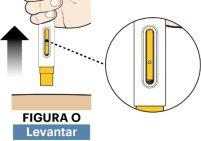
- Compruebe el visor. Todo el visor estará ocupado por el color amarillo.
- Levante y separe la pluma precargada de la piel en línea recta (ver figura O).
- Si el visor no se vuelve completamente amarillo, retire la pluma y llame a su proveedor de atención sanitaria.
NO use la pluma precargada si el protector de la aguja amarillo no sube por la pluma; deséchela inmediatamente en un recipiente para objetos cortopunzantes.
Paso 3: Deseche
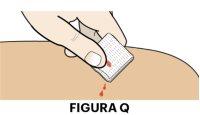
3A Tire la pluma precargada y cuide el lugar de la inyección
- Deseche la pluma precargada usada en un recipiente para objetos cortopunzantes aprobado (ver figura P).
- Puede haber una pequeña gota de sangre en el lugar de la inyección, es normal. Apriete una bola de algodón o gasa en la zona y ponga una tirita en caso necesario (ver figura Q).

NO deseche las plumas precargadas en la basura doméstica.
NO frote el lugar de la inyección.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a ILUMETRI 100 MG SOLUCION INYECTABLE EN PLUMA PRECARGADAForma farmacéutica: INYECTABLE, 100 mgPrincipio activo: TildrakizumabFabricante: Almirall S.A.Requiere recetaForma farmacéutica: INYECTABLE, 100 mgPrincipio activo: TildrakizumabFabricante: Almirall S.A.Requiere recetaForma farmacéutica: INYECTABLE, 200 mgPrincipio activo: TildrakizumabFabricante: Almirall S.A.Requiere receta
Médicos online para ILUMETRI 100 MG SOLUCION INYECTABLE EN PLUMA PRECARGADA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de ILUMETRI 100 MG SOLUCION INYECTABLE EN PLUMA PRECARGADA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes