FLUARIX SUSPENSION INYECTABLE EN JERINGA PRECARGADA

Cómo usar FLUARIX SUSPENSION INYECTABLE EN JERINGA PRECARGADA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto:información para el usuario
Fluarix suspensión inyectable en jeringa precargada
Vacuna antigripal trivalente (virus fraccionados, inactivados)
Este prospecto se ha escrito asumiendo que la persona que recibe la vacuna es quien lo va a leer. Sin embargo, puede que lo esté leyendo para otra persona.
Lea todo el prospecto detenidamente antes de empezar a recibir esta vacuna,porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Esta vacuna se le ha recetado solamente a usted, y no debe dársela a otras personas.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Fluarix y para qué se utiliza
- Qué necesita saber antes de empezar a recibir Fluarix
- Cómo se administra Fluarix
- Posibles efectos adversos
- Conservación de Fluarix
- Contenido del envase e información adicionall
1. Qué es Fluarix y para qué se utiliza
Fluarix es una vacuna para prevenir la gripe en adultos y niños a partir de los 6 meses de edad.
La gripe es una enfermedad de las vías respiratorias superiores y de los pulmones causada por una infección por un virus de la gripe. Los síntomas más comunes de la gripe son: fiebre alta, dolor de garganta, tos, dolores generales, dolor de cabeza, debilidad y cansancio. Pueden presentarse complicaciones, especialmente en personas muy jóvenes, muy mayores y en aquellas con poca inmunidad contra las infecciones.
¿Cómo funciona Fluarix?
- Fluarix contiene virus muertos que no pueden causar la gripe.
- Fluarix estimula el sistema inmunológico del cuerpo para que produzca anticuerpos frente a los virus específicos para los que se diseñó la vacuna. Esto ayudará a prevenir la enfermedad.
- La vacuna está dirigida contra los virus de la gripe de acuerdo con las recomendaciones oficiales.
- Al igual que con todas las vacunas, es posible que Fluarix no proteja completamente a todas las personas vacunadas.
2. Qué necesita saber antes de empezar a recibir Fluarix
No debe recibirFluarix si:
- es alérgico a los principios activos o a alguno de los demás componentes de esta vacuna (incluidos en la sección 6) o a cualquier componente que pueda estar presente en cantidades muy pequeñas, como la ovoalbúmina (una proteína del huevo), la hidrocortisona, el sulfato de gentamicina, el formaldehído y el desoxicolato de sodio.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a recibir Fluarix si:
- tiene una infección grave con fiebre alta. Si le sucede esto, puede que se tenga que posponer la vacunación hasta que se sienta mejor. Una infección menor, como un resfriado, no debería ser un problema, pero hable primero con su médico, farmacéutico o enfermero.
- tiene un problema de coagulación o le aparecen moratones con facilidad.
Antes o después de cualquier inyección, podría producirse un desmayo (especialmente en los adolescentes), por lo que debe informar a su médico, farmacéutico o enfermero si se ha desmayado en anteriores ocasiones tras la administración de una inyección.
Puede que las personas con un sistema inmunológico debilitado, por ejemplo debido a una infección por el VIH o debido a medicamentos que suprimen el sistema inmunológico, no se beneficien por completo de Fluarix.
Si le aplica alguna de las situaciones anteriores (o no está seguro), hable con su médico, farmacéutico o enfermero antes de recibir Fluarix.
Otros medicamentos/vacunas yFluarix
Informe a su médico, farmacéutico o enfermero si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento, o ha recibido recientemente cualquier otra vacuna.
Si se va a administrar Fluarix al mismo tiempo que otras vacunas, se debe utilizar un lugar de inyección diferente para cada tipo de vacuna.
Embarazo, lactanciay fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de recibir esta vacuna.
Conducción y uso de máquinas
Algunos de los efectos mencionados a continuación, en la sección 4 “Posibles efectos adversos” (p. ej., cansancio o mareo), pueden afectar temporalmente a la capacidad para conducir o usar máquinas. No conduzca ni use máquinas o herramientas si no se encuentra bien.
Fluarixcontiene sodio
Este medicamento contiene menos de 23 mg de sodio (1 mmol) por dosis; esto es, esencialmente "exento de sodio".
Fluarixcontiene potasio
Este medicamento contiene menos de 39 mg (l mmol) de potasio por dosis, por lo que se considera esencialmente "exento de potasio".
Fluarixcontiene polisorbato 80
Este medicamento no contiene más de 0,415 mg de polisorbato 80 por dosis. Los polisorbatos pueden causar reacciones alérgicas. Informe a su médico si tiene cualquier alergia conocida a esta sustancia.
3. Cómo se administra Fluarix
Fluarix se administra mediante una inyección única de 0,5 ml en un músculo.
Uso en niños
Los niños menores de 9 años que no hayan sido previamente vacunados frente a la gripe recibirán una segunda inyección al menos un mes después de la primera. Asegúrese de que su hijo complete el ciclo de vacunación. Esto maximizará la protección proporcionada por Fluarix.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, esta vacuna puede producir efectos adversos, aunque no todas las personas los sufran.
Consulte a su médico, farmacéutico o enfermero si desea más información sobre los posibles efectos adversos de Fluarix.
Efectos adversos notificados durante el uso general de Fluarix:
Efectos adversos graves
Informe a su médico inmediatamente si nota alguno de los siguientes efectos adversos graves; puede que necesite tratamiento médico urgente.
Raros: estos pueden ocurrir hasta con 1 de cada 1 000 dosis de la vacuna
- Reacciones alérgicas graves (reacciones anafilácticas). Se pueden reconocer por:
- erupción con picor en las manos y los pies
- hinchazón de los ojos y la cara
- dificultad para respirar o tragar
- caída repentina de la presión sanguínea y pérdida del conocimiento.
Estas reacciones aparecen normalmente en los 15 minutos posteriores a la vacunación. Sin embargo, si presenta alguno de estos síntomas, contacte urgentemente con un médico.
Otrosefectos adversos
Informe a su médico, farmacéutico o enfermero si nota alguno de los siguientes efectos adversos.
Raros: estos pueden ocurrir hasta con 1 de cada 1 000 dosis de la vacuna
- Inflamación de los nervios (neuritis), inflamación del cerebro y la médula espinal (encefalomielitis), inflamación temporal de los nervios, que causa dolor, debilidad y parálisis, llamada síndrome de Guillain-Barré.
- Reacciones de la piel que pueden extenderse por todo el cuerpo, incluyendo picor (prurito, urticaria) y enrojecimiento de la piel (eritema), erupción.
- Inflamación temporal de las glándulas del cuello, las axilas o la ingle (linfadenopatía transitoria)
- Síntomas parecidos a los de la gripe, malestar general.
Informe a su médico, farmacéutico o enfermero si nota alguno de los efectos adversos mencionados anteriormente.
Efectos adversos ocurridos durante los ensayos clínicos con Fluarix:
Efectos adversos ocurridos en niños entre 6 meses y menos de 6 años de edad
Muy frecuentes: estospueden ocurrir con más de 1 de cada 10 dosis de la vacuna
- Pérdida del apetito.
- Irritabilidad.
- Somnolencia.
- Dolor en el lugar de la inyección.
- Enrojecimiento en el lugar de la inyección.
- Hinchazón en el lugar de la inyección.
Frecuentes:estos pueden ocurrir hasta con 1 de cada 10 dosis de la vacuna
- Náuseas.
- Vómitos.
- Diarrea.
- Dolor de estómago.
- Fiebre.
Efectos adversos ocurridos en niños entre 6 años y menos de 18 años de edad
Muy frecuentes: estospueden ocurrir con más de 1 de cada 10 dosis de la vacuna
- Dolor de cabeza.
- Dolor muscular.
- Cansancio.
- Dolor en el lugar de la inyección.
- Enrojecimiento en el lugar de la inyección.
- Hinchazón en el lugar de la inyección.
Frecuentes:estos pueden ocurrir hasta con 1 de cada 10 dosis de la vacuna
- Náuseas.
- Vómitos.
- Diarrea.
- Dolor de estómago.
- Dolor en las articulaciones.
- Escalofríos.
- Fiebre.
Efectos adversos ocurridos en adultos a partir de 18 años de edad
Muy frecuentes: estospueden ocurrir con más de 1 de cada 10 dosis de la vacuna
- Dolor en el lugar de la inyección.
- Cansancio.
- Dolor de cabeza.
- Dolores musculares.
Frecuentes:estos pueden ocurrir hasta con 1 de cada 10 dosis de la vacuna
- Enrojecimiento, hinchazón o un bulto duro en el lugar de la inyección.
- Escalofríos.
- Sudoración.
- Dolor en las articulaciones.
- Náuseas.
- Vómitos.
- Diarrea.
- Dolor de estómago.
Poco frecuentes:estos pueden ocurrir hasta con 1 de cada 100 dosis de la vacuna
- Fiebre.
- Mareos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Fluarix
- Mantener esta vacuna fuera de la vista y del alcance de los niños.
- No utilice esta vacuna después de la fecha de caducidad que aparece en la etiqueta y en el envase, después de CAD. La fecha de caducidad es el último día del mes que se indica.
- Conservar en nevera (entre 2 °C y 8 ºC).
- No congelar.
- Conservar en el embalaje exterior para protegerla de la luz.
- Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Fluarix
El principio activo es virus de la gripe (inactivado, fraccionado) de las siguientes cepas*:
Cepa similar aA/Victoria/4897/2022(H1N1)pdm09:
(IVR-238) derivada deA/Victoria/4897/202215microgramos de HA**
Cepa similar a A/Croatia/10136RV/2023 (H3N2):
(X-425A) derivada de A/Croatia/10136RV/202315microgramos de HA**
Cepa similar aB/Austria/1359417/2021:
(BVR-26) derivada de B/Austria/1359417/202115microgramos de HA**
por dosis de 0,5 ml
- propagados en huevos embrionados de gallina procedentes de grupos de pollos sanos
** hemaglutinina
Esta vacuna cumple con la recomendación de la Organización Mundial de la Salud (OMS) para el hemisferio Norte y con la recomendación de la Unión Europea para la campaña 2025/2026.
Los demás componentes son: cloruro de sodio, hidrógeno fosfato de disodio dodecahidrato, dihidrogenofosfato de potasio, cloruro de potasio, cloruro de magnesio hexahidrato, hidrógeno succinato de α-tocoferilo, polisorbato 80, octoxinol 10 y agua para preparaciones inyectables
Aspecto del producto y contenido del envase
- Fluarix es una suspensión inyectable en jeringa precargada.
- Fluarix es un líquido incoloro y ligeramente opalescente.
- Fluarix está disponible en jeringa precargada de 1 dosis con o sin agujas separadas; tamaños de envase de 1 y 10.
- Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
GlaxoSmithKline, S.A.
P.T.M. C/ Severo Ochoa, 2
28760 Tres Cantos (Madrid)
Tel.: +34 900 202 700
Responsable de la fabricación
GlaxoSmithKline Biologicals
Branch of SmithKline Beecham Pharma GmbH & Co. KG
Zirkusstrasse 40
01069 Dresde
Alemania
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Estado miembro | Nombre |
Austria | Fluarix Trivalent |
Bélgica, Luxemburgo | Alpharix |
España, Finlandia, Francia, Italia, Noruega, Países Bajos, Polonia, Portugal, Suecia | Fluarix |
Alemania, Grecia | Influsplit |
Fecha de la última revisión de esteprospecto:07/2025
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/).
<----------------------------------------------------------------------------------------------------------------------------------?
Esta información está destinada únicamente a profesionales del sector sanitario:
Las vacunas se deben inspeccionar visualmente para detectar cualquier partícula extraña y/o variación del aspecto físico antes de su administración.
Antes de su uso, se debe agitar bien la vacuna para obtener un líquido incoloro y ligeramente opalescente. Desechar si el contenido se presenta de otro modo.Inyectar todo el contenido de la jeringa.
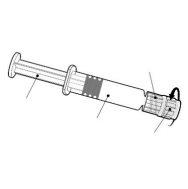
Instrucciones para la jeringa precargada
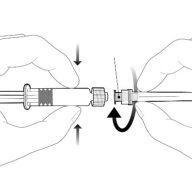
| Sostenga la jeringa por el cuerpo, no por el émbolo. Desenrosque el tapón de la jeringa girándola en sentido contrario a las agujas del reloj. |
| Para insertar la aguja, conecte la base al adaptador luer-locky gírelo un cuarto de vuelta en el sentido de las agujas del reloj hasta que sienta que se bloquea. No saque el émbolo de la jeringa del cuerpo. Si esto ocurre, no administre la vacuna. |
Eliminación de residuos
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a FLUARIX SUSPENSION INYECTABLE EN JERINGA PRECARGADAForma farmacéutica: INYECTABLE, 3,75 microgramosPrincipio activo: influenza, inactivated, split virus or surface antigenFabricante: Glaxosmithkline BiologicalsRequiere recetaForma farmacéutica: INYECTABLE, 0,5 mlPrincipio activo: influenza, inactivated, split virus or surface antigenFabricante: Sanofi Winthrop IndustrieRequiere recetaForma farmacéutica: INYECTABLE, 60 microgramos de HAPrincipio activo: influenza, inactivated, split virus or surface antigenFabricante: Sanofi Winthrop IndustrieRequiere receta
Médicos online para FLUARIX SUSPENSION INYECTABLE EN JERINGA PRECARGADA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de FLUARIX SUSPENSION INYECTABLE EN JERINGA PRECARGADA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes