FIRMAGON 80 mg POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Cómo usar FIRMAGON 80 mg POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
FIRMAGON 80mgpolvo y disolvente para solución inyectable
degarelix
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
- Qué es FIRMAGON y para qué se utiliza
- Qué necesita saber antes de empezar a usar FIRMAGON
- Cómo usar FIRMAGON
- Posibles efectos adversos
- Conservación de FIRMAGON
- Contenido del envase e información adicional
1. Qué es FIRMAGON y para qué se utiliza
FIRMAGON contiene degarelix.
Degarelix es un bloqueante hormonal sintético que se utiliza para el tratamiento del cáncer y para el tratamiento del cáncer de próstata de alto riesgo antes de radioterapia y en combinación con radioterapia en pacientes varones adultos. Degarelix simula los efectos de una hormona natural (que es la hormona liberadora de gonadotropinas, GnRH), por bloqueo directo de sus efectos. Por este motivo, degarelix reduce rápidamente los niveles de la hormona masculina llamada testosterona, que es la responsable de la estimulación del cáncer de próstata.
2. Qué necesita saber antes de empezar a usar FIRMAGON
No use FIRMAGON
- Si es alérgico al principio activo o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico si padece:
- Cualquier condición cardiovascular o problemas de ritmo cardiaco (arritmias) o si está siendo tratado con medicamentos para corregir esta alteración. El riesgo de problemas de ritmo cardiaco puede verse aumentado con la utilización de FIRMAGON.
- Diabetes mellitus. Puede producirse un agravamiento o aparecer diabetes. Si tiene diabetes, es probable que tenga que medir sus niveles de glucosa en sangre más frecuentemente.
- Enfermedad hepática. Puede necesitar que le supervisen la función hepática
- Enfermedad renal. No se ha investigado el uso de Firmagon en pacientes con enfermedad renal grave.
- Osteoporosis o cualquier condición que afecte a la concentración de los huesos. Niveles reducidos de testosterona pueden causar una reducción en el calcio del hueso (adelgazamiento del hueso).
- Hipersensibilidad grave. El uso de Firmagon no se ha investigado en pacientes con reacciones de hipersensibilidad graves.
Niños y adolescentes
No administre este medicamento a niños o adolescentes.
Uso de FIRMAGONcon otros medicamentos
FIRMAGON puede interferir con algunos medicamentos que se utilizan para tratar problemas del ritmo cardiaco (p. ej: quinidina, procainamida, amiodarona y sotalol) o con medicamentos que tienen efecto sobre el ritmo cardiaco (p. ej: metadona (se usa para el alivio del dolor y como parte de la desintoxicación de la drogadicción), moxifloxacino (un antibiótico), antipsicóticos).
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Conducción y uso de máquinas
La fatiga y el mareo son efectos adversos frecuentes que pueden afectar a la capacidad para conducir y usar máquinas. Estos efectos adversos pueden deberse al tratamiento o ser derivados de la propia enfermedad.
3. Cómo USAR FIRMAGON
En general, la inyección de este medicamento la realizará un enfermero o un médico.
La dosis de inicio recomendada es de dos inyecciones consecutivas de 120 mg. Después se le inyectará una dosis mensual de 80 mg. El líquido que se le inyecta forma un gel a partir del cual degarelix se libera durante un mes.
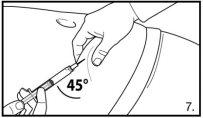
FIRMAGON ÚNICAMENTE debe inyectarse bajo la piel (inyección subcutánea). FIRMAGON NO DEBE administrarse en sangre (inyección intravenosa). Debe tenerse especial cuidado para evitar la inyección accidental en una vena. Es habitual variar el lugar de la inyección en distintos puntos de la pared abdominal.
Si olvidó usar FIRMAGON
Si cree que han olvidado administrarle su dosis mensual de FIRMAGON, pregunte a su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, FIRMAGON puede producir efectos adversos, aunque no todas las personas los sufran.
Una reacción alérgica muy grave a este medicamento es raro. Consulte con su médico de inmediato si desarrolla una erupción cutánea grave, picazón o falta de aliento o dificultad para respirar. Esto podría ser síntoma de una reacción alérgica grave.
Muy frecuentes (pueden afectar a más de 1 de cada 10 pacientes)
Sofocos, reacciones adversas en el lugar de inyección y rubor. Los efectos adversos en el lugar de inyección aparecen más frecuentemente con la dosis de inicio, siendo menos frecuentes al administrar la dosis de mantenimiento.
Frecuentes (pueden afectar hasta 1 de cada 10 pacientes)
- hinchazón, nódulo y dureza en el lugar de inyección
- escalofríos, fiebre o síntomas parecidos a los de la gripe después de la inyección
- dificultad para dormir, cansancio, mareos, dolor de cabeza
- aumento de peso, náuseas, diarrea, aumento de ciertas enzimas hepáticas
- sudoración excesiva (incluyendo sudoración nocturna), erupción cutánea
- anemia
- dolor y malestar musculoesquelético
- disminución del tamaño de los testículos, inflamación del pecho, impotencia.
Poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes)
- pérdida del deseo sexual, dolor testicular, dolor pélvico, interrupción de la eyaculación, irritación genital, dolor en el pecho
- depresión, deterioro mental
- coloración de la piel, pérdida de pelo, nódulos cutáneos, entumecimiento
- reacciones alérgicas, urticaria, picor
- disminución del apetito, estreñimiento, vómitos, sequedad de boca, dolor y molestia abdominal, aumento del azúcar en sangre/ diabetes mellitus, aumento del colesterol, cambio en los niveles de calcio en sangre, pérdida de peso
- presión sanguínea alta, cambios en el ritmo cardiaco, cambios en el electrocardiograma (prolongación QT), sensación de bombeo anormal del corazón, disnea, edema periférico
- debilidad muscular, espasmo muscular, hinchazón/entumecimiento de las articulaciones, osteoporosis/osteopenia, dolor en la articulación
- deseo frecuente de orinar, urgencia miccional (necesidad imperiosa de orinar), dificultad o dolor al orinar, necesidad de orinar por las noches, alteración en la función renal, incontinencia
- visión borrosa
- molestia a la inyección incluyendo disminución de la presión sanguínea y frecuencia cardiaca (reacción vasovagal)
- malestar
Raro (puede afectar hasta 1 de cada 1.000 pacientes)
- Neutropenia febril (número muy bajo de células blancas en la sangre en combinación con fiebre), ataque al corazón, fallo cardiaco.
- Dolor o calambres musculares inexplicables, sensibilidad o debilidad. Los problemas musculares pueden ser graves, incluida la degradación muscular que puede dañar el riñón.
Muy raras (pueden afectar hasta 1 de cada 10.000 pacientes)
- Infección en el lugar de inyección, absceso y necrosis
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistemanacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de FIRMAGON
Mantener este medicamento fuera de la vista y del alcance de los niños.
No usar FIRMAGON después de la fecha de caducidad que aparece en los viales, jeringas y en el envase. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Tras la reconstitución
Este medicamento es estable durante 2 horas a 25 ºC.
Debido a riesgos de contaminación microbiológica, el medicamento debe utilizarse inmediatamente. En caso de no utilizarse inmediatamente, el uso de este medicamento será responsabilidad del usuario.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de FIRMAGON
- El principio activo es degarelix. Cada vial contiene 80 mg de degarelix (como acetato). Tras la reconstitución, 1 ml de solución reconstituida contiene 20 mg de degarelix
- El otro componente del polvo es manitol (E 421).
- El disolvente es agua para preparaciones inyectables.
Aspecto de FIRMAGON y contenido del envase
FIRMAGON es un polvo y disolvente para solución inyectable. El polvo es de color blanquecino a blanco. El disolvente es una solución límpida e incolora.
Firmagon está disponible en 2 tamaños de envase.
Tamaño de envase de 1 bandeja conteniendo:
1 vial de polvo que contiene 80 mg de degarelix y 1 jeringa precargada que contiene 4.2 ml de disolvente.
1 impulsor del émbolo, 1 adaptador para el vial y 1 aguja para la inyección.
Tamaño de envase de 3 bandejas conteniendo:
3 viales de polvo que contiene 80 mg de degarelix y 3 jeringas precargadas que contienen 4.2 ml de disolvente.
3 impulsores del émbolo, 3 adaptadores para el vial y 3 agujas para la inyección.
Puede que no todos los envases esten comercializados.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
Ferring Pharmaceuticals A/S
Amager Strandvej 405
2770 Kastrup
Denmark
Tel. +45 8833 8834
Responsable de la fabricación:
Ferring GmbH
Wittland 11
D-24109 Kiel
Germany
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Ferring N.V. Tel/Tél: +32 53 72 92 00 | Lietuva CentralPharma Communication UAB Tel: +370 5 243 0444 |
???????? ??????? ???? ???: +359 2 807 5022 | Luxembourg/Luxemburg Ferring N.V. Belgique/Belgien Tel/Tél: +32 53 72 92 00 |
Ceská republika Ferring Pharmaceuticals CZ s.r.o. Tel: +420 234 701 333 | Magyarország Ferring Magyarország Gyógyszerkereskedelmi Kft. Tel: +36 1 236 3800 |
Danmark Ferring Lægemidler A/S Tlf: +45 88 16 88 17 | Malta E.J. Busuttil Ltd. Tel: +356 21447184 |
Deutschland Ferring Arzneimittel GmbH Tel: +49 431 5852 0 | Nederland Ferring B.V. Tel: +31 235680300 |
Eesti CentralPharma Communication OÜ Tel: +372 601 5540 | Norge Ferring Legemidler AS Tlf: +47 22 02 08 80 |
Ελλ?δα Ferring Ελλ?ς MEΠΕ Τηλ: +30 210 68 43 449 | Österreich Ferring Arzneimittel Ges.m.b.H. Tel: +43 1 60 8080 |
España Ferring, S.A.U. Tel: +34 91 387 70 00 | Polska Ferring Pharmaceuticals Poland Sp. z o.o. Tel: +48 22 246 06 80 |
France Ferring S.A.S. Tél: +33 1 49 08 67 60 | Portugal Ferring Portuguesa – Produtos Farmacêuticos, Sociedade Unipessoal, Lda. Tel: +351 21 940 5190 |
Hrvatska Clinres farmacija d.o.o. Tel: +385 1 2396 900 | România Ferring Pharmaceuticals Romania SRL Tel: +40 356 113 270 |
Ireland Ferring Ireland Ltd. Tel: + 353 1 4637355 | Slovenija SALUS, Veletrgovina, d.o.o. Tel: +386 1 5899 179 |
Ísland Vistor hf. Sími: +354 535 70 00 | Slovenská republika Ferring Slovakia s.r.o. Tel: +421 2 54 416 010 |
Italia Ferring S.p.A. Tel: +39 02 640 00 11 | Suomi/Finland Ferring Lääkkeet Oy Puh/Tel: +358 207 401 440 |
Κ?προς
Τηλ: +357 22583333 | Sverige Ferring Läkemedel AB Tel: +46 40 691 69 00 |
Latvija CentralPharma Communication SIA Talr: +371 674 50497 | United Kingdom(Northern Ireland) Ferring Ireland Ltd. Tel: +353 1 4637355 |
Fecha de la última revisión de esteprospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea del Medicamento http://www.ema.europa.eu/.
---------------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales del sector sanitario:
Instrucciones para su correcta utilización.
NOTA:
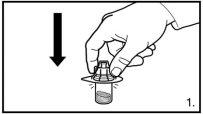
- LOS VIALES NO DEBEN AGITARSE
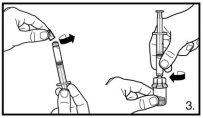
El envase contiene un vial de polvo y una jeringa precargada con disolvente que debe ser preparado para inyección subcutánea.
|
|
| |
|
|
|
Puede aceptarse la formación de pequeñas burbujas de aire de forma circular. El proceso de reconstitución normalmente se lleva a cabo en pocos minutos, pero en algunos casos puede durar hasta 15 minutos. |
|
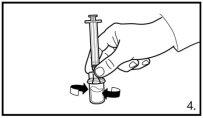
Asegúrese siempre de retirar el volumen exactoy ajústelo en caso de formación de burbujas de aire. |
| |
|
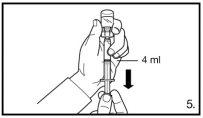
Inyectar 4 ml de FIRMAGON 80mglentamente, inmediatamente después de reconstituir* |
No inyectar directamente en ninguna vena. Tirar suavemente del émbolo para verificar si se ha aspirado sangre. Si entrara sangre en la jeringa, no podrá utilizarse el medicamento. En este caso, retire y deseche la jeringa y la aguja (reconstituir una nueva dosis para el paciente). |
- Se ha demostrado la estabilidad química y física del preparado durante 2 horas a 25ºC. Desde el punto de vista microbiológico, a menos que el método de reconstitución no implique riesgo de contaminación, el producto debe utilizarse inmediatamente. En caso de no utilizarse inmediatamente, las condiciones y el tiempo de utilización serán responsabilidad del usuario.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a FIRMAGON 80 mg POLVO Y DISOLVENTE PARA SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 120 mgPrincipio activo: degarelixFabricante: Ferring Pharmaceuticals A/SRequiere recetaForma farmacéutica: COMPRIMIDO, 250 mgPrincipio activo: abirateroneFabricante: Accord Healthcare S.L.U.Requiere recetaForma farmacéutica: COMPRIMIDO, 500 mgPrincipio activo: abirateroneFabricante: Accord Healthcare S.L.U.Requiere receta
Médicos online para FIRMAGON 80 mg POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de FIRMAGON 80 mg POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes