
DOTIMIR 20 MG/ML + 5 MG/ML COLIRIO EN SOLUCION

Cómo usar DOTIMIR 20 MG/ML + 5 MG/ML COLIRIO EN SOLUCION
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
Dotimir 20 mg/ml + 5 mg/ml colirio en solución
dorzolamida/timolol
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Dotimir y para qué se utiliza
- Qué necesita saber antes de empezar a usar Dotimir
- Cómo usar Dotimir
- Posibles efectos adversos
- Conservación de Dotimir
- Contenido del envase e información adicional
1. Qué es Dotimir y para qué se utiliza
Dotimir contiene dos medicamentos: dorzolamida y timolol.
- Dorzolamida pertenece a un grupo de medicamentos llamados "inhibidores de la anhidrasa carbónica".
- Timolol pertenece a un grupo de medicamentos llamados "betabloqueantes".
Estos medicamentos disminuyen la presión en el ojo de diferentes maneras.
Dotimir se prescribe para reducir la presión ocular elevada en el tratamiento del glaucoma cuando el uso de un colirio betabloqueante solo no es adecuado.
Dotimir colorio en solución es una solución estéril que no contiene conservantes.
2. Qué necesita saber antes de empezar a usar Dotimir
No use Dotimir
- si es alérgico a dorzolamida hidrocloruro, timolol maleato o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- si ahora tiene o ha tenido en el pasado problemas respiratorios, tales como asma o bronquitis obstructiva crónica grave (enfermedad del pulmón grave que puede causar pitidos, dificultad para respirar y/o tos persistente durante mucho tiempo).
- si tiene un latido cardíaco lento, insuficiencia cardíaca o alteraciones del ritmo cardíaco (latidos irregulares del corazón).
- si tiene una enfermedad o problemas renales graves, o antecedentes de piedras en el riñón.
- si tiene exceso de acidez en la sangre causada por una acumulación de cloruro en la sangre (acidosis hiperclorémica).
Si no está seguro si debe usar este medicamento, consulte a su médico o farmacéutico.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Dotimir. Informe a su médico si tiene o ha tenido en el pasado:
- cardiopatía coronaria (los síntomas pueden incluir dolor torácico u opresión en el pecho, dificultad para respirar o ahogo), insuficiencia cardíaca, tensión arterial baja.
- alteraciones del ritmo cardíaco tales como disminución del latido cardíaco.
- problemas respiratorios, asma o enfermedad pulmonar obstructiva crónica.
- problemas circulatorios (como la enfermedad de Raynaud o el síndrome de Raynaud).
- diabetes, ya que timolol puede enmascarar los signos y síntomas de niveles bajos de azúcar en sangre.
- hiperactividad de la glándula tiroides, ya que timolol puede enmascarar signos y síntomas.
- cualquier alergia o reacción anafiláctica.
- debilidad muscular o si le han diagnosticado miastenia gravis.
- si usa lentes de contacto blandas, Dotimir no se ha estudiado en pacientes que usan lentes de contacto.
Si tiene antecedentes de hipersensibilidad de contacto a la plata, no debe utilizar este medicamento ya que las gotas dispensadas pueden contener trazas de plata procedentes del envase.
Informe a su médico, antes de que tenga una intervención quirúrgica, que está usando Dotimir, ya que timolol puede cambiar los efectos de algunos medicamentos usados durante la anestesia.
Cuando Dotimir se instila en el ojo puede afectar a todo el cuerpo.
Consulte con su médico si durante el tratamiento con Dotimir usted:
- desarrolla irritación ocular o cualquier problema ocular nuevo, como enrojecimiento de los ojos o hinchazón de los párpados.
- sospecha que Dotimir está provocando una reacción alérgica o hipersensibilidad (por ejemplo, erupción cutánea, reacción cutánea grave o enrojecimiento y picazón en los ojos). Deje de usar este medicamento y comuníquese con su médico inmediatamente.
- desarrollar una infección ocular, sufrir una lesión ocular, someterse a una cirugía ocular o desarrollar una reacción que incluya síntomas nuevos o que empeoren.
Uso en niños
Existe una experiencia limitada en el uso de dorzolamida/timolol (formulación con conservantes) en lactantes y niños.
Uso en pacientes de edad avanzada
En estudios con dorzolamida/timolol (formulación con conservantes), los efectos fueron similares tanto en los pacientes de edad avanzada como en los más jóvenes.
Uso en pacientes con deterioro hepático
Informe a su médico si sufre o ha sufrido problemas del hígado en el pasado.
Otros medicamentos y Dotimir
Dotimir puede afectar o verse afectado por otros medicamentos que esté usando, incluyendo otras gotas oftálmicas para el tratamiento del glaucoma.
Informe a su médico si está usando o tiene intención de usar medicamentos para reducir la presión arterial, medicamentos para el corazón o medicamentos para tratar la diabetes.
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Esto es particularmente importante si está:
- tomando medicamentos para reducir la presión arterial o para tratar enfermedades cardíacas (como bloqueadores de los canales de calcio, betabloqueantes o digoxina).
- tomando medicamentos para tratar una alteración o irregularidad del latido cardíaco, como bloqueadores de los canales de calcio, betabloqueantes o digoxina.
- usando otro colirio que contiene betabloqueantes.
- tomando otro inhibidor de la anhidrasa carbónica tal como acetazolamida.
- tomando inhibidores de la monoaminooxidasa (IMAO).
- tomando un medicamento parasimpaticomimético que pudiera haber sido prescrito para ayudar a eliminar orina. Los parasimpaticomiméticos son también un tipo particular de medicamento que en algunas ocasiones se utiliza para ayudar a restaurar los movimientos normales a nivel intestinal.
- tomando narcóticos tal como la morfina utilizada para tratar el dolor moderado a grave.
- tomando medicamentos para tratar la diabetes.
- tomando antidepresivos conocidos como fluoxetina y paroxetina.
- tomando un medicamento sulfamida
- tomando quinidina (usado para tratar trastornos del corazón y algún tipo de malaria).
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Uso durante el embarazo
No use Dotimir si está embarazada a no ser que su médico lo considere necesario.
Uso durante la lactancia
No use Dotimir si está dando el pecho. Timolol puede llegar a la leche materna. Consulte a su médico antes de tomar cualquier medicamento durante la lactancia.
Conducción y uso de máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir o utilizar máquinas. Hay efectos adversos asociados con Dotimir, como visión borrosa, que pueden afectar a su capacidad para conducir y/o manejar máquinas. No conducir ni manejar máquinas hasta que se sienta bien o su visión sea clara.
3. Cómo usar Dotimir
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico. La dosis apropiada y la duración del tratamiento serán establecidas por su médico.
La dosis recomendadaes de una gota en el ojo u ojos afectados por la mañana y por la noche.
Si está utilizando Dotimir con otro colirio, las gotas se deben instilar al menos con 10 minutos de diferencia.
No cambie la dosis del medicamento sin consultar a su médico.
Si tienen dificultad en la administración de las gotas, busque ayuda en un miembro de la familia o cuidador.
Instrucciones de uso
No deje que la punta del envase multidosis toque los ojos o las zonas que los rodean. Puede producir daño en sus ojos. Las gotas del colirio en solución pueden estar contaminadas con bacterias capaces de causar infecciones oculares que originen graves daños en los ojos, e incluso la pérdida de la visión. Para evitar una posible contaminación del envase multidosis, lavese las manos antes del uso de este medicamento y evite que la punta del envase multidosis entre en contacto con cualquier superficie.
- Antes de la primera aplicación, escriba la fecha de apertura en el espacio provisto en la etiqueta del frasco. Retire la tapa protectora antes de cada aplicación. No toques nada con la punta del frasco
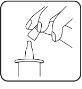
- Antes de la primera aplicación del frasco de Dotimir, presione varias veces (hasta 10 veces) para activar el mecanismo de bombeo hasta que aparezca la primera gota. A continuación, deseche también las dos primeras gotas. Mientras lo hace, sostenga el frasco boca abajo como se muestra en la figura. Esto sólo aplica a la primera aplicación y no es necesario para todas las demás aplicaciones. Evite cualquier contacto entre la punta del gotero, los dedos y los ojos.
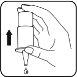
- Sostenga el frasco como se muestra en la imagen. Asegúrese de que el pulgar descanse sobre el reposamuñecas circular, ancho y antideslizante.
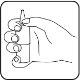
- Incline la cabeza ligeramente hacia atrás (posición del cuello) y use la mano libre para tirar del párpado inferior ligeramente hacia abajo. Aplique una gota de Dotimir en el saco conjuntival del ojo afectado accionando el mecanismo de bomba una vez. Asegúrese de que la botella se mantenga vertical.
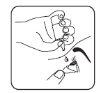
- Cierre el ojo y presione la esquina interna del ojo con el dedo durante unos dos minutos. Esto ayuda a evitar que el medicamento llegue al resto del cuerpo.
- Repita los pasos 3 y 4 para aplicar una gota en el otro ojo, si su médico se lo ha indicado. A veces, solo es necesario tratar un ojo y su médico le indicará si esto se aplica a usted y qué ojo necesita tratamiento.
Después del uso del envase multidosis, vuelva a colocar la tapa protectora. Limpie el exceso de líquido de la piel alrededor de los ojos.
Una vez abierto el frasco se puede utilizar durante 2 meses. Pasado ese tiempo, debe desechar el frasco aunque quede solución.
Si usa másDotimirdel que debe
Si se aplica demasiadas gotas en el ojo o traga parte del contenido del frasco, entre otros efectos, puede sentir aturdimiento, tener dificultad para respirar o notar que el corazón le late más despacio. Contacte con su médico inmediatamente.
En caso de sobredosis o ingestión accidental consulte inmediatamente a su médico o farmacéutico o llame al Servicio de Información Toxicológica, teléfono: 91 562 04 20, indicando el medicamento y la cantidad ingerida.
Si olvidó usarDotimir
Es importante usar Dotimir como le ha prescrito su médico.
Si olvida aplicar una dosis, debe administrársela lo antes posible. Sin embargo, si es casi la hora de la siguiente dosis, no se administre la dosis olvidada y continúe con el programa de dosis previsto normalmente.
No utilice una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento conDotimir
Si quiere interrumpir el uso de este medicamento, consulte primero con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Como todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves:
Si experimenta alguno de los siguientes efectos adversos, deje de usar este medicamento y solicite ayuda médica inmediata ya que estos pueden ser signos de reacción al medicamento.
Raros(pueden afectar hasta 1 de cada 1.000 personas):
- Dolor en el pecho, edema (acumulación de líquido), cambios en el ritmo o la velocidad de los latidos del corazón, insuficiencia cardíaca congestiva (enfermedad cardíaca con dificultad para respirar e hinchazón de pies y piernas debido a la acumulación de líquido), paro cardíaco, bloqueo cardíaco, presión arterial baja, isquemia cerebral (reducción del suministro de sangre al cerebro), accidente cerebrovascular.
- Dificultad para respirar, insuficiencia respiratoria, constricción de las vías respiratorias en los pulmones.
- Signos y síntomas de reacciones alérgicas sistémicas, incluidos angioedema, urticaria, prurito, erupción cutánea y anafilaxia.
- Reacciones cutáneas graves, incluida hinchazón debajo de la piel.
Otros efectos adversos:
Por lo general usted puede continuar usando las gotas, a menos que los efectos sean graves. Si está preocupado, consulte al médico o farmacéutico. No deje de usar Dotimir sin hablar con su médico.
Se han notificado los siguientes efectos adversos con el colirio de dorzolamida/timolol o uno de sus componentes durante los ensayos clínicos o durante la experiencia poscomercialización:
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- Quemazón y escozor en los ojos, alteración del gusto.
Frecuentes(pueden afectar hasta 1 de cada 10 personas):
- Efectos en los ojos: enrojecimiento en y alrededor de los ojos, lagrimeo o picazón en los ojos, erosión corneal (daño en la capa frontal del globo ocular), hinchazón y/o irritación en y alrededor de los ojos, sensación de tener algo en el ojo, disminución de la sensibilidad corneal (no darse cuenta de que le entra algo en el ojo y no sentir dolor), dolor ocular, ojos secos, visión borrosa.
- Efectos secundarios generales: dolor de cabeza, sinusitis (sensación de tensión o congestión en la nariz), náuseas, debilidad/cansancio, fatiga.
Poco frecuentes(pueden afectar hasta 1 de cada 100 personas):
- Efectos en los ojos: inflamación del iris, alteraciones visuales incluyendo cambios refractivos (debido a la suspensión de la terapia miótica en algunos casos).
- Efectos secundarios generales: mareos, depresión, ritmo cardíaco lento, desmayo, dificultad para respirar (disnea), indigestión, cálculos renales.
Raros(pueden afectar hasta 1 de cada 1.000 personas):
- Efectos en los ojos: miopía temporal que puede resolverse cuando se interrumpe el tratamiento, desprendimiento de la capa debajo de la retina que contiene vasos sanguíneos después de una cirugía de filtración que puede causar alteraciones visuales, párpados caídos (haciendo que el ojo permanezca medio cerrado), visión doble, formación de costras en los párpados, hinchazón de la córnea (con síntomas de alteraciones visuales), presión ocular baja.
- Efectos secundarios generales: latidos cardíacos fuertes que pueden ser rápidos o irregulares, fenómeno de Raynaud, hinchazón o frialdad de las manos y los pies y circulación reducida en brazos y piernas, calambres en las piernas y/o dolor en las piernas al caminar (claudicación), tos, irritación de garganta, sequedad de boca, insomnio, pesadillas, pérdida de memoria, hormigueo o entumecimiento de manos o pies, aumento de los signos y síntomas de miastenia gravis (trastorno muscular), disminución del deseo sexual, lupus eritematoso sistémico (una enfermedad inmunológica que puede causar una inflamación de los órganos internos), zumbidos en los oídos, rinitis, hemorragia nasal, diarrea, dermatitis de contacto, caída del cabello, erupción cutánea con aspecto blanco plateado (erupción psoriasiforme), enfermedad de Peyronie (que puede provocar una curvatura del pene), reacciones de tipo alérgico como erupción cutánea, urticaria, picor, en casos raros posible hinchazón de labios, ojos y boca, sibilancias o reacciones cutáneas graves (síndrome de Stevens Johnson, necrólisis epidérmica tóxica).
Al igual que otros medicamentos que se aplican en los ojos, el timolol se absorbe en la sangre. Esto puede causar efectos secundarios similares a los observados con los agentes betabloqueantes orales. La incidencia de efectos secundarios después de la administración oftálmica tópica es menor que cuando los medicamentos, por ejemplo, se toman por vía oral o se inyectan. Los efectos secundarios adicionales enumerados incluyen reacciones observadas dentro de la clase de betabloqueantes cuando se usan para tratar afecciones oculares.
Frecuencia no conocida(la frecuencia no puede estimarse a partir de los datos disponibles):
Niveles bajos de glucosa en sangre, dolor abdominal, vómitos, dolor muscular no causado por el ejercicio, disfunción sexual, alucionaciones, sensación de cuerpo extraño en el ojo (sensación de que hay algo en el ojo), aumento de la frecuencia cardíaca y aumento de la presión arterial.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Dotimir
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta del frasco después de CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Tras la primera apertura del frasco, la solución puede ser utilizada durante 2 meses.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Dotimir
- Los principios activos son dorzolamida y timolol.
Cada ml contiene 20 mg de dorzolamida (como 22,26 mg de dorzolamida hidrocloruro) y 5 mg de timolol (como 6,83 mg de timolol maleato). Cada gota (aproximadamente 0,028 ml) contiene aproximadamente 0,56 mg de dorzolamida y 0,14 mg de timolol.
- Los demás componentes son hidroxietilcelulosa, manitol, citrato de sodio, hidróxido de sodio, agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Dotimir es una solución transparente, de incolora a casi incolora y ligeramente viscosa, que se presenta en envase multidosis blanco de HDPE, con aplicador de gotero (PP, HDPE, LDPE) y tapón de HDPE, así como un aplicador ergonómico de PP.
Tamaños de envases:
1 frasco de 5 ml
1 frasco de 9 ml
2 frascos de 9 ml
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
OmniVision GmbH
Lindberghstrasse 9
82178 Puchheim
Alemania
Responsable de la fabricación
Tubilux Pharma S.p.A.
Via Costarica 20/22
00071 Pomezia
Italia
Este medicamento está autorizado en los Estados Miembros del Espacio Económico Europeo con siguientes nombres:
Austria: DorzoComp-Vision sine 20 mg/ml + 5 mg/ml Augentropfen, Lösung
Francia: Dotimir 20 mg/5 mg par ml, collyre en solution
Alemania: DorzoComp-Vision sine 20 mg/ml + 5 mg/ml Augentropfen, Lösung
Italia: Dotimir 20 mg/ml + 5 mg/ml collirio, soluzione
España: Dotimir 20 mg/ml + 5 mg/ml colirio en solución
Fecha de la última revisión de este prospecto: junio 2025
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/)
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a DOTIMIR 20 MG/ML + 5 MG/ML COLIRIO EN SOLUCIONForma farmacéutica: COLIRIO, 10 mg/ml + 5 mg/mlPrincipio activo: timolol, combinationsFabricante: Novartis Europharm LimitedRequiere recetaForma farmacéutica: COLIRIO, 0,3 mg/ml + 5 mg/mlPrincipio activo: timolol, combinationsFabricante: Brill Pharma S.L.Requiere recetaForma farmacéutica: COLIRIO, 0,3 mg/ml+5mg/mlPrincipio activo: timolol, combinationsFabricante: Laboratorio Stada S.L.Requiere receta
Médicos online para DOTIMIR 20 MG/ML + 5 MG/ML COLIRIO EN SOLUCION
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de DOTIMIR 20 MG/ML + 5 MG/ML COLIRIO EN SOLUCION, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















