CRYSVITA 30 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA

Cómo usar CRYSVITA 30 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
CRYSVITA 10mg solución inyectable en jeringa precargada
CRYSVITA 20mg solución inyectable en jeringa precargada
CRYSVITA 30mg solución inyectable en jeringa precargada
burosumab
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es CRYSVITA y para qué se utiliza
- Qué necesita saber antes de empezar a usar CRYSVITA
- Cómo usar CRYSVITA
- Posibles efectos adversos
- Conservación de CRYSVITA
- Contenido del envase e información adicional
1. Qué es CRYSVITA y para qué se utiliza
Qué es CRYSVITA
CRYSVITA contiene el principio activo burosumab. Se trata de un tipo de medicamento llamado anticuerpo monoclonal humano.
Para qué se utiliza CRYSVITA
CRYSVITA se utiliza para tratar la hipofosfatemia ligada al cromosoma X (XLH). Se utiliza en niños y adolescentes de 1 a 17 años, y en adultos.
CRYSVITA se utiliza para tratar la osteomalacia inducida por tumor (TIO) cuando el tumor que la causa no puede ser extirpado o localizado con éxito, en niños y adolescentes de 1 a 17 años y en adultos.
Qué es la hipofosfatemia ligada al cromosomaX (XLH)
La hipofosfatemia ligada al cromosoma X es una enfermedad genética.
- Las personas con XLH tienen niveles más altos de una hormona llamada factor de crecimiento de fibroblastos 23 (FGF23).
- El FGF23 reduce la cantidad de fosfato en la sangre.
- El nivel bajo de fosfato puede:
- dar lugar a que los huesos no se endurezcan correctamente y, en niños y adolescentes, a que no crezcan correctamente;
- producir dolor y rigidez en los huesos y las articulaciones.
Qué es la osteomalacia inducida por tumor (TIO)
- Las personas con TIO tienen niveles más altos de una hormona llamada FGF23 producida por ciertos tipos de tumores.
- El FGF23 reduce la cantidad de fosfato en la sangre.
- El nivel bajo de fosfato puede producir ablandamiento de los huesos, debilidad muscular, cansancio, dolor óseo y fracturas.
Cómo funciona CRYSVITA
CRYSVITA se fija al FGF23 en la sangre, impidiendo que el FGF23 actúe y aumente los niveles de fosfato en la sangre para que se puedan alcanzar niveles normales de fosfato.
2. Qué necesita saber antes de empezar a usar CRYSVITA
No use CRYSVITA
- si es alérgico a burosumab o a alguno de los demás componentes de este medicamento (incluidos en la sección 6);
- si toma suplementos de fosfato o ciertos suplementos de vitamina D (que contienen la denominada vitamina D activa [p. ej., calcitriol]);
- si ya tiene un nivel alto de fosfato en la sangre («hiperfosfatemia»);
- si tiene enfermedad renal grave o insuficiencia renal.
Reacciones alérgicas
Deje de usar CRYSVITA y póngase en contacto con su médico inmediatamente si presenta alguno de los siguientes efectos adversos, ya que podrían ser signos de una reacción alérgica:
- erupción y picor en todo el cuerpo;
- hinchazón grave de los párpados, la boca o los labios (angioedema);
- falta de aire;
- latido cardiaco rápido;
- sudoración.
No use CRYSVITA si alguno de los puntos anteriores se aplica en su caso. Si tiene dudas, consulte a su médico antes de empezar a usar CRYSVITA.
Advertencias y precauciones
Reacciones cutáneas
Puede presentar reacciones cutáneas en la zona de inyección, ver sección 4 para más información. Si estas reacciones son graves, informe a su médico.
Pruebas y comprobaciones
Su médico comprobará los niveles de fosfato y de calcio en la sangre y en la orina y podría realizarle también una ecografía renal durante el tratamiento para reducir el riesgo de hiperfosfatemia (demasiado fosfato en la sangre) y de mineralización ectópica (acumulación de calcio en tejidos como los riñones). También comprobará el nivel de la hormona paratiroidea en suero de vez en cuando.
Niños menores de 1año
No se debe administrar CRYSVITA a niños menores de 1 año, ya que no se ha estudiado la seguridad ni los efectos de este medicamento en este grupo de edad.
Otros medicamentos y CRYSVITA
Informe a su médico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
No use CRYSVITA e informe a su médico si está tomando:
- suplementos de fosfato;
- ciertos suplementos de vitamina D (que contienen la denominada vitamina D activa [p. ej., calcitriol]). Hay algunos suplementos de vitamina D que puede continuar usando o empezar a usar, y su médico le indicará cuáles son.
Consulte a su médico antes de empezar a usar CRYSVITA:
- si está tomando medicamentos que actúan en el cuerpo de la misma forma que el calcio («calcimiméticos»). Si se utilizan simultáneamente pueden reducir el nivel de calcio en la sangre;
- si es un paciente con TIO y está a punto de recibir tratamiento para el tumor subyacente (es decir, radioterapia o extirpación quirúrgica). En este caso, el tratamiento con CRYSVITA no se iniciará hasta después del tratamiento del tumor y si los niveles de fosfato sérico son bajos.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. Esto se debe a que se desconoce si CRYSVITA afectará al bebé.
No se recomienda utilizar CRYSVITA durante el embarazo.
Si puede quedarse embarazada, debe utilizar un método anticonceptivo efectivo mientras utiliza CRYSVITA y durante como mínimo 14 semanas después de la última dosis. Debe hablar de esto con su médico.
Se desconoce si CRYSVITA pasa a la leche materna y no se puede excluir el riesgo en recién nacidos/niños. Debe hablar de esto con su médico.
Conducción, montar en bicicleta y uso de máquinas
Es posible que CRYSVITA cause mareos y afecte a la capacidad de montar en bicicleta, utilizar herramientas o máquinas o conducir. Si cree que le afecta, no monte en bicicleta, no utilice herramientas ni máquinas y no conduzca. Informe a su médico.
CRYSVITA contiene sorbitol
CRYSVITA 10 mg solución inyectable en jeringa precargada: este medicamento contiene 15,30 mg de sorbitol en cada jeringa precargada.
CRYSVITA 20 mg solución inyectable en jeringa precargada: este medicamento contiene 30,61 mg de sorbitol en cada jeringa precargada.
CRYSVITA 30 mg solución inyectable en jeringa precargada: este medicamento contiene 45,91 mg de sorbitol en cada jeringa precargada.
3. Cómo usar CRYSVITA
CRYSVITA se debe administrar mediante inyección por debajo de la piel (vía subcutánea) en la parte superior del brazo, abdomen, nalga o muslo. Este medicamento se lo puede administrar un profesional sanitario o, alternativamente, su médico puede recomendarle que la inyección de CRYSVITA se la administre usted mismo o un cuidador. Si le sugiere que se lo administre usted mismo, un profesional sanitario le proporcionará formación para mostrarle a usted o a su cuidador la forma correcta de utilizar CRYSVITA antes de la primera autoinyección.
La primera autoinyección tras comenzar el tratamiento o tras cualquier cambio de dosis se debe realizar delante del profesional sanitario. Al final de este prospecto se incluye una sección detallada de «Instrucciones de uso» para la jeringa precargada. Siga siempre estas instrucciones cuidadosamente cuando se administre la inyección de CRYSVITA a usted mismo o a su hijo.
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico, enfermero o farmacéutico. En caso de duda, consulte de nuevo a su médico, enfermero o farmacéutico.
Qué cantidad de CRYSVITA necesitará
La dosis se determina en función del peso corporal. Su médico calculará la dosis correcta para usted.
Dosis para XLH y TIO
Será necesario inyectar su dosis de CRYSVITA:
- cada dos semanas en niños y adolescentes de 1 a 17 años;
- cada 4 semanas en adultos.
Su médico realizará unas comprobaciones para asegurar que recibe la dosis correcta y podrá cambiar la dosis o la frecuencia de administración en caso necesario.
Dosis máxima para pacientes con XLH
La dosis máxima que recibirá para el tratamiento de la XLH es 90 mg.
Dosis máxima para pacientes con TIO
La dosis máxima que recibirá para el tratamiento de la TIO:
- para niños de 1 a 12 años es 90 mg;
- para adolescentes de 13 a 17 años y para adultos es 180 mg.
Pacientes con TIO
Si es un paciente con TIO que requiere tratamiento del tumor subyacente (es decir, radioterapia o extirpación quirúrgica), su médico suspenderá el tratamiento con CRYSVITA. Una vez finalizado el tratamiento del tumor, su médico realizará controles de sus niveles de fosfato y reiniciará el tratamiento con CRYSVITA si los niveles de fosfato sérico son bajos.
Si le administran más CRYSVITA del que debe
Si cree que le han administrado una cantidad excesiva de CRYSVITA, informe a su médico inmediatamente.
Si se saltó una dosis de CRYSVITA
Si se salta una dosis, consulte a su médico inmediatamente. La dosis olvidada se debe administrar lo antes posible y su médico volverá a programar las dosis futuras como corresponden.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos en niños y adolescentes con XLH
Muy frecuentes (pueden afectar a más de 1 de cada 10niños y adolescentes)
- Absceso dental (infección)
- Tos
- Dolor de cabeza
- Mareo
- Vómitos
- Náuseas
- Diarrea
- Estreñimiento
- Caries dentales
- Erupción
- Dolor de músculos (mialgia) y de manos y pies
- Reacciones en el lugar de inyección, que pueden incluir:
- enrojecimiento o erupción
- dolor o picor
- hinchazón
- sangrado o hematomas
Estas reacciones en la zona de inyección normalmente son leves y ocurren en el plazo de 1 día tras la inyección y suelen mejorar en el plazo de 1 a 3 días.
- Fiebre
- Nivel bajo de vitamina D en la sangre
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
- Aumento del fosfato en la sangre
Efectos adversos en niños y adolescentes con TIO
No se conocen los efectos adversos en niños y adolescentes, ya que no se han realizado estudios clínicos.
Efectos adversos en adultos con XLH y TIO
Muy frecuentes (pueden afectar a más de 1 de cada 10adultos)
- Absceso dental (infección)
- Dolor de cabeza
- Mareo
- Síndrome de piernas inquietas (impulso irresistible de mover las piernas para detener las sensaciones incómodas, dolorosas o extrañas en las piernas, especialmente antes de dormir o durante la noche)
- Estreñimiento
- Dolor de espalda
- Espasmo muscular
- Reacciones en la zona donde se administra la inyección, que pueden incluir dolor o hinchazón
- Nivel bajo de vitamina D en la sangre
Frecuentes (pueden afectar hasta 1 de cada 10adultos)
- Erupción
- Aumento del fosfato en la sangre
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de CRYSVITA
Mantener CRYSVITA fuera de la vista y del alcance de los niños.
No utilice CRYSVITA después de la fecha de caducidad que aparece en la caja y la etiqueta después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2º C y 8º C). No congelar.
Conservar la jeringa precargada en la caja exterior para protegerla de la luz.
No utilice CRYSVITA si contiene partículas visibles.
Los medicamentos no se deben tirar por los desagües ni a la basura. De esta forma, ayudará a proteger el medio ambiente.
Si se autoinyecta, consulte el paso 4 de las «Instrucciones de uso» que aparecen al final del prospecto para la eliminación de los medicamentos y materiales no utilizados. Si tiene alguna duda sobre cómo deshacerse de los medicamentos que ya no necesita, pregunte a su profesional sanitario o farmacéutico.
6. Contenido del envase e información adicional
Composición de CRYSVITA
El principio activo es burosumab.
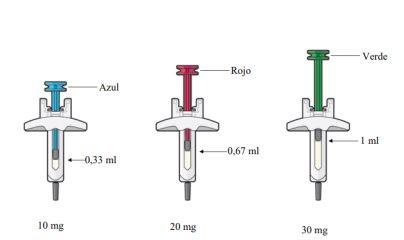
Jeringa precargada de 10 mg:
Cada jeringa precargada contiene 10 mg de burosumab en 0,33 ml de solución.
Jeringa precargada de 20 mg:
Cada jeringa precargada contiene 20 mg de burosumab en 0,67 ml de solución.
Jeringa precargada de 30 mg:
Cada jeringa precargada contiene 30 mg de burosumab en 1 ml de solución.
Los demás componentes son L-histidina, D-sorbitol (E 420), polisorbato 80, L-metionina, ácido clorhídrico al 10 % y agua para preparaciones inyectables. (Ver «CRYSVITA contiene sorbitol» en la sección 2 para más información).
Aspecto del producto y contenido del envase
CRYSVITA se presenta como una solución inyectable transparente a ligeramente opalescente y de incolora a marrón-amarilla pálida en una jeringa precargada. Cada envase contiene 1 jeringa precargada.
Las diferentes concentraciones del medicamento se pueden identificar mediante un vástago del émbolo de diferente color: 10 mg (azul), 20 mg (rojo) y 30 mg (verde).
Titular de la autorización de comercialización
Kyowa Kirin Holdings B.V.
Bloemlaan 2
2132NP Hoofddorp
Países Bajos
Responsable de la fabricación
allphamed PHARBIL Arzneimittel GmbH
Hildebrandstr. 10-12
37081 Göttingen
Alemania
Kyowa Kirin Holdings B.V.
Bloemlaan 2
2132NP Hoofddorp
Países Bajos
Fecha de la última revisión de este prospecto:junio 2025
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: https://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
INSTRUCCIONES DE USO
Las siguientes instrucciones de uso están indicadas para:
- la autoadministración;
- la administración por un cuidador o un profesional sanitario.
Lea atentamente estas instrucciones de uso antes de utilizar CRYSVITA:
- Solo debe administrarse este medicamento a sí mismo o a otra persona si se lo ha indicado su médico.
- Solo debe administrarse este medicamento a sí mismo o a otra persona después de haber recibido formación sobre la técnica de inyección. La primera autoinyección tras comenzar el tratamiento o tras cualquier cambio de dosis se debe realizar delante de un médico, farmacéutico o enfermero (profesional sanitario).
- Siga exactamente las instrucciones de administración de este medicamento indicadas por su profesional sanitario. En caso de duda, consulte de nuevo a su profesional sanitario.
- Su médico le recetará la dosis correcta. Su dosis se mide en miligramos (mg).
- Su profesional sanitario le indicará la cantidad de CRYSVITA que se debe administrar a sí mismo o administrar a otra persona. Puede necesitar más de una jeringa precargada para obtener la dosis correcta.
- Si su profesional sanitario le indica que es necesaria más de una inyección para administrar la dosis requerida, debe repetir los pasos 2 a 4 siguientes para cada inyección.
- Utilice materiales nuevos para cada inyección.
- Cada jeringa precargada es únicamente para un solo uso. Utilice siempre una nueva jeringa precargada de CRYSVITA para cada inyección; ver el paso 4 sobre cómo desechar las jeringas usadas y otros materiales.
- Cuando sea posible, utilice un lugar del cuerpo diferente para cada inyección.
- Cuando se administra CRYSVITA a un niño pequeño, puede ser útil que otra persona esté presente para calmarlo.
- No utilice CRYSVITA si es alérgico a alguno de los componentes de este medicamento. Deje de usar CRYSVITA si tiene alguna reacción alérgica durante o después de la inyección y póngase en contacto con su profesional sanitario inmediatamente. Ver la sección 2 del prospecto para obtener más información.
CRYSVITA está disponible en jeringas precargadas de tres concentraciones diferentes: 10 mg (azul), 20 mg (roja) y 30 mg (verde). La cantidad de líquido en las jeringas precargadas varía según la concentración. Las jeringas que se le administren dependerán de la dosis que se le haya recetado.
Estas instrucciones se utilizan para las tres concentraciones.
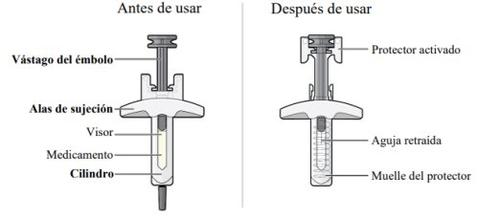
A continuación, se muestran las partes de la jeringa precargada de CRYSVITA:
Paso1. Reúna e inspeccione los materiales
CRYSVITA se debe conservar en nevera antes de su uso. Cuando tenga que administrarse
CRYSVITA a sí mismo o a otra persona, saque CRYSVITA de la nevera, pero manténgalo en la caja. Coloque la caja sobre una superficie limpia y plana.
Compruebe la concentración de cada jeringa precargada que le han dado en las cajas de CRYSVITA.
Asegúrese de que tiene el número correcto de jeringas y las concentraciones correctas de cada jeringa precargada para que coincidan con la dosis en mg aconsejada por su profesional sanitario.
Si no está seguro, pregunte a su profesional sanitario.
Deje que la caja de la jeringa precargada alcance la temperatura ambiente durante 45minutos.Nocaliente la jeringa precargada de ninguna otra manera como, por ejemplo, con agua caliente o en un horno microondas. Noexponga la jeringa precargada a la luz solar directa.
Transcurridos 45 minutos, abra la caja y retire la bandeja de plástico. Sujete suavemente la jeringa precargada por el cilindro y sáquela de la bandeja.
Nolevante la jeringa por el vástago del émbolo ni por el capuchón de la aguja.
Notoque el vástago del émbolo ni retire el capuchón de la aguja hasta que esté preparado para utilizarla
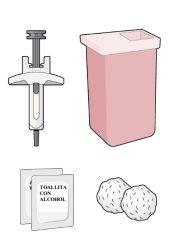
| Coloque todos los materiales que va a necesitar en una superficie limpia y plana. Para cada inyección necesitará:
Póngase en contacto con su profesional sanitario si no tiene estos materiales. |
Noutilice la jeringa precargada si falta el capuchón de la aguja o no está bien colocado.
Noutilice la jeringa precargada si tiene alguna grieta o está rota.
Compruebe la concentración en la etiqueta de cada jeringa precargada.
Compruebe la fecha de caducidad (indicada después de CAD) en la etiqueta de cada jeringa precargada.
Noutilice la jeringa precargada si ha pasado la fecha de caducidad.
Inspeccione el líquido de la jeringa precargada. No agitar.
El líquido de CRYSVITA debe ser de transparente a ligeramente opalescente y de incoloro a marrón-amarillo pálido.
Nota:es normal que el medicamento contenga burbujas de aire. Las burbujas de aire no le perjudicarán ni afectarán a su dosis.
Noutilice la jeringa precargada si el líquido presenta un cambio de color, está turbio o contiene
partículas.
Lávese bien las manos con agua y jabón antes de pasar al paso 2.
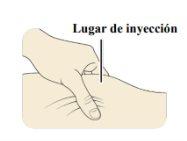
Paso2. Prepare el lugar de inyección
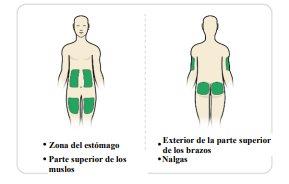
| La inyección debe administrase en la capa de grasa justo debajo de la piel. Tendrá que elegir el lugar de inyección. Si se está administrando la inyección a usted mismo, las zonas adecuadas son:
los muslos. Si va a administrar la inyección a otra persona, las zonas adecuadas son:
Noadministre la inyección en:
(incluidas las quemaduras);
alrededor de un lunar. |
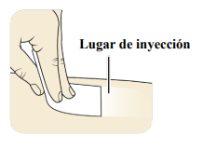
| Limpie el lugar de inyección con una toallita con alcohol y deje que se seque. Notoque ni sople el lugar de inyección limpio. |
Si le van a administrar más de una inyección, utilice un lugar diferentepara cada inyección. Limpie cada lugar de inyección con una nueva toallita con alcohol y deje que la piel se seque.
CRYSVITA debe inyectarse en piel limpia y seca.
Paso3. Administre la inyección de CRYSVITA
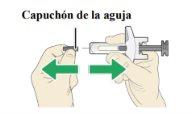
| Sujete el cilindrocon una mano y con el capuchón de la aguja apuntando hacia afuera. Tire del capuchón de la aguja hacia fueracon la otra mano. Nogire el capuchón de la aguja. Tire el capuchón de la aguja en un recipiente homologado para objetos punzantes. |
- Notoque la aguja ni el vástago del émbolo.
- Nopermita que la aguja entre en contacto con ninguna superficie una vez retirado el capuchón.
- Noutilice la jeringa si se le cae después de quitar el capuchón o si la aguja parece estar dañada
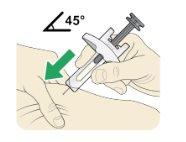
| Sin tocar el lugar de inyección limpio, pellizque la piel firmemente utilizando el pulgar y otros dedos, creando un área de unos 5 cm de ancho. |
| O |
|
Sujete la jeringa entre los dedos pulgar e índice de su mano dominante.
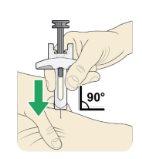
La aguja se debe introducir en la piel en un ángulo de 45º o de 90º.
Su profesional sanitario le indicará qué ángulo debe utilizar.
Utilice un movimiento rápido como si fuera un dardo para introducir la aguja en la piel pellizcada.
Noempuje el émbolo cuando introduzca la aguja.
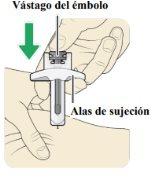
| Cuando la aguja esté introducida, no la mueva. Siga pellizcando la piel. Sujete las alas de sujecióncon una mano y empuje lenta y firmemente el vástago del émbolohasta que la jeringa esté vacía. Nosaque aún la aguja |
Cuando haya administrado la dosis completa, mantenga la jeringa en el mismo ángulo de
inyeccióny retírela tirando suavemente de la misma hacia fuera.
Noincline la jeringa mientras la retira.
Nofrote el lugar de inyección.
Suelte la piel pellizcada
| Suelte el vástago del émbolo. Se activará el protector y cubrirá la aguja. Para evitar cualquier herida, novuelva a poner el capuchón en la aguja. Notoque ninguna parte expuesta de la aguja. |
Si sale algo de sangre, presione el lugar de inyección con un algodón o una gasa durante unos
segundos.
Paso4. Después de cada inyección
Deposite los capuchones y las jeringas usadas en el recipiente para objetos punzantes.
Notire las jeringas a la basura.
Cuando su recipiente para objetos punzantes esté casi lleno, deberá seguir las directrices locales para solicitar otro recipiente y eliminarlo correctamente.
Recordatorio:Si va a administrar más de una inyección, repita los pasos 2 a 4 para cada una de ellas.
Utilice materiales nuevos para cada inyección.
Anote la fecha de inyección y todas las zonas en las que se ha inyectado de modo que, si es posible, pueda utilizar lugares diferentes para la siguiente inyección.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a CRYSVITA 30 MG SOLUCION INYECTABLE EN JERINGA PRECARGADAForma farmacéutica: NULL, 10 mgPrincipio activo: BurosumabFabricante: Kyowa Kirin Holdings B.V.Requiere recetaForma farmacéutica: INYECTABLE, 10 mgPrincipio activo: BurosumabFabricante: Kyowa Kirin Holdings B.V.Requiere recetaForma farmacéutica: NULL, 20 mgPrincipio activo: BurosumabFabricante: Kyowa Kirin Holdings B.V.Requiere receta
Médicos online para CRYSVITA 30 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de CRYSVITA 30 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes