
BRINZOLAMIDA/BRIMONIDINA ZENTIVA 10 MG/ML+2 MG/ML COLIRIO EN SUSPENSIÓN

Cómo usar BRINZOLAMIDA/BRIMONIDINA ZENTIVA 10 MG/ML+2 MG/ML COLIRIO EN SUSPENSIÓN
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
- Introducción
- Qué es Brinzolamida/Brimonidina Zentiva y para qué se utiliza
- Qué necesita saber antes de empezar a usar Brinzolamida/Brimonidina Zentiva
- Cómo usar Brinzolamida/Brimonidina Zentiva
- Posibles efectos adversos
- Conservación de Brinzolamida/Brimonidina Zentiva
- Contenido del envase e información adicional
Introducción
Prospecto: información para el usuario
Brinzolamida/Brimonidina Zentiva 10 mg/ml + 2mg/ml colirio en suspensión
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted,y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Brinzolamida/Brimonidina Zentiva y para qué se utiliza
- Qué necesita saber antes de empezar a usar Brinzolamida/Brimonidina Zentiva
- Cómo usar Brinzolamida/Brimonidina Zentiva
- Posibles efectos adversos
- Conservación de Brinzolamida/Brimonidina Zentiva
- Contenido del envase e información adicional
1. Qué es Brinzolamida/Brimonidina Zentiva y para qué se utiliza
Brinzolamida/Brimonidina Zentiva contiene dos principios activos, brinzolamida y tartrato de brimonidina. La brinzolamida pertenece a un grupo de medicamentos llamados inhibidores de la anhidrasa carbónica y el tartrato de brimonidina pertenece a un grupo de medicamentos llamados agonistas de los receptores alfa-2 adrenérgicos. Ambas sustancias trabajan juntas para reducir la presión dentro del ojo.
Brinzolamida/Brimonidina Zentiva se utiliza para reducir la presión en los ojos en pacientes adultos (de 18 años o más) que padecen enfermedades en los ojos conocidas como glaucoma o hipertensión ocular y cuya presión elevada en los ojos no puede controlarse eficazmente con un solo medicamento.
2. Qué necesita saber antes de empezar a usar Brinzolamida/Brimonidina Zentiva
No tomeBrinzolamida/Brimonidina Zentiva
- si es alérgico a la brinzolamida o al tartrato de brimonidina o a alguno de los demás componentes de este medicamento (incluidos en la sección 6)
- si es alérgico a las sulfonamidas (por ejemplo, medicamentos utilizados para tratar la diabetes y las infecciones y también diuréticos)
- si está tomando inhibidores de la monoaminooxidasa (MAO) (por ejemplo, medicamentos para tratar la depresión o la enfermedad de Parkinson) o ciertos antidepresivos. Debe informar a su médico si está tomando algún medicamento antidepresivo.
- si tiene problemas graves de riñón
- si tiene demasiada acidez en la sangre (una afección llamada acidosis hiperclorémica)
- en bebés y lactantes menores de 2 años
Advertencias y precauciones
Consulte a su médico, oftalmólogo (oculista) o farmacéutico antes de utilizar Brinzolamida/Brimonidina Zentiva si ahora ha tenido o ha tenido en el pasado:
- problemas hepáticos
- un tipo de presión elevada en los ojos llamada glaucoma de ángulo estrecho
- ojos secos o problemas de córnea
- enfermedad cardiaca coronaria (los síntomas pueden incluir dolor u opresión en el pecho, dificultad para respirar o ahogo), insuficiencia cardíaca, presión arterial alta o baja
- depresión
- circulación sanguínea alterada o deficiente (como la enfermedad de Raynaud, el síndrome de Raynaud o la insuficiencia cerebral).
- si alguna vez ha desarrollado una erupción cutánea grave o descamación de la piel, ampollas y/o llagas en la boca después de usar Brinzolamida/Brimonidina Zentiva u otros medicamentos relacionados.
Tenga especial cuidado con Brinzolamida/Brimonidina Zentiva:
Se han notificado reacciones cutáneas graves, incluido el síndrome de Stevens-Johnson y necrólisis epidérmica tóxica, en asociación con el tratamiento con brinzolamida. Deje de usar Brinzolamida/Brimonidina Zentiva y busque atención médica inmediatamente si nota alguno de los síntomas relacionados con estas reacciones graves de la piel descritas en la sección 4.
Si usa lentes de contacto blandas, no use el colirio con las lentes puestas. Consulte la sección “Uso de lentes de contacto: Brinzolamida/Brimonidina Zentiva contiene cloruro de benzalconio” a continuación).
Niños y adolescentes
Brinzolamida/Brimonidina Zentiva no está indicado en niños y adolescentes menores de 18 años porque no se ha estudiado en este grupo de edad. Es particularmente importante que el medicamento no se utilice en niños menores de 2 años (ver sección “No usar Brinzolamida/Brimonidina Zentiva” más arriba) porque es poco probable que sea seguro.
Uso de Brinzolamida/Brimonidina Zentiva con otros medicamentos
Informe a su médico, oftalmólogo (oculista) o farmacéutico si está utilizando, ha utilizado recientemente o podría utilizar cualquier otro medicamento.
Brinzolamida/Brimonidina Zentiva puede afectar o verse afectado por otros medicamentos que esté utilizando, incluidos otros colirios para el tratamiento del glaucoma.
Informe a su médico si está tomando o tiene intención de tomar alguno de los siguientes medicamentos:
- medicamentos para disminuir la presión arterial
- medicamentos para el corazón, incluyendo la digoxina (utilizada para tratar afecciones del corazón)
- otros medicamentos para el glaucoma que también tratan el mal de altura conocidos como acetazolamida, metazolamida y dorzolamida
- medicamentos que pueden afectar el metabolismo, como clorpromazina, metilfenidato y reserpina
- medicamentos antivirales, antirretrovirales (utilizados para tratar el virus de la inmunodeficiencia humana (VIH)) o antibióticos
- medicamentos contra la levadura o antimicóticos
- inhibidores de la monoaminooxidasa (MAO) o antidepresivos, incluidos amitriptilina, nortriptilina, clomipramina, mianserina, venlafaxina y duloxetina.
- anestésicos
- sedantes, opiáceos o barbitúricos
También debe informar a su médico si cambia la dosis de cualquiera de sus medicamentos actuales.
Toma deBrinzolamida/Brimonidina Zentivacon alcohol
Si consume alcohol habitualmente, consulte a su médico, oftalmólogo (oculista) o farmacéutico antes de tomar este medicamento. Brinzolamida/Brimonidina Zentiva puede verse afectado por el alcohol
Embarazo y lactancia
Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico, oftalmólogo (oculista) o farmacéutico antes de utilizar este medicamento. Se recomienda a las mujeres que puedan quedarse embarazadas que utilicen métodos anticonceptivos eficaces durante el tratamiento con Brinzolamida/Brimonidina Zentiva. No se recomienda el uso de Brinzolamida/Brimonidina Zentiva durante el embarazo. No utilice Brinzolamida/Brimonidina Zentiva a menos que su médico se lo indique claramente.
Si está en periodo de lactancia, Brinzolamida/Brimonidina Zentiva puede pasar a la leche. No se recomienda el uso de Brinzolamida/Brimonidina Zentiva durante la lactancia.
Conducción y uso de máquinas
Es posible que observe que su visión es borrosa o anormal durante un tiempo justo después de usar Brinzolamida/Brimonidina Zentiva. Brinzolamida/Brimonidina Zentiva también puede provocar mareos, somnolencia o cansancio en algunos pacientes.
No conduzca ni utilice máquinas hasta que los síntomas desaparezcan.
Brinzolamida/Brimonidina Zentiva contiene cloruro de benzalconio
Este medicamento contiene 0,15 mg de cloruro de benzalconio por cada 5 ml, lo que equivale a 0,03 mg/ml.
El cloruro de benzalconio se puede absorber por las lentes de contacto blandas y puede alterar el color de las lentes de contacto. Retirar las lentes de contacto antes de usar este medicamento y. esperar 15 minutos antes de volver a colocarlas.
El cloruro de benzalconio puede causar irritación ocular, especialmente si padece de ojo seco u otras enfermedades de la córnea (capa transparente de la zona frontal del ojo). Consulte a su médico si siente una sensación extraña, escozor o dolor en el ojo después de usar este medicamento.
3. Cómo usar Brinzolamida/Brimonidina Zentiva
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico oftalmólogo (oculista) o farmacéutico. En caso de duda, consulte de nuevo a su médico oftalmólogo (oculista) o farmacéutico.
Solo utilice Brinzolamida/Brimonidina Zentiva para los ojos. No tragar ni inyectar.
La dosis recomendadaes una gota en el ojo u ojos afectados dos veces al día. Úselo a la misma hora todos los días.
Cómo usar
- Lávese las manos antes de comenzar.
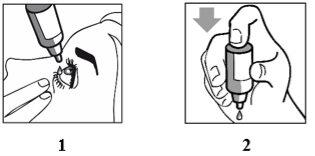
- Agitar bien antes de usar.
- Desenrosque el tapón del frasco. Después de quitar el tapón, si el cierre a prueba de manipulaciones está suelto, retírelo antes de usar el medicamento..
- No toque el gotero con los dedos al abrir o cerrar el frasco. Podría infectar las gotas.
- Sostenga el frasco, boca abajo, entre el pulgar y los dedos. Inclina la cabeza hacia atrás.
- Baje el párpado inferior con un dedo limpio, hasta que quede un "bolsillo" entre el párpado y el ojo. La gota caerá aquí (imagen 1).
- Acerque la punta del frasco al ojo. Haga esto frente a un espejo si le ayuda.
- No toque su ojo o párpado, áreas próximas u otras superficies con el gotero. Podría infectar las gotas.
- Presione suavemente la base del frasco para que caiga una gota de Brinzolamida/Brimonidina Zentiva.
- No aprietes el frasco: está diseñada para que una suave presión en la base sea suficiente (imagen 2).
Para reducir la cantidad de medicamento que podría pasar al resto del cuerpo después de la aplicación del colirio, cierre el ojo y aplique una presión suave en la esquina del ojo junto a la nariz con un dedo durante al menos 2 minutos.
Si usa gotas en ambos ojos, repita los pasos en el otro ojo. No es necesario cerrar y agitar el frasco antes de aplicar la gota en el otro ojo. Cierre firmemente el tapón del frasco inmediatamente después de su uso.
Si está utilizando otros colirios además de Brinzolamida/Brimonidina Zentiva, espere al menos cinco minutos entre el uso de Brinzolamida/Brimonidina Zentiva y las otras gotas.
Si una gota cae fuera del ojo, inténtalo de nuevo.
Si usa más Brinzolamida/Brimonidina Zentiva del que debe
Lave su ojo con agua templada. No aplique más gotas hasta que llegue el momento de su siguiente dosis.
Los adultos que habían ingeridoaccidentalmente medicamentos que contenían brimonidina experimentaron una disminución de la frecuencia cardíaca, disminución de la presión arterial, que puede ir seguida de un aumento de la presión arterial, insuficiencia cardíaca, dificultad para respirar y efectos en el sistema nervioso. Si esto sucediera, comuníquese con su médico inmediatamente.
Se han comunicado efectos adversos graves en niños que accidentalmente habían ingerido medicamentos que contienen brimonidina. Los signos incluían somnolencia, flacidez, baja temperatura corporal, palidez y dificultades respiratorias. Si esto sucede, comuníquese con su médico inmediatamente.
Si se ha ingerido accidentalmente Brinzolamida/Brimonidina Zentiva, debe contactar con su médico inmediatamente.
Si olvidó tomar Brinzolamida/Brimonidina Zentiva
Continúe con la siguiente dosis según lo planeado. No utilice una dosis doble para compensar una dosis olvidada. No utilice más de una gota dos veces al día en el ojo(s) afectado(s).
Si interrumpe el tratamiento con Brinzolamida/Brimonidina Zentiva
No deje de usar Brinzolamida/Brimonidina Zentiva sin antes consultar con su médico. Si deja de usar Brinzolamida/Brimonidina Zentiva, la presión en su ojo no estará controlada, lo que podría provocar pérdida de visión.
Si tiene más dudas sobre el uso de este medicamento, consulte a su médico, oftalmólogo (oculista) o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Si experimenta alguno de los siguientes efectos adversos, deje de usar este medicamento y busque atención médica inmediatamente, ya que podrían ser signos de una reacción al medicamento. No se conoce la frecuencia de una reacción alérgica a este medicamento (la frecuencia no puede estimarse a partir de los datos disponibles).
- Reacciones graves de la piel, como sarpullido, enrojecimiento o picazón en el cuerpo o los ojos.
- Dificultad para respirar
- Dolor en el pecho, latidos cardíacos irregulares
Comuníquese con su médico de inmediato si presenta cansancio extremo o mareos.
Se han observado los siguientes efectos adversos con Brinzolamida/Brimonidina Zentiva y otros medicamentos que contienen brinzolamida o brimonidina solos.
Deje de usar Brinzolamida/Brimonidina Zentiva y busque atención médica inmediatamente si nota alguno de los siguientes síntomas:
- manchas rojizas no elevadas, en forma de diana o circulares en el tronco, a menudo con ampollas centrales, descamación de la piel, úlceras en la boca, garganta, nariz, genitales y ojos. Estas erupciones de la piel graves pueden ir precedidas de fiebre y síntomas similares a los de la gripe (síndrome de Stevens-Johnson, necrólisis epidérmica tóxica).
Frecuentes(pueden afectar hasta 1 de cada 10 personas)
- Efectos en los ojos: conjuntivitis alérgica (alergia ocular), inflamación de la superficie ocular, dolor en el ojo, malestar en el ojo, visión borrosa o anormal, enrojecimiento del ojo.
- Otros efectos adversos: somnolencia, mareos, mal sabor de boca, sequedad de boca.
Poco frecuentes(pueden afectar hasta 1 de cada 100 personas)
- Efectos en el ojo: daño en la superficie del ojo con pérdida de células, inflamación del párpado, depósitos en la superficie del ojo, sensibilidad a la luz, hinchazón del ojo (que afecta a la córnea o al párpado), ojo seco, secreción ocular, ojo lloroso, enrojecimiento del párpado, sensación anormal o disminuida en el ojo, ojo cansado, visión reducida, visión doble, partículas del producto en los ojos.
- Otros efectos adversos: descenso de la presión arterial, dolor en el pecho, latidos cardíacos irregulares, frecuencia cardíaca lenta o rápida, palpitaciones, dificultad para dormir (insomnio), pesadillas, depresión, debilidad generalizada, dolor de cabeza, mareos, nerviosismo, irritabilidad, sensación general de malestar. pérdida de memoria, dificultad para respirar, asma, hemorragias nasales, síntomas de resfriado, sequedad de nariz o garganta, dolor de garganta, irritación de garganta, tos, secreción nasal, congestión nasal, estornudos, infección de los senos nasales, congestión del pecho, zumbidos en el oído, indigestión, gases intestinales o dolor de estómago, náuseas, diarrea, vómitos, sensación anormal en la boca, aumento de los síntomas alérgicos en la piel, erupción cutánea, sensación anormal en la piel, pérdida de cabello, picazón generalizada, aumento de los niveles de cloro en la sangre o disminución del recuento de glóbulos rojos observados en los análisis de sangre, dolor, dolor de espalda, dolor o espasmo muscular, dolor de riñón como dolor lumbar, disminución de la libido, dificultad sexual masculina.
Muyraros(pueden afectar hasta 1 de cada 10.000 personas)
- Efectos en el ojo: disminución del tamaño de la pupila
- Otros efectos adversos: desmayos, aumento de la presión arterial.
Frecuencia no conocida(no puede estimarse a partir de los datos disponibles)
- • Efectos en el ojo: disminución del crecimiento de las pestañas
- Otros efectos adversos: temblor, disminución de la sensibilidad, pérdida del gusto, valores anormales de la función hepática observados en los análisis de sangre, hinchazón de la cara, dolor en las articulaciones, micción frecuente, dolor en el pecho, hinchazón de las extremidades, manchas rojizas no elevadas, en forma de diana o circulares en el tronco, a menudo con ampollas centrales, descamación de la piel, úlceras en la boca, garganta, nariz, genitales y ojos, que pueden ir precedidas de fiebre y síntomas similares a los de la gripe. Estas erupciones cutáneas graves pueden poner en peligro la vida (síndrome de Stevens-Johnson, necrólisis epidérmica tóxica).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, oftalmólogo (oculista) o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Brinzolamida/Brimonidina Zentiva
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Deseche el frasco 4 semanas después de abrirlo por primera vez para prevenir infecciones y use un frasco nuevo. Anote la fecha de apertura de la caja en el espacio provisto.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Brinzolamida/Brimonidina Zentiva
- Los principios activos son brinzolamida y tartrato de brimonidina. Un ml de suspensión contiene 10 mg de brinzolamida y 2 mg de tartrato de brimonidina equivalente a 1,3 mg de brimonidina.
- Los demás componentes son cloruro de benzalconio (solución al 50 %) (ver sección 2 “Uso de lentes de contacto - Brinzolamida/Brimonidina Zentiva contiene cloruro de benzalconio”), propilenglicol (E1520), carbómero 974P, ácido bórico (E284), cloruro de sodio, tiloxapol, ácido clorhídrico y/o hidróxido de sodio y agua para inyección.
Se añaden pequeñas cantidades de ácido clorhídrico y/o hidróxido de sodio para mantener los niveles de acidez (niveles de pH) normales.
Aspecto del producto y contenido del envase
Frasco de LDPE blanco de 10 ml con una punta de cuentagotas sellada de LDPE blanco y un tapón blanco de HDPE/LDPE con un cierre a prueba de manipulaciones, que contiene 5 ml de una suspensión homogénea blanca.
Están disponibles los siguientes tamaños de envase: cajas que contienen 1 x 5 ml, 3 x 5 ml.
Puede que solamente estén comercializados algunos tamaños de envases
Titularde la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
Zentiva k.s.
U kabelovny 130
Dolní Mecholupy
102 37 Praga 10
República Checa
Responsable de la fabricación
Pharmathen S.A.
Dervenakion 6
Pallini 153 51,
Attikis, Grecia
Balkanpharma-Razgrad AD
68 Aprilsko Vastanie Blvd
Razgrad 7200, Bulgaria
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Zentiva Spain S.L.U.
Avenida de Europa, 19, Edificio 3, Planta 1.
28224 Pozuelo de Alarcón, Madrid
España
Este medicamento está autorizado en los estados miembros del Espacio Económico con los siguientes nombres:
Alemania | Brinzolamid/Brimonidin Zentiva 10 mg/ml + 2 mg/ml Augentropfensuspension |
España | Brinzolamida/Brimonidina Zentiva 10 mg/ml + 2mg/ml colirio en suspensión |
Francia | BRINZOLAMIDE/BRIMONIDINE ZENTIVA 10 mg/2 mg par mL, collyre en suspension |
Suecia | Brimonidin/brinzolamide Zentiva |
Fecha de la última revisión de este prospecto: Octubre 2023
Otras fuentes de información:
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a BRINZOLAMIDA/BRIMONIDINA ZENTIVA 10 MG/ML+2 MG/ML COLIRIO EN SUSPENSIÓNForma farmacéutica: COLIRIO, 10 mg/ml + 2 mg/mlPrincipio activo: brinzolamide, combinationsFabricante: Laboratorio Stada S.L.Requiere recetaForma farmacéutica: COLIRIO, 10 mg/ml + 2 mg/mlPrincipio activo: brinzolamide, combinationsFabricante: Novartis Europharm LimitedRequiere recetaForma farmacéutica: COLIRIO, 20 mg/mlPrincipio activo: dorzolamidaFabricante: Tiedra Farmaceutica S.L.Requiere receta
Médicos online para BRINZOLAMIDA/BRIMONIDINA ZENTIVA 10 MG/ML+2 MG/ML COLIRIO EN SUSPENSIÓN
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de BRINZOLAMIDA/BRIMONIDINA ZENTIVA 10 MG/ML+2 MG/ML COLIRIO EN SUSPENSIÓN, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















