APRETUDE 600 MG SUSPENSION INYECTABLE DE LIBERACION PROLONGADA

Cómo usar APRETUDE 600 MG SUSPENSION INYECTABLE DE LIBERACION PROLONGADA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
Apretude 600 mg suspensión inyectable de liberación prolongada
cabotegravir
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Apretude y para qué se utiliza
- Qué necesita saber antes de que le administren Apretude
- Cómo se administra Apretude
- Posibles efectos adversos
- Conservación de Apretude
- Contenido del envase e información adicional
1. Qué es Apretude y para qué se utiliza
Apretude contiene cabotegravir como principio activo. Cabotegravir pertenece a un grupo de medicamentos antirretrovirales llamados inhibidores de la integrasa (INI).
Apretude se usa para ayudar a prevenir la infección por VIH-1 en adultos y adolescentes que pesan al menos 35 kg y presenten un mayor riesgo de infección. Esto se denomina profilaxis preexposición: PrEP(ver sección 2).
Debe usarse en combinación con prácticas sexuales más seguras, como el uso de preservativos.
2. Qué necesita saber antes de que le administren Apretude
No use Apretude
- si alguna vez ha desarrollado una erupción cutánea grave, descamación de la piel, ampollas y/o llagas en la boca.
- si es alérgico(hipersensible) a cabotegravir o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- Si usted es VIH positivoo usted no sabe si es VIH positivo. Apretude solo puede ayudar a reducir el riesgo de adquirir VIH antes de infectarse. Debe hacerse la pruebapara asegurarse de que es VIH negativo antes de tomar Apretude.
- si está tomando alguno de los siguientes medicamentos:
- carbamazepina, oxcarbazepina, fenitoína, fenobarbital(medicamentos para tratar la epilepsia y prevenir las convulsiones).
- rifampicina o rifapentina(medicamentos para tratar algunas infecciones bacterianas, como la tuberculosis).
Estos medicamentos reducen la eficacia de Apretude al disminuir la cantidad de Apretude en sangre.
Si piensa que esto le afecta, o si no está seguro, informe a su médico.
Advertencias y precauciones
El uso de Apretude por sí solo puede no prevenir la infección por el VIH.
La infección por el VIH se transmite por contacto sexual con alguien VIH positivo o por transferencia de sangre infectada. Aunque Apretude reduce el riesgo de infección, aún puede contraer el VIH, a pesar de estar recibiendo este medicamento.
Se deben adoptar otras medidas para reducir aún más el riesgo de infección por VIH:
- Hágase pruebaspara otras enfermedades de transmisión sexual cuando su médico se lo indique. Estas infecciones hacen más fácil que pueda infectarse por VIH.
- Use preservativoscuando practique sexo oral o con penetración.
- No comparta ni reutilice agujas u otro instrumental de inyección o utensilios médicos.
- No comparta artículos personales que puedan contener sangre o fluidos corporales (como cuchillas de afeitar o cepillos de dientes).
Consulte con su médico sobre qué precauciones adicionales son necesarias para disminuir aún más el riesgo de infección por VIH.
Reduzca el riesgo de infección por VIH:
Existe cierto riesgo de desarrollar resistencia a este medicamento si se infecta por el VIH. Esto significa que el medicamento puede que no le prevenga de infectarse con el VIH. Para minimizar este riesgo y prevenir la infección por VIH, es importante que usted:
- asista a sus citas programadaspara recibir la inyección de Apretude. Informe a su médico si está pensando en interrumpir el tratamiento, ya que esto puede aumentar el riesgo de contraer una infección por VIH. Si deja de recibir su inyección de Apretude o se retrasa, necesitará tomar otros medicamentos o precauciones para reducir el riesgo de infección por VIH y posiblemente desarrollar resistencia viral.
- se haga la prueba del VIHcuando su médico se lo indique. Se debe hacer la prueba regularmente para asegurarse de que sigue siendo VIH-1 negativo mientras recibe Apretude.
- informe inmediatamente a su médicosi cree que puede haberse infectado por el VIH (puede tener una enfermedad similar a la gripe). Es posible que le requieran que se haga más pruebas para asegurarse de que sigue siendo VIH negativo.
Apretude inyectable es un medicamento de acción prolongada
Si deja de inyectarse Apretude, cabotegravir puede permanecer en su organismo hasta más de un año después de la última inyección, pero esto no sería suficiente para protegerle de una posible infección.
Es importante que asista a sus citas programadas para recibir las inyecciones de Apretude. Hable con su médico si está pensando dejar la PrEP.
Una vez interrumpa Apretude inyectable puede que necesite tomar otros medicamentos para reducir el riesgo de contraer una infección por el VIH o utilizar otras precauciones como relaciones sexuales seguras.
Problemas hepáticos
Informe a su médico si tiene problemas hepáticos. Es posible que necesite ser controlado más de cerca. (Ver también ‘Efectos adversos poco frecuentes’ en la sección 4).
Adolescentes
Su médico hablará con usted sobre su salud mental antes y mientras reciba Apretude. Informe a su médico si tiene problemas de salud mental. Es posible que necesite ser controlado más de cerca (Ver también la sección 4).
Reacción cutánea grave
Se han notificado muy raramente reacciones cutáneas graves, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica, en asociación con Apretude. Si nota alguno de los síntomas relacionados con estas reacciones cutáneas graves, no reciba la próxima inyección de Apretude y busque atención médica inmediatamente.
Lea la informaciónde la sección 4 de este prospecto (“Posibles efectos adversos”).
Reacciones alérgicas
Apretude contiene cabotegravir, que es un inhibidor de la integrasa. Los inhibidores de la integrasa, incluyendo cabotegravir, pueden causar una reacción alérgica grave conocida como reacción de hipersensibilidad. Necesita conocer cuáles son los signos y síntomas importantes a los que debe prestar atención mientras recibe Apretude.
Lea la informaciónen ‘Posibles efectos adversos’ en la sección 4 de este prospecto.
Niños y adolescentes
Este medicamento no se debe utilizar por niños y adolescentes que pesen menos de 35 kg, ya que no se ha estudiado en estos usuarios.
Otros medicamentos y Apretude
Informe a su médico si está tomando, ha tomado recientemente o pudiera tomar cualquier otro medicamento, incluyendo otros medicamentos comprados sin prescripción.
Algunos medicamentos pueden afectar el funcionamiento de Apretude o aumentar la probabilidad de que sufra efectos adversos. Apretude también puede afectar al modo en que otros medicamentos funcionan.
Apretude no se debe administrarcon otros medicamentos que puedan afectar a la eficacia del medicamento (ver ‘No use Apretude’ en la sección 2). Entre los que se incluyen:
- carbamazepina, oxcarbazepina, fenitoína, fenobarbital(medicamentos para tratar la epilepsia y prevenir las convulsiones).
- rifampicina o rifapentina(medicamentos para tratar algunas infecciones bacterianas, como la tuberculosis).
Informe a su médicosi usted está tomando:
- rifabutina(para tratar algunas infecciones bacterianas, como la tuberculosis). Puede que necesite recibir inyecciones de Apretude con mayor frecuencia.
Informe a su médico o farmacéuticosi usted está tomando este medicamento. Su médico puede decidir que necesita controles adicionales.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
Embarazo
Apretude no está recomendado durante el embarazo. Se desconoce el efecto de Apretude sobre el embarazo. Consulte a su médico: si puede estar embarazada, si planea tener un bebé o si se queda embarazada. No pare de asistir a las citas para recibir Apretude sin consultarlo con su médico. Su médico considerará el beneficio para usted y el riesgo para su bebé antes de empezar a utilizar/continuar utilizando Apretude.
Lactancia
Se desconoce si los componentes de Apretude pueden pasar a la leche materna. Sin embargo, es posible que cabotegravir pudiera pasar a la leche materna durante los 12 meses siguientes a la última inyección de Apretude. Si está dando el pecho o piensa en dar el pecho, consúltelo con su médico. Su médico considerará el beneficio y el riesgo de dar el pecho para usted y su bebé.
Conducción y uso de máquinas
Apretude puede causarle mareos y tener otros efectos adversos que le hagan estar menos atento.
No conduzca ni maneje maquinariaa menos que esté seguro de que no le afecta.
3. Cómo se administra Apretude
Este medicamento se administra en forma de inyección de 600 mg. Un enfermero o médico le administrará Apretude en el músculo de su nalga.
Debe hacerse una prueba de detección del VIH y dar negativoantes de recibir Apretude.
Se le administrará su primera y segunda dosis de Apretude con un mes de diferencia. Tras la segunda dosis, se le administrará una sola inyección de Apretude cada 2 meses.
Antes de comenzar el tratamiento con Apretude inyectable, usted y su médico pueden decidir iniciar primero el tratamiento con cabotegravir comprimidos (denominado periodo de inducción oral). El periodo de inducción oral le permite a usted y a su médico evaluar si es apropiado pasar a las inyecciones.
Si decide empezar el tratamiento con los comprimidos:
- Debe tomar un comprimido de Apretude de 30 mg una vez al día, durante aproximadamente un mes.
- Debe recibir su primera inyección el mismo día que tome el último comprimido o como mucho 3 días después.
- Después, recibirá una inyección cada 2 meses.
Pauta de inyección para la dosificación cada 2 meses
Cuándo | Qué medicamento |
Primera y segunda inyección, con un mes de diferencia | Apretude 600 mg |
Tercera inyección en adelante, cada dos meses | Apretude 600 mg |
Si le administran más Apretude inyectable del que debe
Este medicamento se lo administrará un médico o enfermero, por lo que es poco probable que le administren de más. Si está preocupado, consulte al médico o enfermero y recibirá el tratamiento necesario.
Si no asiste a la cita para recibir una inyección de Apretude
Contacte con su médico inmediatamentepara programar una nueva cita.
Es importante que vaya a las citas programadas habituales para recibir su inyección y reducir el riesgo de contraer VIH (ver sección 2). Hable con su médico si está pensando en interrumpir Apretude.
Hable con su médico si piensa que no va a poder recibir su inyección de Apretude con la frecuencia habitual. Su médico puede recomendarle que tome cabotegravir comprimidos en su lugar, hasta que pueda recibir su inyección de Apretude de nuevo.
No deje de recibir inyecciones de Apretude sin el consejo de su médico.
Continúe recibiendo inyecciones de Apretude tanto tiempo como le recomiende su médico. No lo deje a menos que su médico se lo indique. Si interrumpe el tratamiento y todavía está en riesgo de contraer el VIH, su médico debe iniciar un tratamiento con otro medicamento para la PrEP durante los 2 meses posteriores a su última inyección de Apretude.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
No reciba la próxima inyección de Apretude y busque atención médica inmediatamentesi nota alguno de los siguientes síntomas:
- manchas rojizas no elevadas, en forma de diana o circulares en el tronco, a menudo con ampollas en el centro, descamación de la piel, llagas en la boca, garganta, nariz, genitales y ojos. Estas erupciones cutáneas graves pueden ir precedidas de fiebre y síntomas similares a los de la gripe (síndrome de Stevens-Johnson, necrólisis epidérmica tóxica). Estas reacciones cutáneas graves son muy raras (pueden afectar hasta 1 de cada 10000personas).
Reacciones alérgicas
Apretude contiene cabotegravir, que es un inhibidor de la integrasa. Los inhibidores de la integrasa, incluyendo cabotegravir, pueden causar una reacción alérgica grave conocida como reacción de hipersensibilidad.
Si padece alguno de los siguientes síntomas:
- reacción cutánea
- temperatura elevada (fiebre)
- falta de energía (fatiga)
- hinchazón, en ocasiones de la cara o boca (angioedema), que causa dificultad para respirar
- dolores musculares o articulares.
Acuda al médico de inmediato.Su médico puede considerar necesario realizar pruebas para controlar su hígado, riñones o sangre y puede que le indique que deje de tomar Apretude.
Efectos adversos muy frecuentes(pueden afectar a más de 1 de cada 10 personas)
- dolor de cabeza
- diarrea
- reacciones en el lugar de la inyección
- muy frecuentes: dolor (que en raras ocasiones puede incluir dificultad temporal al caminar) y malestar, una masa o bulto endurecido
- frecuentes: enrojecimiento (eritema), picor (prurito), hinchazón, calor, entumecimiento (anestesia) o hematomas, (que pueden incluir decoloración o acumulación de sangre debajo de la piel)
- poco frecuentes: acumulación de pus (absceso)
- sensación de calor (pirexia)
- cambios en la función hepática (aumento de las transaminasas), medidas en los análisis de sangre.
Efectos adversos frecuentes(pueden afectar hasta a 1 de cada 10 personas)
- depresión
- ansiedad
- sueños anormales
- dificultad para dormir (insomnio)
- mareos
- sentirse enfermo (náuseas)
- vómitos
- dolor de estómago (dolor abdominal)
- gases (flatulencia)
- erupción
- dolor muscular (mialgia)
- falta de energía (fatiga)
- malestar general.
Efectos adversos poco frecuentes(pueden afectar hasta a 1 de cada 100 personas)
- intento de suicidio y pensamientos suicidas (especialmente en usuarios con antecedentes de depresión o problemas de salud mental)
- reacción alérgica (hipersensibilidad)
- habón (urticaria)
- hinchazón, en ocasiones de la cara o boca (angioedema), que puede causar dificultad para respirar
- sensación de somnolencia (somnolencia)
- aumento de peso
- sensación de mareo, durante o después de una inyección (reacciones vasovagales). Esto puede llevar a desmayos
- daño hepático (hepatotoxicidad). Los signos pueden incluir coloración amarillenta de la piel y del blanco de los ojos, pérdida de apetito, picor, sensibilidad estomacal, heces de color claro u orina anormalmente oscura
- aumento de la bilirrubina en la sangre, un producto de degradación de los glóbulos rojos, medida en los análisis de sangre.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Apretude
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
El médico o enfermero es responsable de conservar este medicamento correctamente.
No congelar.
6. Contenido del envase e información adicional
Composición de Apretude
- El principio activo es cabotegravir
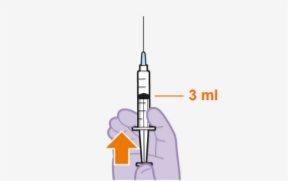
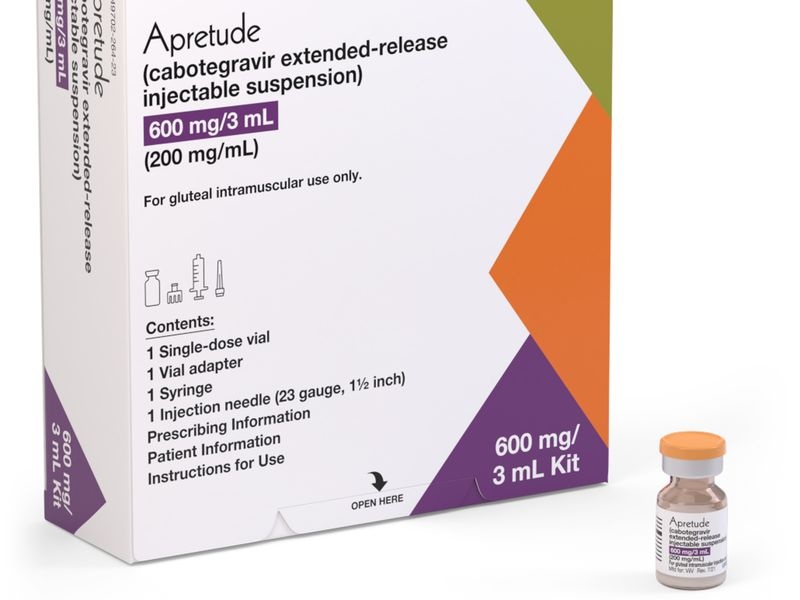
Cada vial de 3 ml contiene 600 mg de cabotegravir.
Los demás componentes son:
Manitol (E421)
Polisorbato 20 (E432)
Macrogol (E1521)
Agua para preparaciones inyectables
Aspecto del producto y contenido del envase
Cabotegravir es una suspensión de color blanco a rosa claro, que se presenta en un vial de vidrio color topacio con tapón de goma y un sello de aluminio con una tapa abatible de plástico.
Titular de la autorización de comercialización
ViiV Healthcare BV
Van Asch van Wijckstraat 55H,
3811 LP Amersfoort
Países Bajos
Responsable de la fabricación
GlaxoSmithKline Manufacturing S.p.A.
Strada Provinciale Asolana 90
Torrile
PR
43056
Italia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien ViiV Healthcare srl/bv Tél/Tel: + 32 (0) 10 85 65 00 | Lietuva ViiV Healthcare BV Tel: + 370 80000334 |
???????? ViiV Healthcare BV Te?.: + 359 80018205 | Luxembourg/Luxemburg ViiV Healthcare srl/bv Belgique/Belgien Tél/Tel: + 32 (0) 10 85 65 00 |
Ceská republika GlaxoSmithKline, s.r.o. Tel: + 420 222 001 111 | Magyarország ViiV Healthcare BV Tel.: + 36 80088309 |
Danmark GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 | Malta ViiV Healthcare BV Tel: + 356 80065004 |
Deutschland ViiV Healthcare GmbH Tel.: + 49 (0)89 203 0038-10 | Nederland ViiV Healthcare BV Tel: + 31 (0) 33 2081199 |
Eesti ViiV Healthcare BV Tel: + 372 8002640 | Norge GlaxoSmithKline AS Tlf: + 47 22 70 20 00 |
Ελλ?δα GlaxoSmithKline Μονοπρóσωπη A.E.B.E. Τηλ: + 30 210 68 82 100 | Österreich GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 |
España Laboratorios ViiV Healthcare, S.L. Tel: + 34 900 923 501 | Polska GSK Services Sp. z o.o. Tel.: + 48 (0)22 576 9000 |
France ViiV Healthcare SAS Tél.: + 33 (0)1 39 17 69 69 | Portugal VIIVHIV HEALTHCARE, UNIPESSOAL, LDA Tel: + 351 21 094 08 01 |
Hrvatska ViiV Healthcare BV Tel: + 385 800787089 | România ViiV Healthcare BV Tel: + 40 800672524 |
Ireland GlaxoSmithKline (Ireland) Limited Tel: + 353 (0)1 4955000 | Slovenija ViiV Healthcare BV Tel: + 386 80688869 |
Ísland Vistor hf. Sími: +354 535 7000 | Slovenská republika ViiV Healthcare BV Tel: + 421 800500589 |
Italia ViiV Healthcare S.r.l Tel: + 39 (0)45 7741600 | Suomi/Finland GlaxoSmithKline Oy Puh/Tel: + 358 (0)10 30 30 30 |
Κ?προς ViiV Healthcare BV Τηλ: + 357 80070017 | Sverige GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 |
Latvija ViiV Healthcare BV Tel: + 371 80205045 | United Kingdom (Northern Ireland) ViiV Healthcare BV Tel: + 44 (0)800 221441 |
Fecha de la última revisión de este prospecto:{MM/AAAA}.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Esta información está destinada únicamente a profesionales sanitarios:
| |
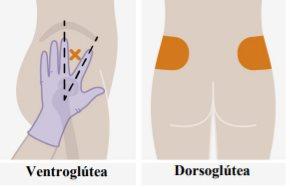
Descripción general En cada visita, se requiere una inyección; 3 ml de cabotegravir (600 mg). Cabotegravir es una suspensión que no necesita una dilución o reconstitución adicional. Cabotegravir es solo para uso intramuscular. Se debe administrar en la zona glútea. Nota:Se recomienda la zona ventroglútea. | |
Información de conservación | |
Nocongelar. | |
Para preparar la inyección | |
| |
Para administrar la inyección | |
Tenga en cuenta la constitución del paciente y el criterio médico para elegir la longitud de aguja apropiada. | |
También necesitará | |
| |
Preparación | |
| |
|
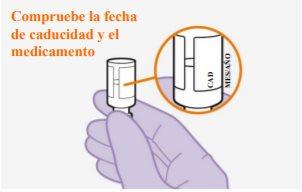
No utilizarsi ha pasado la fecha de caducidad
Nota:El vial de cabotegravir es de vidrio color topacio. |
| |
|
|
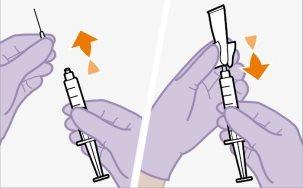
No permitaque nada toque el tapón de goma después de limpiarlo. | |
| |
|
|
| |
|
|
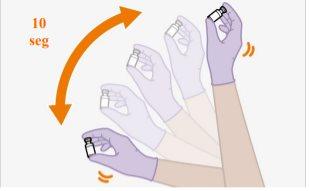
Nota:Compruebe que la suspensión parece uniforme y de un color blanco a rosa claro. | |
| |
|
|
Inyección | |
| |
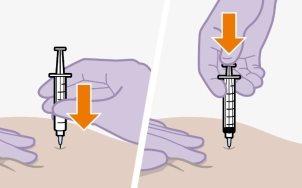
| Las inyecciones se deben administrar en los glúteos. Elija entre las siguientes zonas para la inyección:
|
Nota:Sólo para uso intramuscular glúteo. Nolo inyecte por vía intravenosa. | |
| |
|
|
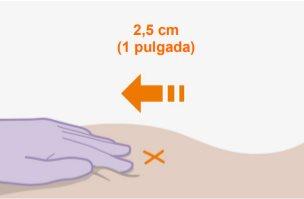
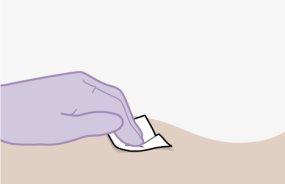
Nota:Limpie la zona de inyección con una toallita impregnada en alcohol. Deje que la piel se seque al aire antes de continuar. | |
| |
|
|
| |
|
|
| |
|
Nomasajee la zona. |
Preguntas y respuestas | |
Debe esperar al menos 15 minutos antes de administrar la inyección para que el medicamento alcance la temperatura ambiente. Lo mejor es dejar que el vial alcance la temperatura ambiente de manera natural. No obstante, puede usar el calor de sus manos para acelerar el tiempo de atemperación, pero asegúrese de que el vial no supere los 30ºC. No utilice ningún otro método de calentamiento.
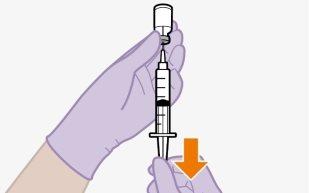
Lo mejor es inyectar el medicamento (a temperatura ambiente) lo antes posible después de extraerlo. Sin embargo, el medicamento puede permanecer en la jeringa hasta 2 horas antes de inyectarlo. Si el medicamento permanece en la jeringa más de 2 horas, la jeringa llena y la aguja deben desecharse.
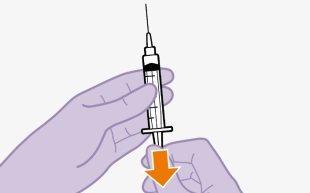
Inyectar 1 ml de aire en el vial facilita la extracción de la dosis con la jeringa. Sin el aire, parte del líquido puede retornar al vial sin querer, dejando menos medicamento de lo previsto en la jeringa.
Se recomienda la administración en la zona ventroglútea, en el músculo glúteo medio, porque está más alejada de los principales nervios y vasos sanguíneos. También es aceptable la administración en la zona dorsoglútea, en el músculo glúteo mayor, si así lo prefiere el profesional sanitario. La inyección no se debe administrar en ninguna otra zona. |
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a APRETUDE 600 MG SUSPENSION INYECTABLE DE LIBERACION PROLONGADAForma farmacéutica: COMPRIMIDO, 30 MGPrincipio activo: CabotegravirFabricante: Viiv Healthcare B.V.Requiere recetaForma farmacéutica: COMPRIMIDO, 30 mgPrincipio activo: CabotegravirFabricante: Viiv Healthcare B.V.Requiere recetaForma farmacéutica: INYECTABLE, 600 mgPrincipio activo: CabotegravirFabricante: Viiv Healthcare B.V.Requiere receta
Médicos online para APRETUDE 600 MG SUSPENSION INYECTABLE DE LIBERACION PROLONGADA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de APRETUDE 600 MG SUSPENSION INYECTABLE DE LIBERACION PROLONGADA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes