
AKANTIOR 0,8 MG/ML COLIRIO EN SOLUCION EN ENVASE UNIDOSIS

Cómo usar AKANTIOR 0,8 MG/ML COLIRIO EN SOLUCION EN ENVASE UNIDOSIS
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
AKANTIOR 0,8 mg/ml colirio en solución en envase unidosis
polihexanida
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es AKANTIOR y para qué se utiliza
- Qué necesita saber antes de empezar a usar AKANTIOR
- Cómo usar AKANTIOR
- Posibles efectos adversos
- Conservación de AKANTIOR
- Contenido del envase e información adicional
1. Qué es AKANTIOR y para qué se utiliza
AKANTIOR contiene el principio activo polihexanida.
AKANTIOR se usa en adultos y niños a partir de 12 años de edad para tratar la queratitis por Acanthamoeba. Acanthamoebaes un parásito (organismo diminuto que vive dentro de los seres humanos y que puede causar enfermedad) que puede causar una infección que da lugar a queratitis (inflamación de la córnea, la capa transparente de la parte frontal del ojo). La queratitis por Acanthamoebapuede causar defectos graves en la superficie de la córnea, incluidas úlceras (llagas abiertas).
AKANTIOR lesiona la membrana (piel externa) del parásito Acanthamoebay causa la salida del contenido celular, lo cual destruye la célula. AKANTIOR también impide que el parásito Acanthamoebahaga copias de su DNA al interferir con enzimas (proteínas) responsables del proceso de replicación, lo cual interrumpe el crecimiento y la reproducción del parásito en los seres humanos.
2. Qué es AKANTIOR y para qué se utiliza
No use AKANTIOR
Si es alérgico a polihexanida o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar AKANTIOR.
El tratamiento con AKANTIOR puede causar molestias oculares de leves a moderadas (como dolor ocular) y ojo rojo. Si experimenta una reacción ocular grave, póngase en contacto con su médico.
Niños y adolescentes
No se recomienda utilizar AKANTIOR en niños menores de 12 años, ya que no se ha estudiado en este grupo de edad.
Otros medicamentos y AKANTIOR
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Si está utilizando otro colirio,espere al menos 5 minutos entre la aplicación de AKANTIOR y la aplicación del otro colirio. AKANTIOR se debe administrar el último.
Embarazo y lactancia
No hay experiencia del uso de AKANTIOR en mujeres embarazadas. No se recomienda utilizar AKANTIOR durante el embarazo. Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Se desconoce si AKANTIOR se excreta en la leche materna. Consulte a su médico o farmacéutico antes de empezar el tratamiento con AKANTIOR.
Conducción y uso de máquinas
Su visión puede ser temporalmente borrosa después de usar AKANTIOR. No conduzca ni use máquinas hasta que su visión sea clara de nuevo.
AKANTIOR contiene fosfatos
Este medicamento contiene 0,37 mg de fosfatos en cada gota equivalente a 10,66 mg/ml. Si sufre de daño grave en la capa trasparente de la parte frontal del ojo (córnea) el tratamiento con fosfatos, en casos muy raros, puede provocar parches nublados en la córnea debido al calcio.
3. Cómo usar AKANTIOR
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
El tratamiento consta de dos partes: tratamiento intensivo durante los primeros 19 días y tratamiento de continuación a partir del día 20.
La dosis recomendada es 1 gotade AKANTIOR en el ojo afectado tal como se indica a continuación:
Tratamiento intensivo inicial (19 días)
- Aplicar una gota cada hora (16 veces al día) durante los primeros cinco días (días del 1 al 5)
- Aplicar una gota cada 2 horas (8 veces al día) durante los siguientes siete días (días del 6 al 12)
- Aplicar una gota cada 3 horas (6 veces al día) durante los siguientes siete días (días del 13 al 19)
Tratamiento de continuación
- Aplicar una gota cada 4 horas (4 veces al día) hasta que no haya inflamación corneal ni signos de infección (el ojo está curado).
Su médico le indicará cuándo interrumpir el tratamiento.
Instrucciones de uso
- Lávese las manos.
- Abra el sobre de aluminio que contiene los envases unidosis.
- Separa el envase unidosis de la tira y coloque los envases sin abrir de nuevo en el sobre.
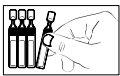
- Abra el envase unidosis girando la parte superior sin tirar de ella. No toque la punta después de abrir el envase.
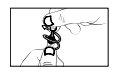
- Incline la cabeza hacia atrás. El envase está ahora abierto. Mantenga el envase unidosis en posición vertical y no lo presione.
- Utilice un dedo para tirar hacia abajo suavemente del párpado inferior del ojo afectado.
- Invierta el envase unidosis y coloque la punta del envase cerca de su ojo. No toque el ojo ni el párpado con la punta del envase.

- Presione el envase unidosis para administrar únicamente una gota y, a continuación, suelte el párpado inferior.
- Cierre el ojo y presione un dedo sobre el ángulo interno (nasal) del ojo afectado. Mantenga la presión 2 minutos.
- Deseche el envase unidosis después de usarlo.
Si usa más AKANTIOR del que debe
Aplíquese la siguiente dosis a la hora habitual, ya que es improbable que le cause daños graves.
Si olvidó usar AKANTIOR
Aplique la siguiente dosis a la hora habitual. No use una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con AKANTIOR
Use AKANTIOR tal como le haya indicado el médico para conseguir el máximo efecto. Informe siempre a su médico si piensa interrumpir el tratamiento.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
La mayoría de los efectos adversos suelen producirse en el ojo tratado.
Póngase en contacto con su médicosi tiene una reacción grave en el ojo.
Se han comunicado los siguientes efectos adversos:
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas)
- dolor ocular
- hiperemia ocular (ojo rojo)
Frecuentes(pueden afectar a hasta 1 de cada 10 personas)
- perforación corneal (lesión de la superficie de la córnea)
- deficiencia visual
- queratitis ulcerosa (inflamación o infección de la córnea)
- defectos del epitelio corneal (defectos de la capa más externa de la córnea)
- infiltrados corneales (respuesta inmunitaria a una lesión corneal)
- queratitis punteada (pequeños desgarros en la superficie del ojo)
- lagrimeo (ojos llorosos)
- hiperemia conjuntival (enrojecimiento de la conjuntiva)
- inflamación ocular
- irritación ocular
- fotofobia (sensibilidad molesta del ojo a la luz)
- papilas conjuntivales (enrojecimiento, hinchazón e irritación de la cara interna del párpado)
- prurito ocular (picor en los ojos)
- secreción ocular
- hinchazón ocular
- sensación de cuerpo extraño en el ojo
- molestias oculares
- ojo seco
- conjuntivitis (inflamación de la capa más externa del ojo)
- infección ocular
- agravamiento del trastorno (empeoramiento de la enfermedad)
- intolerancia al producto (hipersensibilidad al medicamento)
- reacciones en el lugar de aplicación tales como dolor
- reacciones en el lugar de aplicación tales como molestias
- reacciones en el lugar de aplicación tales como prurito (picor)
- defecto epitelial persistente (pérdida persistente de la capa más externa de la córnea después de la lesión)
- toxicidad para diversos agentes
- necesidad de trasplante de córnea
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de AKANTIOR
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica del producto sin abrir.
Este medicamento no requiere condiciones especiales de conservación.
Después de abrir el sobre, los envases unidosis deben usarse en un plazo de 28 días. Después de este período, los envases unidosis sin usar se deben eliminar.
El contenido del envase unidosis se debe usar justo después de abrir el envase y el contenido restante debe eliminarse.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de AKANTIOR
- El principio activo es polihexanida. Cada mililitro de solución contiene 0,8 mg de polihexanida.
- Los demás componentes son dihidrogenofosfato de sodio monohidrato, fosfato de disodio dodecahidrato, cloruro de sodio y agua purificada.
AKANTIOR contiene fosfatos (ver sección 2).
Aspecto del producto y contenido del envase
AKANTIOR colirio en solución en envase unidosis (colirio) es una solución transparente e incolora en un envase unidosis.
Los envases unidosis están envasados en tiras selladas de 5 unidades que, a su vez, están incluidas en un sobre de poliéster/aluminio/polietileno y acondicionadas dentro de una caja.
Tamaños de envases:
- 20 envases unidosis
- 30 envases unidosis
- envase múltiple que contiene 120 (4 envases de 30) envases unidosis.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
SIFI S.p.A.
Via Ercole Patti, 36
95025 Aci Sant'Antonio (CT)
Italia
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Puede acceder a información detallada y actualizada sobre este medicamento escaneando con su teléfono móvil (smartphone) o dispositivo el código QR incluido en el prospecto y en la caja. También puede acceder a esta información en la siguiente dirección de internet: https://qr.sifigroup.com/akantior/.
[código QR]
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a AKANTIOR 0,8 MG/ML COLIRIO EN SOLUCION EN ENVASE UNIDOSISForma farmacéutica: COLIRIO, 50 mg/mlPrincipio activo: Povidona iodadaRequiere recetaForma farmacéutica: POMADA OFTALMICA, 20 mg/gPrincipio activo: bibrocatholFabricante: Brill Pharma S.L.Requiere recetaForma farmacéutica: COLIRIO, 5 mg/mlPrincipio activo: moxifloxacinaFabricante: Tiedra Farmaceutica S.L.Requiere receta
Médicos online para AKANTIOR 0,8 MG/ML COLIRIO EN SOLUCION EN ENVASE UNIDOSIS
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de AKANTIOR 0,8 MG/ML COLIRIO EN SOLUCION EN ENVASE UNIDOSIS, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















