
ACTUATOS 35 MG JARABE EN SOBRES

Cómo usar ACTUATOS 35 MG JARABE EN SOBRES
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Actúatos 35 mgjarabe en sobres
extracto seco deHedera helix L.(hiedra)
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento porque contiene información importante para usted.
Siga exactamente las instrucciones de administración del medicamento contenidas en este prospecto o las indicadas por su médico o farmacéutico.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si necesita consejo o más información, consulte a su farmacéutico.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
- Debe consultar a un médico si empeora o si no mejora después de 7 días.
Contenido del prospecto
- Qué es actúatos y para qué se utiliza
2.
- Cómo tomar actúatos
4.
- Conservación de actúatos
6.
1. Qué es actúatos y para qué se utiliza
Actúatos 35 mg jarabe en sobres es un medicamento a base de plantas utilizado como expectorante para la tos productiva en adultos, adolescentes y niños a partir de 6 años.
2. Qué necesita saber antes de empezar a tomar actúatos
No tome actúatos :
- Si es alérgico a la hiedra (Hedera helix L.), a plantas de la familia de las Araliáceas o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- No administrar a niños menores de 2 años ya que con los expectorantes existe el riesgo de que se agraven los síntomas respiratorios.
Advertencias y precauciones:
Consulte a su médico o farmacéutico antes de empezar a tomar este medicamento.
Se debe consultar con el médico o farmacéutico en los casos de disnea (dificultad para respirar), fiebre o esputos purulentos.
Se recomienda precaución en pacientes con gastritis o úlcera gástrica.
En caso de empeoramiento de los síntomas o si no se produjera mejoría después de 7 días de iniciar el tratamiento, éste deberá ser interrumpido y se deberá consultar con el médico.
Niños
Este medicamento no debe administrar a niños de 2 a 5 años ya que no puede dosificarse adecuadamente, existen otras formulaciones más adecuadas para este grupo de edad.
Toma de actúatos con otros medicamentos:
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
Embarazo, lactancia y fertilidad:
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Embarazo y lactancia:
No se ha establecido la seguridad de este medicamento durante el embarazo y lactancia, en consecuencia, no se recomienda su utilización en estas circunstancias.
Fertilidad:
No existen datos disponibles sobre fertilidad.
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas.
Actúatoscontiene sorbitol.
Este medicamento contiene 1.925 mg de sorbitol en cada sobre de 5 ml (385 mg por cada ml).
El sorbitol es una fuente de fructosa. Si su médico le ha indicado que usted (o su hijo) padecen una intolerancia a ciertos azúcares, o se les ha diagnosticado intolerancia hereditaria a la fructosa (IHF), una enfermedad genética rara, en la que el paciente no puede descomponer la fructosa, consulte usted (o su hijo) con su médico antes de tomar este medicamento.
El sorbitol puede provocar malestar gastrointestinal y un ligero efecto laxante.
3. Cómo tomar actúatos
Siga exactamente las instrucciones de administración de este medicamento contenidas en este prospecto o las indicadas por su médico o farmacéutico. En caso de duda, pregunte a su médico o farmacéutico.
La dosis recomendada es:
- Adolescentes y adultos: 1 sobre de 5 ml de jarabe, 2 o 3 veces al día (equivalente a 70-105 mg diarios de extracto seco de hoja de hiedra).
- Niños entre 6 y 11 años de edad:1 sobre de 5 ml de jarabe 2 veces al día (equivalente a 70 mg diarios de extracto seco de hoja de hiedra).
Este medicamento no debe administrase a niños de 2 a 5 años, ya que no puede dosificarse adecuadamente, existiendo otras formulaciones más apropiadas para este grupo de edad.
Si estima que la acción de este medicamento es demasiado fuerte o débil, comuníqueselo a su médico o farmacéutico.
Este medicamentose toma por vía oral.
Para más detalles del uso de los sobres, siga los diagramas siguientes:
Presionar suavemente el sobre antes de usarlo, como se muestra.
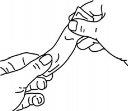
Sujetar firmemente el sobre y rasgar el sobre por donde indican las rayas.
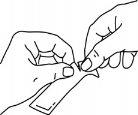
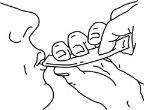
Tragar el medicamento, apretando el sobre hasta que quede vacío.
Debe consultar a un médico si empeora o no mejora después de una semana de tratamiento.
Si toma más actúatosdel que debe
La sobredosis puede provocar náuseas, vómitos, diarrea y agitación.
En el caso de que se haya tomado más actúatos del que debiera o en caso de sobredosis o ingestión accidental consulte inmediatamente a su médico o farmacéutico o llame al Servicio de Información Toxicológica, teléfono 915 620 420, indicando el medicamento y la cantidad ingerida.
Si olvidó tomaractúatos:
No tome una dosis doble para compensar la dosis olvidada.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Frecuencia no conocida: se han notificado reacciones de tipo gastrointestinal como náuseas, vómitos y diarrea y reacciones alérgicas como urticaria, erupciones cutáneas, dificultad para respirar y reacción anafiláctica.
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de actúatos
Mantener este medicamento fuera de la vista y del alcance de los niños.
No requiere condiciones especiales de conservación.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase, después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de actúatos 35 mg jarabe en sobres :
- El principio activo es: extracto seco de hoja de Hedera helix.
5 ml de actúatos 35 mg jarabe en sobres contiene 35 mg de extracto seco de Hedera helix L., hoja (hojas de hiedra) (4-8:1), disolvente de extracción: etanol 30 % m/m.
- Los demás componentes son: agua purificada, sorbato de potasio, ácido cítrico, sorbitol líquido no cristalizable (E-420), goma de xantano y aroma de cereza. Consultar sección 2 “Actúatos contiene sorbitol”
Aspecto del producto y contenido del envase:
Actúatos 35 mg jarabe en sobres se presenta en sobres que contienen 5 ml de jarabe.
Sobres monodosis compuestos de una lámina compleja de aluminio (PET/Aluminio/PE/PET/PE). Envases con 20 sobres monodosis.
Titular de la autorización de comercialización y reponsable de la fabricación:
Titular de la autorización de comercialización
Adventia Pharma, S.L.
Calle Viera y Clavijo, 30, 2º
35002 Las Palmas de Gran Canaria (España)
Responsable de la fabricación:
Kern Pharma S.L.
Venus, 72 - Pol. Ind. Colón II
08228 Terrassa - Barcelona
España
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Actúa Pharma, S.L.
Calle Viera y Clavijo, 30, 2º
35002 Las Palmas de Gran Canaria (España)
Fecha de la última revisión de este prospecto: Junio 2025
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
- País de registro
- Principio activo
- Requiere recetaNo
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a ACTUATOS 35 MG JARABE EN SOBRESForma farmacéutica: SOLUCIÓN/SUSPENSIÓN ORAL, 7 mg/mlPrincipio activo: Hederae helicis foliumFabricante: Engelhard Arzneimittel Gmbh & Co. KgNo requiere recetaForma farmacéutica: SOLUCIÓN/SUSPENSIÓN ORAL, 7 mg/mlPrincipio activo: Hederae helicis foliumFabricante: Adventia Pharma S.L.No requiere recetaForma farmacéutica: SOLUCIÓN/SUSPENSIÓN ORAL, 8,25 mg/mlPrincipio activo: Hederae helicis foliumFabricante: Laboratorios Cinfa S.A.No requiere receta
Médicos online para ACTUATOS 35 MG JARABE EN SOBRES
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de ACTUATOS 35 MG JARABE EN SOBRES, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















