Cómo usar Zivafert
HOJA DE INSTRUCCIONES PARA EL PACIENTE
Hoja de instrucciones incluida en el paquete: información para el paciente
Zivafert, 5000 UI
Polvo y disolvente para preparar una solución para inyección
Gonadotropina coriónica
Este medicamento estará sujeto a un seguimiento adicional para permitir la identificación rápida de nueva información sobre seguridad. El usuario del medicamento también puede ayudar comunicando cualquier efecto adverso que se produzca después de la administración del medicamento. Para saber cómo comunicar efectos adversos, ver el punto 4.
Es importante leer atentamente el contenido de la hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para una persona. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Ver el punto 4.
Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Ver el punto 4.
- En esta hoja de instrucciones, el medicamento Zivafert 5000 UI polvo y disolvente para preparar una solución para inyección se denomina Zivafert.
Índice de la hoja de instrucciones
- 1. Qué es Zivafert y para qué se utiliza
- 2. Información importante antes de tomar Zivafert
- 3. Cómo tomar Zivafert
- 4. Posibles efectos adversos
- 5. Cómo conservar Zivafert
- 6. Contenido del paquete y otra información
1. Qué es Zivafert y para qué se utiliza
Qué es Zivafert:
Zivafert contiene gonadotropina coriónica humana altamente purificada, una hormona obtenida del orina humana, que pertenece a la familia de las "gonadotropinas", hormonas naturales responsables de la reproducción y la fertilidad.
Cuándo se utiliza Zivafert:
Zivafert se utiliza para:
- estimular el crecimiento y la maduración de varios folículos (cada uno de los cuales contiene un óvulo) en mujeres sometidas a técnicas de reproducción asistida (un procedimiento que puede ayudar a quedar embarazada), como la "fertilización in vitro";
- estimular la liberación de un óvulo del ovario (inducción de la ovulación) en mujeres que no pueden producir óvulos (anovulación) o que producen demasiado pocos óvulos (oligoovulación).
Este medicamento debe utilizarse bajo la supervisión de un médico, a menos que el médico indique lo contrario.
2. Información importante antes de tomar Zivafert
Cuándo no se debe tomar Zivafert:
- si el paciente es alérgico a la gonadotropina coriónica humana o a cualquier otro componente de este medicamento (enumerados en el punto 6);
- si el paciente tiene enfermedades no tratadas de la glándula tiroides, la pituitaria o las suprarrenales;
- si el paciente tiene cáncer de ovario, útero o mama;
- si el paciente tiene una condición que impida un embarazo normal, como la insuficiencia ovárica, la ausencia de útero, la menopausia prematura, la obstrucción de las trompas de Falopio, los fibromas uterinos o otras anormalidades de los órganos genitales;
- si el paciente ha tenido un sangrado vaginal inexplicable recientemente.
Debe informar a su médico o farmacéutico si el paciente tiene alguna de las condiciones anteriores, ya que este medicamento puede no ser adecuado para el paciente.
Advertencias y precauciones
Antes de comenzar el tratamiento, el médico debe verificar que los órganos genitales del paciente sean normales.
Antes de comenzar a tomar Zivafert, debe discutir con su médico si el paciente tiene o ha tenido alguna de las siguientes condiciones:
- anomalías de los órganos genitales;
- enfermedades crónicas (como la diabetes, los trastornos cardiovasculares, etc.);
- complicaciones vasculares (es decir, un mayor riesgo de coágulos sanguíneos, coágulos sanguíneos en el paciente en el pasado o en la familia del paciente, sobrepeso).
Pruebas médicas
Hasta 10 días después de la administración de Zivafert, la prueba de embarazo puede dar un resultado falso positivo.
Durante el tratamiento con Zivafert, pueden ocurrir:
- Síndrome de hiperestimulación ovárica
- El tratamiento con hormonas gonadotrópicas, como Zivafert, puede causar síndrome de hiperestimulación ovárica. Esta es una enfermedad grave en la que los ovarios están sobreestimulados, y los folículos ováricos en desarrollo alcanzan un tamaño demasiado grande. En casos raros, el síndrome de hiperestimulación ovárica grave puede ser una amenaza para la vida. Por lo tanto, es muy importante que el paciente esté bajo la supervisión cuidadosa de un médico. El médico realizará una prueba de ultrasonido (USG) de los ovarios para verificar los efectos del tratamiento. También puede recomendar un control de los niveles de hormonas en la sangre (ver también el punto 4).
La hiperestimulación ovárica puede causar una acumulación rápida de líquido en la cavidad abdominal y en el tórax. También pueden formarse coágulos sanguíneos. Debe consultar a un médico de inmediato si experimenta:
- un aumento significativo del tamaño de la cavidad abdominal y dolor abdominal;
- náuseas;
- vómitos;
- un aumento rápido de peso debido a la acumulación de líquido;
- diarrea;
- una disminución de la producción de orina;
- problemas para respirar.
Torsión ovárica
La torsión ovárica es una condición en la que el ovario se tuerce, lo que puede causar una interrupción del suministro de sangre al ovario.
Antes de comenzar a tomar este medicamento, debe informar a su médico si:
- el paciente ha tenido síndrome de hiperestimulación ovárica en el pasado;
- el paciente está embarazada o sospecha que puede estar embarazada;
- el paciente ha tenido una operación en la cavidad abdominal;
- el paciente ha tenido una torsión ovárica en el pasado;
- el paciente ha tenido quistes ováricos o de los ovarios en el pasado o en la actualidad.
Coágulos sanguíneos (trombosis)
El embarazo aumenta el riesgo de formación de coágulos sanguíneos.
Si el paciente tiene factores de riesgo para la formación de coágulos sanguíneos (por ejemplo, sobrepeso o coágulos sanguíneos en la familia), el riesgo de formación de coágulos sanguíneos en un vaso sanguíneo puede aumentar durante el tratamiento de fertilización in vitro.
Los coágulos sanguíneos pueden estar asociados con enfermedades graves, como:
- émbolos pulmonares (tromboembolismo pulmonar);
- accidente cerebrovascular;
- infarto de miocardio;
- disminución del flujo sanguíneo a los órganos vitales, lo que puede causar daño a los órganos;
- disminución del flujo sanguíneo (trombosis venosa profunda) a las manos o los pies, lo que puede causar la amputación de una mano o un pie.
Embarazos múltiples, defectos de nacimiento, aborto o complicaciones del embarazo
Los embarazos que ocurren después del tratamiento con Zivafert son más frecuentemente embarazos gemelares o múltiples.
Los embarazos múltiples están asociados con un mayor riesgo para la madre y el feto durante el período perinatal.
En mujeres que están siendo tratadas por infertilidad, existe un riesgo ligeramente aumentado de aborto o implantación ectópica (embarazo ectópico). Por lo tanto, el médico debe realizar una prueba de ultrasonido temprana para descartar la posibilidad de un embarazo ectópico. El nacimiento múltiple es más probable si el paciente está tomando otros medicamentos que estimulan la ovulación (por ejemplo, hMG).
No se sabe si el tratamiento de fertilización in vitrocausa defectos de nacimiento o ciertos tumores de los órganos genitales.
Niños y adolescentes
Zivafert no está indicado para su uso en niños y adolescentes.
Zivafert y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que el paciente está tomando actualmente o ha tomado recientemente, así como sobre cualquier medicamento que el paciente planea tomar, incluyendo aquellos que se pueden obtener sin receta. Esto es especialmente importante si el paciente está tomando medicamentos que:
- estimulan la ovulación (por ejemplo, hMG);
- contienen corticosteroides, especialmente en dosis altas.
Embarazo y lactancia
No debe tomar Zivafert si el paciente está embarazada o en período de lactancia. Si el paciente sospecha que puede estar embarazada, debe consultar a su médico antes de tomar este medicamento.
Conducción de vehículos y uso de maquinaria
Zivafert no afecta la capacidad de conducir vehículos o operar maquinaria.
Zivafert contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por inyección, es decir, el medicamento se considera "sin sodio".
3. Cómo tomar Zivafert
Zivafert es un polvo que debe disolverse en un líquido (disolvente) antes de su administración; se administra por inyección subcutánea o intramuscular. La solución se prepara mezclando el disolvente con el polvo y debe utilizarse inmediatamente después de su preparación.
Este medicamento debe administrarse siempre según las indicaciones de un médico. En caso de dudas, debe consultar a su médico o farmacéutico.
Método de administración
Cómo se administra Zivafert:
Zivafert se administra por inyección subcutánea o intramuscular.
Cada vial debe utilizarse solo una vez, y la inyección debe administrarse inmediatamente después de la preparación de la solución.
La dosis recomendada de Zivafert es de 5.000 UI o 10.000 UI. El medicamento debe administrarse dentro de las 24-48 horas después de que se haya alcanzado la estimulación óptima del crecimiento de los folículos.
Después de proporcionar al paciente la orientación y el entrenamiento adecuados, el médico puede recomendar que el paciente se administre Zivafert por sí mismo.
Antes de la primera administración por sí mismo, el médico:
- explicará cómo preparar la dosis adecuada del medicamento;
- mostrará cómo preparar la solución para inyección;
- mostrará los posibles lugares donde se puede administrar la inyección;
- permitirá que el paciente practique la administración de la inyección subcutánea por sí mismo.
Antes de administrar Zivafert por sí mismo, debe leer atentamente las siguientes instrucciones.
Cómo preparar la solución de Zivafert con 1 vial de polvo:
La solución debe prepararse justo antes de la administración. Cada vial está destinado solo para un uso único.
Zivafert solo puede prepararse con el disolvente proporcionado en el paquete, según las siguientes instrucciones:
Paso 1
Lavar las manos antes de preparar la solución. Utilizar una superficie limpia para preparar la solución. Es importante que las manos y los objetos utilizados estén lo más limpios posible.
Paso 2
Colocar los siguientes objetos en una superficie limpia:
- dos algodones empapados en alcohol (no incluidos en el kit);
- un vial que contiene el polvo de Zivafert;
- un disolvente en una jeringa de vidrio;
- una aguja larga para reconstitución y administración intramuscular;
- una aguja corta para administración subcutánea.
Paso 3
- Retirar solo la tapa de la jeringa de vidrio.
- Colocar la aguja para reconstitución (aguja larga) con la cubierta protectora en la jeringa y verificar que la aguja esté bien sujeta para evitar que la solución se escape. Si la solución se escapa, debe intentar ajustar la aguja, girándola ligeramente.
- Colocar la jeringa en una superficie limpia.
- Evitar tocar la aguja.
Paso 4
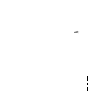
- Retirar la tapa de plástico de color del vial de Zivafert, presionándolo suavemente hacia arriba.
- Limpie el tapón de goma con un algodón empapado en alcohol y deje que se seque.
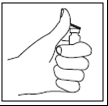
Paso 5
- Tomar la jeringa, retirar la cubierta protectora de la aguja y perforar la aguja a través del centro de goma del vial de Zivafert.
- Presionar firmemente el émbolo y administrar lentamente el disolvente en el vial con el polvo a través del tapón de goma para administrar toda la solución en el vial que contiene el polvo.
- No agitar, girar suavemente el vial en las manos hasta que el polvo se disuelva completamente, teniendo cuidado de no crear espuma.
Paso 6
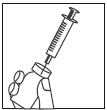
Después de disolver el polvo (lo que generalmente ocurre de inmediato), extraer lentamente la solución en la jeringa, como se describe a continuación:
- Dejar la aguja insertada, girar el vial hacia abajo.
- Asegurarse de que la punta de la aguja esté por debajo del nivel del líquido.
- Tirar suavemente del émbolo para extraer toda la solución de Zivafert en la jeringa.
- Verificar que la solución reconstituida sea transparente y sin color.
Preparación de dosis más altas utilizando más de 1 vial de polvo:
Si el médico ha recetado una dosis más alta de Zivafert, 10.000 UI, se puede lograr utilizando dos viales de polvo y una jeringa de vidrio con disolvente.
Al preparar 2 viales de Zivafert, al final del paso 3 anterior, se debe extraer el contenido reconstituido del primer vial en la jeringa y administrarlo lentamente en el segundo vial.
Repetir los pasos del 4 al 6 para el segundo vial.
La solución debe ser transparente y sin color.
Administración intramuscular:
En el caso de la administración intramuscular, el médico o la enfermera prepararán y luego administrarán Zivafert en el muslo o los glúteos.
Administración subcutánea:
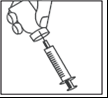
- Cuando la jeringa contenga la dosis adecuada, colocar la cubierta protectora en la aguja larga. Retirar la aguja larga de la jeringa y reemplazarla con la aguja corta para la administración subcutánea con la cubierta protectora colocada. Debe verificar que la aguja esté bien sujeta y presionar firmemente la aguja corta en el cilindro de la jeringa, y luego girarla ligeramente para asegurarse de que esté completamente asegurada, para evitar que la solución se escape.
- Retirar la cubierta protectora de la aguja. Sostener la jeringa con la aguja hacia arriba y golpear suavemente el lado de la jeringa para hacer que cualquier burbuja de aire suba.
- Presionar el émbolo hasta que aparezca una gota de líquido en la punta de la aguja.
- No utilizar la solución si contiene partículas o es turbia.
- El médico o la enfermera aconsejarán en qué lugar del cuerpo se debe administrar el medicamento. Los lugares típicos son los muslos o la parte inferior del abdomen (por debajo del ombligo).
- Limpie el lugar de la inyección con un algodón empapado en alcohol.
- Apretar firmemente la piel. Con la otra mano, introducir la aguja con un movimiento firme en un ángulo de 45° o 90°.
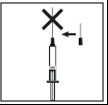
Lugar de la inyección:
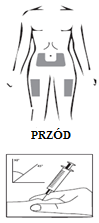
Administración de la solución:
- La solución debe administrarse subcutáneamente según las indicaciones del médico.
- No administrar la solución directamente en una vena.
- Presionar lentamente el émbolo para administrar la solución de manera uniforme, para que no se dañen los tejidos de la piel.
Dedique el tiempo necesario para administrar el volumen prescrito de la solución.
Retirada de la aguja:
- Retirar rápidamente la jeringa y aplicar presión en el lugar de la inyección.
- Masajear suavemente el lugar de la inyección, mientras se mantiene la presión, para ayudar a dispersar la solución de Zivafert y aliviar el malestar.
Eliminación de todos los artículos utilizados:
Después de la administración, todas las agujas y jeringas vacías deben desecharse en un contenedor adecuado. Todos los residuos de la solución o desechos deben eliminarse de acuerdo con las regulaciones locales.
Uso de una dosis más alta de lo recomendado de Zivafert
No se conocen los efectos de la sobredosis de Zivafert, sin embargo, se puede esperar la ocurrencia de síndrome de hiperestimulación ovárica (ver "Posibles efectos adversos"). En caso de administrar una dosis más alta de la recomendada de Zivafert, debe consultar a un médico o farmacéutico.
Omision de la administración de Zivafert
En caso de omitir la administración de Zivafert, debe consultar a un médico de inmediato.
Interrupción del tratamiento con Zivafert
Si no planea tomar este medicamento, debe consultar a un médico.
En caso de dudas adicionales sobre la administración de este medicamento, debe consultar a un médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, Zivafert puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
En caso de observar alguno de los siguientes efectos adversos graves, debe interrumpir el tratamiento con Zivafert y buscar atención médica de inmediato - puede ser necesaria ayuda médica de emergencia:
- Estimulación ovárica excesiva leve o moderada (síndrome de hiperestimulación ovárica), que se manifiesta como un aumento del tamaño de los ovarios, quistes ováricos, dolor abdominal con náuseas y vómitos (ver también el punto 2. "Síndrome de hiperestimulación ovárica"). Este es un efecto adverso común (puede ocurrir en hasta 1 de cada 10 personas).
- Estimulación ovárica excesiva grave caracterizada por dolor en la parte inferior del abdomen (pelvis), náuseas, vómitos, aumento de peso, acumulación de líquido en la cavidad abdominal (ascitis) o en el tórax (derrame pleural). Este es un efecto adverso poco común (puede ocurrir en hasta 1 de cada 100 personas).
- Ruptura de un quiste ovárico (como una complicación rara del síndrome de hiperestimulación ovárica grave, puede ocurrir en hasta 1 de cada 1.000 personas).
- Formación de coágulos sanguíneos en los vasos sanguíneos (eventos tromboembólicos), como una complicación del síndrome de hiperestimulación ovárica. Este es un efecto adverso raro (puede ocurrir en hasta 1 de cada 1.000 personas).
- Reacciones alérgicas graves generalizadas que pueden incluir: hinchazón de la cara, ojos, labios, garganta o lengua, dificultad para respirar, sibilancias, erupciones cutáneas. Este es un efecto adverso raro (puede ocurrir en hasta 1 de cada 1.000 personas).
Otros efectos adversos:
Efectos adversos comunes(pueden ocurrir en hasta 1 de cada 10 personas):
- reacción en el lugar de la inyección, que puede incluir enrojecimiento, moretones, hinchazón, picazón o dolor en el lugar de la inyección;
- hinchazón;
- cambios de humor;
- dolor de cabeza;
- dolor en los senos.
Efectos adversos poco comunes(pueden ocurrir en hasta 1 de cada 100 personas):
- ansiedad (agitación);
- fatiga.
Efectos adversos raros(pueden ocurrir en hasta 1 de cada 1.000 personas):
- hinchazón en las capas profundas de la piel, a menudo con urticaria;
- erupciones cutáneas generalizadas.
Si ocurre alguno de los efectos adversos raros mencionados anteriormente, debe buscar atención médica de inmediato, ya que el médico debe evaluar si es necesario interrumpir el tratamiento con Zivafert o buscar ayuda médica de emergencia.
Notificación de efectos adversos
Si ocurren efectos adversos, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos se pueden notificar directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Calle de Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 24 99
Fax: +34 91 596 24 90
Sitio web: https://www.aemps.gob.es/.
Los efectos adversos también se pueden notificar al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Zivafert
Debe conservar este medicamento en un lugar donde no pueda ser visto o alcanzado por los niños.
No conservar a temperaturas superiores a 25°C. Conservar el vial y la jeringa de vidrio con disolvente en el paquete exterior para protegerlo de la luz.
La solución debe utilizarse inmediatamente después de su preparación.
No use este medicamento después de la fecha de caducidad que se indica en el paquete, vial, jeringa de vidrio con disolvente, después de EXP. Si la fecha de caducidad está indicada como mes/año, la fecha de caducidad es el último día del mes indicado.
No use este medicamento si nota que la solución no es transparente (turbia o contiene partículas visibles). Después de la reconstitución, la solución debe ser transparente y sin color.
No deseche los medicamentos por el desagüe. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Zivafert
- El principio activo de Zivafert es la gonadotropina coriónica humana.
- Los demás componentes son:
- vial de polvo: lactosa monohidratada;
- jeringa de vidrio con disolvente (solución al 0,9% de cloruro de sodio): agua para inyección, cloruro de sodio.
Cada vial contiene: gonadotropina coriónica humana 5.000 UI, obtenida de la orina humana.
Cómo se presenta Zivafert y qué contiene el paquete
Zivafert está disponible como:
Polvo en vial: polvo liofilizado de color blanco a casi blanco.
Disolvente en jeringa de vidrio: solución transparente y sin color.
Un paquete individual contiene:
Una bandeja de plástico que contiene el polvo en vial de vidrio transparente tipo I, cerrado con un tapón de goma de bromobutilo con una tapa de aluminio tipo flip-off.
1 ml de disolvente en jeringa de vidrio de vidrio transparente tipo I con un tapón de goma de clorobutilo (que también actúa como émbolo) con una cubierta de isopreno y bromobutilo, y 1 aguja para inyección y 1 aguja para inyección subcutánea.
El paquete colectivo (10+10) contiene 10 bandejas de plástico, como se describe anteriormente.
No todas las tallas de paquete pueden estar en circulación.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización:
IBSA Farmaceutici Italia s.r.l.
Via Martiri di Cefalonia 2
26900 Lodi
Italia
[email protected]
Importador:
IBSA Farmaceutici Italia srl
Via Martiri di Cefalonia 2
26900 Lodi
Italia
Este medicamento está autorizado en los países miembros del Espacio Económico Europeo bajo los siguientes nombres:
AT:
Zivafert
DK:
Gonasi Set
CZ:
Zivafert
EL:
Zivafert
ES:
Gonasi Kit
FI:
Gonasi Set
FR:
GONADOTROPHINE CHORIONIQUE IBSA
HU:
Zivafert Kit
NL:
Gonasi
NO:
Gonasi Set
PL:
Zivafert
SE:
Gonasi Set
SK:
Gonasi Kit
Fecha de la última actualización de la hoja de instrucciones:enero 2025
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorIBSA Farmaceutici Italia S.r.l.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a ZivafertForma farmacéutica: Polvo, 1500 UIPrincipio activo: chorionic gonadotrophinFabricante: Ferring GmbHRequiere recetaForma farmacéutica: Polvo, 5000 UIPrincipio activo: chorionic gonadotrophinFabricante: Ferring GmbHRequiere recetaForma farmacéutica: Polvo, 75 UIPrincipio activo: UrofolitropinaRequiere receta
Alternativas a Zivafert en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Zivafert en Ukraine
Alternativa a Zivafert en Spain
Médicos online para Zivafert
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Zivafert – sujeta a valoración médica y normativa local.