
Riastap

Consulta con un médico sobre la receta médica de Riastap

Cómo usar Riastap
HOJA DE INSTRUCCIONES: INFORMACIÓN PARA EL PACIENTE
Riastap, 1 g
Polvere para preparar solución para inyección/infusión.
Fibrogeno humano
Es importante leer atentamente el contenido de la hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para una persona. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los posibles efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Riastap y para qué se utiliza
- 2. Información importante antes de usar Riastap
- 3. Cómo usar Riastap
- 4. Posibles efectos adversos
- 5. Cómo conservar Riastap
- 6. Contenido del envase y otra información
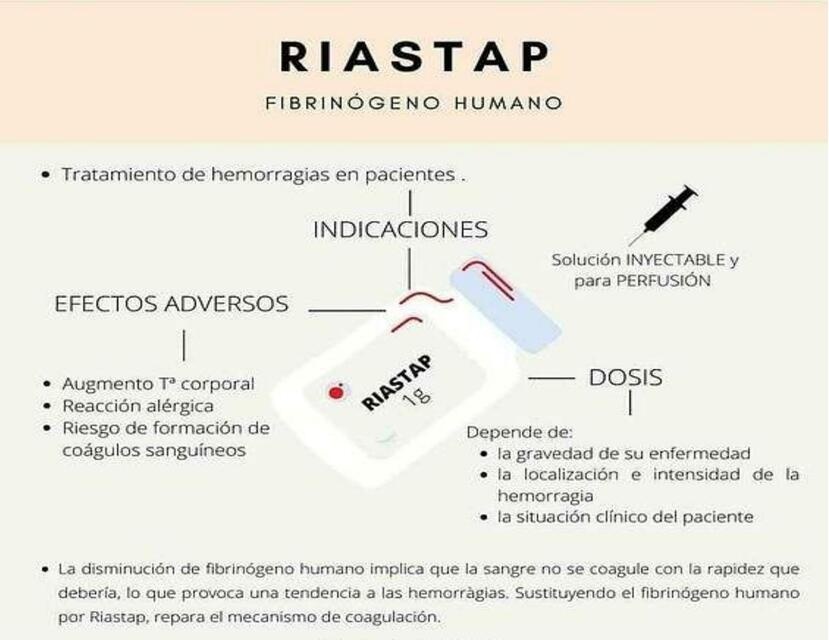
1. Qué es Riastap y para qué se utiliza
Qué es Riastap?
Riastap contiene fibrogeno humano, que es una proteína importante para la coagulación de la sangre
(coagulación). La falta de fibrogeno significa que la sangre no coagula tan rápido como debería, lo que
causa un mayor riesgo de sangrado. El reemplazo del fibrogeno humano con el medicamento Riastap
ayuda a reparar los mecanismos de coagulación.
Para qué se utiliza Riastap?
Riastap se utiliza para tratar el sangrado en pacientes con deficiencia congénita de fibrogeno
(hipofibrinogenemia o afibrinogenemia) con tendencia a sangrar.
2. Información importante antes de usar Riastap
La información proporcionada en esta sección debe ser considerada por el médico antes de administrar
el medicamento Riastap.
Cuándo no usar el medicamento Riastap:
- si el paciente es alérgico al fibrogeno humano o a alguno de los otros componentes de este medicamento (enumerados en el punto 6).
En caso de alergia a algún medicamento o alimento, debe informar a su médico.
Precauciones y advertencias:
- si ha habido reacciones alérgicas previas a Riastap. En ese caso, debe tomar medicamentos antihistamínicos y corticosteroides de forma profiláctica, si así lo indica el médico.
- cuando se produzcan reacciones alérgicas o reacciones anafilácticas (una reacción alérgica grave que causa dificultades respiratorias graves o mareos). La administración
de Riastap debe interrumpirse de inmediato (por ejemplo, deteniendo la inyección).
- debido al mayor riesgo de formación de coágulos sanguíneos en un vaso sanguíneo (trombosis), en particular:
- en caso de administración de una dosis alta o de dosis repetidas
- cuando haya enfermedad cardíaca (enfermedad coronaria o infarto de miocardio en la historia)
- en caso de enfermedad hepática
- inmediatamente después de una cirugía (pacientes postoperatorios)
- justo antes de una cirugía (pacientes preoperatorios)
- en recién nacidos (recién nacidos)
- si hay una mayor tendencia a la formación de coágulos sanguíneos de lo normal (pacientes con riesgo de trastornos trombóticos o trombosis intravascular diseminada)
El médico considerará la relación entre los beneficios de la terapia con Riastap y el riesgo asociado
con estas complicaciones.
Seguridad viral
En el caso de productos medicinales obtenidos a partir de sangre o plasma humano,
se toman medidas para prevenir infecciones transmitidas a los pacientes.
Estas incluyen:
- una selección cuidadosa de los donantes de sangre y plasma para excluir a las personas infectadas y
- análisis de las donaciones y lotes de plasma para detectar la presencia de virus / infecciones.
Los fabricantes de estos productos también incorporan etapas en el proceso de tratamiento de la sangre o el plasma que pueden inactivar o eliminar los virus. A pesar de esto, no se puede excluir completamente la posibilidad de transmisión de agentes infecciosos durante la administración de productos medicinales obtenidos a partir de sangre o plasma humano. Esto incluye virus desconocidos y recién descubiertos, así como otros tipos de infecciones.
Se considera que estos procedimientos son efectivos contra los virus con envoltura, como el virus de la inmunodeficiencia humana (VIH, el virus que causa el SIDA), el virus de la hepatitis B y C
(inflamación del hígado) y contra los virus sin envoltura de la hepatitis A
(inflamación del hígado) y el parvovirus B19.
El médico puede recomendar considerar la vacunación contra la hepatitis A y B en caso de administración regular / repetida de productos obtenidos a partir de plasma humano.
Se recomienda que el médico registre la fecha de administración del medicamento, el número de lote y el volumen inyectado.
Riastap y otros medicamentos
- Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
- No se debe mezclar el medicamento Riastap con otros productos medicinales, con excepciones descritas en la sección “Información destinada exclusivamente al personal médico /Reconstitución”.
Embarazo y lactancia
- Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
- Durante el embarazo o la lactancia, el medicamento Riastap solo debe administrarse si es estrictamente necesario.
Conducción de vehículos y uso de máquinas
Riastap no tiene un efecto significativo o tiene un efecto insignificante en la capacidad de conducir vehículos o usar máquinas.
Información importante sobre algunos componentes de Riastap
Riastap contiene hasta 164 mg (7,1 mmol) de sodio por vial. Esto equivale a 11,5 mg (0,5 mmol) de sodio
por kg de peso corporal del paciente, si se administra la dosis inicial recomendada de 70 mg/kg de peso corporal. Debe tenerse en cuenta al administrar a pacientes con dieta controlada de sodio.
3. Cómo usar Riastap
La terapia debe iniciarse y supervisarse por un médico experimentado en el tratamiento de este
tipo de enfermedad.
Dosificación
La cantidad de fibrogeno humano necesaria y la duración del tratamiento dependen de:
- la gravedad de la enfermedad
- la ubicación y la intensidad del sangrado
- el estado clínico del paciente. La administración de una dosis mayor que la recomendada de RiastapEl médico debe supervisar regularmente el estado de coagulación de la sangre durante el tratamiento. En caso de sobredosis, el riesgo de complicaciones trombóticas aumenta.
Método de administración
En caso de preguntas sobre el uso de este producto, debe consultar a su médico o farmacéutico (véase la sección “ Información destinada exclusivamente al personal médico”).
4. Posibles efectos adversos
Como cualquier medicamento, Riastap puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Debe comunicarse de inmediato con su médico:
- en caso de experimentar algún efecto adverso
- en caso de experimentar efectos adversos no mencionados en esta hoja de instrucciones.
Las siguientes reacciones adversas se han observado muy frecuentemente(pueden ocurrir en más de 1
de cada 10 personas):
- Aumento de la temperatura corporal
Las siguientes reacciones adversas se han observado con poca frecuencia(en menos de 1 de cada 100 personas):
- Reacción alérgica aguda (como enrojecimiento de la piel, erupción cutánea en toda la superficie del cuerpo, caída de la presión arterial, dificultades para respirar).
Las siguientes reacciones adversas se han observado frecuentemente(en menos de 1 de cada 10 personas, aunque estos incidentes ocurren con más frecuencia en pacientes que no reciben fibrogeno):
- Riesgo aumentado de formación de coágulos sanguíneos (véase la sección 2. ”Precauciones y advertencias”).
Notificación de efectos adversos
Si se producen algún efecto adverso, incluidos todos los posibles efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Productos Medicinales de la Agencia de Registro de Productos Medicinales, Dispositivos Médicos y Productos Biocidas
Al. Jerozolimskie 181C
02-222 Varsovia
tel.: +48 22 49 21 301
fax.: +48 22 49 21 309
Sitio web: ://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Gracias a la notificación de efectos adversos, se pueden recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Riastap
- El medicamento debe conservarse en un lugar inaccesible y fuera del alcance de los niños.
- No debe usar el medicamento Riastap después de la fecha de caducidad indicada en el etiquetado y el cartón.
- No debe conservar a una temperatura superior a 25°C. No congelar.
- Para proteger del sol, la ampolla debe conservarse en el envase exterior.
- La solución reconstituida debe usarse de inmediato.
- Si la solución preparada no se administra de inmediato, el período de conservación no debe exceder las 8 horas a temperatura ambiente (máx. 25 ºC).
- No debe conservar la solución reconstituida en el refrigerador.
6. Contenido del envase y otra información
Qué contiene Riastap El principio activo es:
Fibrogeno humano (1 g/ampolla; después de la reconstitución en 50 ml de agua para inyección, aproximadamente
20 mg/ml).
Para obtener información más detallada, véase la sección “ Información destinada exclusivamente al personal médico”.
Los demás componentes son:
Albumina humana, cloruro de sodio, clorhidrato de L-arginina, citrato de sodio, hidróxido de sodio
(para ajustar el pH),
Véase el último capítulo de la sección 2. „ Información importante sobre algunos componentes de Riastap”.
Cómo se presenta Riastap y qué contiene el envase
Riastap es un polvo blanco.
Después de la reconstitución en agua para inyección, la solución debe ser transparente o ligeramente opalescente, es decir, puede tener un brillo cuando se observa a la luz pero no debe contener partículas visibles.
Envases
Envase que contiene 1 g (Fig. 1)
Una ampolla de 1 g de fibrogeno humano
Filtro: filtro de jeringa Pall
Dispositivo de administración: dispositivo de administración Mini-Spike

Fig.1
Titular de la autorización de comercialización y fabricante:
CSL Behring GmbH
Emil-von-Behring-Str. 76
35041 Marburgo
Alemania
Este medicamento está autorizado en los Estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Riastap 1g, polvo para solución para inyección/infusión
Reino Unido
Riastap 1g, polvo para solución inyectable/perfusión
Francia
Riastap 1g, polvo para solución para inyección o infusión
Eslovenia
Riastap 1g
Alemania, Irlanda
Riastap
Bélgica, Chipre, Dinamarca, Finlandia, Grecia, Islandia, Italia, Luxemburgo,
Malta, Noruega, Polonia, Eslovaquia, España, Suecia
Fecha de aprobación de la hoja de instrucciones: Septiembre 2024
Información destinada exclusivamente al personal médico Dosificación:
El nivel de fibrogeno (funcional) debe determinarse para calcular la dosificación individual y la cantidad y frecuencia de las dosis administradas a cada paciente
a través de mediciones regulares del nivel de fibrogeno en suero y monitoreo continuo del estado clínico del paciente, teniendo en cuenta otras terapias sustitutivas utilizadas.
El nivel normal de fibrogeno en suero es de 1,5 – 4,5 g/l. El nivel crítico de fibrogeno en suero, por debajo del cual puede ocurrir sangrado, es de aproximadamente 0,5 - 1
g/l. En caso de cirugías importantes, es necesario un monitoreo cuidadoso de la terapia sustitutiva con pruebas de coagulación.
Dosis inicial
Si el nivel de fibrogeno del paciente no es conocido, la dosis recomendada es de 70 mg por kg de peso corporal administrados por vía intravenosa.
Dosis siguiente
El nivel objetivo (1 g/l) en caso de sangrados leves (por ejemplo, sangrado nasal,
sangrado muscular o menstrual) debe mantenerse durante al menos
tres días. El nivel objetivo (1,5 g/l) en caso de sangrados importantes (por ejemplo, lesión en la cabeza o sangrado intracraneal) debe mantenerse durante siete días.
Dosis de fibrogeno =
[Nivel objetivo (g/l) – nivel medido (g/l)]
(mg/kg de peso corporal)
0,017 (g/l por mg/kg de peso corporal)
Dosificación en recién nacidos, lactantes y niños
Hay datos limitados de estudios clínicos sobre la dosificación de Riastap en niños.
Las recomendaciones para la dosificación en niños son las mismas que para adultos, basadas en estos estudios y en la experiencia clínica a largo plazo con preparados de fibrogeno.
Método de administración
Información general
- El proceso de reconstitución y la extracción del producto deben realizarse en condiciones asépticas.
- Los productos reconstituidos deben evaluarse visualmente antes de la administración para excluir la presencia de partículas y decoloración.
- La solución debe ser casi incolora a amarillenta, transparente a ligeramente opalescente con un pH neutro. No se deben usar soluciones que estén turbias o contengan sedimentos.
Reconstitución
- Calentar tanto el diluyente como el polvo a temperatura ambiente o temperatura corporal (no superior a 37 ), sin abrir las ampollas.
- El preparado Riastap debe reconstituirse con agua para inyección (50 ml, no incluida).
- Antes de reconstituir el producto, debe lavarse las manos o ponerse guantes.
- Retirar la tapa de la ampolla que contiene Riastap, para exponer la parte central de los tapones de inyección.
- Limpie la superficie del tapón de inyección con una solución antiséptica y déjela secar.
- Introduzca el diluyente en la ampolla utilizando el equipo adecuado. Asegúrese de que el polvo esté completamente humedecido.
- Después de mezclar suavemente el contenido de la ampolla con un movimiento rotatorio hasta la reconstitución del polvo, la solución está lista para la administración. Evite agitar con fuerza, lo que puede causar la formación de espuma. Por lo general, se considera que el polvo se disuelve en aproximadamente 5 minutos. La disolución completa no debe tardar más de 15 minutos.
- Abrir el blister de plástico que contiene el dispositivo de administración (Mini-Spike ) suministrado con el producto Riastap (Fig. 2).

Fig. 2
- Debe introducir el dispositivo de administración suministrado en el tapón de la ampolla después de la reconstitución (Fig. 3)

Fig. 3
- Después de introducir el dispositivo de administración, retire la tapa. Después de retirar la tapa, no debe tocar la superficie expuesta.
- Debe abrir el blister con el filtro (filtro de jeringa Pall ) suministrado con el producto Riastap (Fig.4)

Fig. 4
Enrosque la jeringa en el filtro (Fig.5)
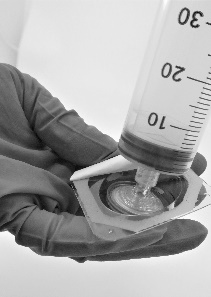
Fig. 5
- Enrosque la jeringa con el filtro en la punta de administración (Fig. 6)

Fig. 6
- Extraiga el producto reconstituido en la jeringa (Fig.7)
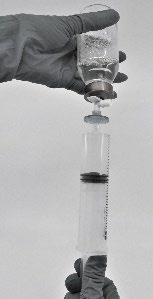
Fig.7
- Después de terminar, debe desconectar el filtro, el dispositivo de administración y la ampolla vacía de la jeringa y desechar según las normas vigentes, y luego comenzar a administrar el medicamento según las recomendaciones. La solución reconstituida debe administrarse de inmediato utilizando un conjunto de inyección / infusión separado.
- Debe tener cuidado para no causar aspiración de sangre en las jeringas llenas de producto.
Cualquier residuo no utilizado del producto o sus desechos debe eliminarse según las regulaciones locales.
Método de administración
Para la administración intravenosa de la solución reconstituida a temperatura ambiente, se recomienda usar un conjunto de infusión estándar. La solución reconstituida debe inyectarse o administrarse en infusión lentamente, con una velocidad adecuada para el confort del paciente.
La velocidad de inyección o infusión no debe exceder los 5 ml por minuto.
- País de registro
- Principio activo
- Requiere recetaNo
- Fabricante
- ImportadorCSL Behring GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a RiastapForma farmacéutica: Polvo, 1 gPrincipio activo: fibrinógeno humanoNo requiere recetaForma farmacéutica: Polvo, 1000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 2000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere receta
Alternativas a Riastap en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Riastap en Ucrania
Alternativa a Riastap en España
Médicos online para Riastap
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Riastap – sujeta a valoración médica y normativa local.














