
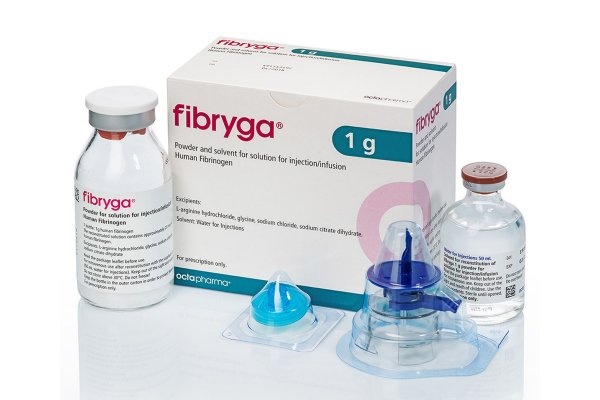
Fibriga

Consulta con un médico sobre la receta médica de Fibriga

Cómo usar Fibriga
Hoja de instrucciones del paquete: información para el usuario
Fibryga, 1 g
Polvo y disolvente para la preparación de una solución para inyección/infusión
Fibrogeno humano
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda adicional, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Fibryga y para qué se utiliza
- 2. Información importante antes de usar Fibryga
- 3. Cómo usar Fibryga
- 4. Posibles efectos adversos
- 5. Cómo conservar Fibryga
- 6. Contenido del paquete y otra información
1. Qué es Fibryga y para qué se utiliza
Qué es Fibryga
Fibryga contiene fibrogeno humano, que es una proteína importante en el proceso de coagulación de la sangre. La falta de fibrogeno significa que la sangre no coagula tan bien como debería, lo que causa una mayor tendencia a sangrar. Reemplazar el fibrogeno faltante con Fibryga corregirá este defecto en el proceso de coagulación.
Para qué se utiliza Fibryga
Fibryga se utiliza para:
- tratar episodios de sangrado y prevenir sangrado durante procedimientos quirúrgicos en pacientes con deficiencia congénita de fibrogeno (hipofibrinogenemia o afibrinogenemia) con tendencia a sangrar.
- suplementar fibrogeno en pacientes con sangrado incontrolado y grave que se asocia con deficiencia adquirida de fibrogeno durante procedimientos quirúrgicos.
2. Información importante antes de usar Fibryga
Cuándo no usar Fibryga:
- si el paciente es alérgico al fibrogeno humano o a cualquier otro componente de este medicamento (enumerados en el punto 6).
- si el paciente ha experimentado una reacción alérgica a Fibryga en el pasado.
Debe informar a su médico si el paciente es alérgico a cualquier medicamento.
Precauciones y advertencias
Antes de comenzar a usar Fibryga, debe discutirlo con su médico o farmacéutico.
Riesgo de coágulos sanguíneos en los vasos sanguíneos
El médico debe evaluar los beneficios de usar este medicamento en relación con el riesgo de formación de coágulos en los vasos sanguíneos, especialmente si:
- el paciente ha recibido una dosis grande o múltiples dosis de este medicamento,
- el paciente ha tenido un ataque al corazón (enfermedad coronaria o infarto de miocardio) en el pasado,
- el paciente tiene enfermedad hepática,
- el paciente es recién operado (paciente postoperatorio),
- el paciente está a punto de someterse a una operación (paciente preoperatorio),
- en recién nacidos,
- si el paciente tiene un alto riesgo de formación de coágulos o trastornos de la coagulación en los vasos sanguíneos (pacientes con riesgo de eventos tromboembólicos o coagulación intravascular diseminada). El médico puede ordenar pruebas adicionales de coagulación para monitorear el riesgo.
Reacciones alérgicas y anafilácticas
Cualquier medicamento, como Fibryga, que se produce a partir de sangre humana (que contiene proteínas) y que se administra por vía intravenosa puede causar reacciones alérgicas. Si el paciente ha experimentado reacciones alérgicas a Fibryga en el pasado, el médico decidirá si es necesario administrar un medicamento antialérgico.
El médico explicará al paciente qué síntomas de alerta de una reacción alérgica o anafiláctica.
Debe prestar atención a los síntomas tempranos de una reacción alérgica (hipersensibilidad), como:
- urticaria,
- erupción cutánea,
- sensación de opresión en el pecho,
- respiración sibilante,
- presión arterial baja,
- o reacción anafiláctica (si alguno o todos los síntomas anteriores ocurren repentinamente y con gran intensidad). Si ocurren estos síntomas, la inyección/infusión de Fibryga debe interrumpirse de inmediato.
Seguridad virológica
Cuando los medicamentos se producen a partir de sangre humana o plasma, se toman ciertas precauciones para evitar la transmisión de infecciones a los pacientes. Estas incluyen:
- selección cuidadosa de los donantes de sangre y plasma para garantizar la exclusión de donantes que puedan ser portadores de infecciones,
- pruebas de cada donación y lote de plasma recolectado para detectar la presencia de virus/infecciones,
- incorporación de etapas en el proceso de tratamiento de la sangre o el plasma para inactivar o eliminar los virus. A pesar de estas precauciones, no se puede excluir completamente la posibilidad de transmisión de una infección en el caso de medicamentos preparados a partir de sangre humana o plasma. Esto también se aplica a los virus desconocidos o que han aparecido recientemente. Las medidas tomadas se consideran efectivas contra los virus con envoltura, como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC), así como contra el virus de la hepatitis A (VHA) sin envoltura. Las medidas de precaución pueden tener una eficacia limitada contra los virus sin envoltura, como el parvovirus B19. La infección por parvovirus B19 puede ser grave en el caso de mujeres embarazadas (infección del feto no nacido) y personas con deficiencia de la función inmunitaria o con ciertos tipos de anemia (por ejemplo, anemia falciforme o hemólisis patológica de los glóbulos rojos). Se recomienda encarecidamente que, en cada caso de administración de Fibryga a un paciente, se registre el nombre y el número de lote del producto para poder vincular al paciente con el lote del producto administrado. Si el paciente recibe regularmente/múltiples veces productos que contienen fibrogeno de plasma humano, el médico puede recomendar al paciente que considere la vacunación contra la hepatitis A y B.
Niños y adolescentes
No hay advertencias ni precauciones específicas para niños y adolescentes.
Fibryga y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que el paciente esté tomando actualmente o recientemente, así como sobre los medicamentos que el paciente planea tomar.
Fibryga no debe mezclarse con ningún otro medicamento, excepto los enumerados en el punto "Información destinada exclusivamente al personal médico especializado / Reconstitución".
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, o si sospecha que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento. Este medicamento debe usarse durante el embarazo o la lactancia solo después de consultar a un médico o farmacéutico.
Conducción de vehículos y uso de máquinas
Fibryga no afecta la capacidad de conducir vehículos o usar máquinas.
Fibryga contiene sodio
Este medicamento contiene sodio (principal componente de la sal común) en una cantidad de hasta 132 mg por frasco.
Esto equivale al 6,6% del consumo máximo diario recomendado de sodio para adultos. Debe tenerse en cuenta si el paciente sigue una dieta baja en sodio.
3. Cómo usar Fibryga
Este medicamento debe usarse siempre según las indicaciones de su médico. En caso de duda, debe consultar a su médico.
Fibryga se administra por vía intravenosa (goteo) por personal médico.
La dosis y el esquema de dosificación dependen de:
- el peso del paciente,
- la gravedad de la enfermedad,
- la localización del sangrado,
- la naturaleza del procedimiento quirúrgico,
- el estado general de salud.
Uso en niños y adolescentes
La forma de administrar Fibryga a niños y adolescentes (por vía intravenosa) no difiere de la administración a adultos.
Uso de una dosis mayor que la recomendada de Fibryga
El médico realizará pruebas de sangre regularmente para determinar la concentración de fibrogeno y reducir el riesgo de sobredosis.
En caso de sobredosis, aumenta el riesgo de formación de coágulos patológicos en los vasos sanguíneos.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
Forma de administración
Este medicamento debe administrarse por inyección o infusión (goteo) en una vena después de la reconstitución con el disolvente adjunto. En caso de dudas adicionales sobre el uso del medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Debe comunicarse con su médico de inmediato:
- si ocurre algún efecto adverso,
- si ocurre algún efecto adverso no mencionado en esta hoja de instrucciones.A continuación, se presentan los efectos adversos que se han notificado con Fibryga y otros productos que contienen fibrogeno (la frecuencia de los efectos adversos enumerados a continuación es desconocida):
- reacciones alérgicas o anafilácticas: reacciones cutáneas, como erupción cutánea o enrojecimiento de la piel (véase el punto 2 "Precauciones y advertencias").
- relacionados con el sistema circulatorio: inflamación de las venas y formación de coágulos sanguíneos (véase el punto 2 "Precauciones y advertencias").
- aumento de la temperatura corporal (fiebre).
Si el paciente experimenta alguno de los síntomas anteriores, debe comunicarse con su médico.
Notificación de efectos adversos
Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 24 99
Fax: +34 91 596 24 90
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Fibryga
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe usarse después de la fecha de caducidad indicada en el etiquetado y en el paquete.
La fecha de caducidad es el último día del mes indicado.
No debe conservarse a una temperatura superior a 25 °C. No debe congelarse. El frasco debe conservarse en el paquete exterior para protegerlo de la luz.
El polvo debe reconstituirse solo justo antes de la inyección/infusión. Se ha demostrado la estabilidad química y física de la solución reconstituida durante 24 horas a temperatura ambiente (hasta 25 °C). Sin embargo, la solución debe usarse de inmediato y solo una vez para evitar la contaminación. La solución preparada no debe conservarse en el refrigerador ni congelarse.
Los medicamentos no deben eliminarse por el desagüe ni depositarse en los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se necesitan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Fibryga
- El principio activo es fibrogeno humano.
Fibryga contiene 1 g de fibrogeno humano en el frasco o 20 mg de fibrogeno humano por ml después de la reconstitución con el disolvente adjunto (50 ml de agua para inyección).
- Los demás componentes son cloruro de L-arginina, glicina, cloruro de sodio y citrato de sodio dihidratado. Disolvente: agua para inyección
Cómo se presenta Fibryga y qué contiene el paquete
Fibryga se presenta como polvo y disolvente para la preparación de una solución para inyección/infusión y está disponible en frascos de vidrio.
Polvere blanca o ligeramente amarillenta, higroscópica, o masa cristalina quebradiza.
El disolvente es un líquido incoloro y transparente.
La solución preparada debe ser casi incolora y ligeramente opalescente.
Fibryga se comercializa en un paquete de cartón que contiene:
- 1 frasco con polvo para la preparación de una solución para inyección/infusión,
- 1 ampolla con 50 ml de disolvente (agua para inyección),
- 1 dispositivo de reconstitución nextaro.
Título del titular de la autorización de comercialización
Octapharma (IP) SPRL
Allée de la Recherche 65
1070 Anderlecht
Bélgica
Fabricante
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Strasse 235, 1100 Viena, Austria
Octapharma AB
Lars Forssells gata 23, 112 75 Estocolmo, Suecia
Octapharma GmbH
Elisabeth-Selbert-Strasse 11
40764 Langenfeld, Alemania
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) bajo los siguientes nombres:
Fibryga: Austria, Bélgica, Bulgaria, Croacia, Chipre, República Checa, Dinamarca, Estonia, Finlandia, Francia, Alemania, Grecia, Hungría, Irlanda, Islandia, Italia, Letonia, Liechtenstein, Lituania, Luxemburgo, Malta, Países Bajos, Noruega, Polonia, Portugal, Reino Unido, República Eslovaca, Eslovenia, España, Suecia
Fecha de la última revisión de la hoja de instrucciones: 2023-12-22
Información destinada exclusivamente al personal médico especializado: Dosis
La dosis y la duración del tratamiento de reemplazo dependen del grado de gravedad del trastorno, la localización y la intensidad del sangrado, así como del estado clínico del paciente.
Debe determinarse la concentración (funcional) de fibrogeno para calcular la dosis individual y la cantidad y frecuencia de las dosis administradas a cada paciente mediante mediciones regulares de la concentración de fibrogeno en suero y un seguimiento continuo del estado clínico del paciente y de otras terapias de reemplazo.
En el caso de procedimientos quirúrgicos graves, es necesario un seguimiento cuidadoso de la terapia de reemplazo mediante la determinación de parámetros de coagulación.
- 1. Profilaxis en pacientes con deficiencia congénita de fibrogeno o afibrinogenemia y tendencia conocida a sangrar Para prevenir un sangrado excesivo durante los procedimientos quirúrgicos, se recomienda la administración profiláctica para aumentar la concentración de fibrogeno a 1 g/l y mantenerla a ese nivel hasta que se logre la hemostasia y por encima de 0,5 g/l hasta que se complete la curación de la herida. En el caso de un procedimiento quirúrgico o tratamiento de un episodio de sangrado, la dosis debe calcularse de la siguiente manera:
Dosis (mg/kg de peso corporal) = [Concentración objetivo (g/l) - concentración determinada (g/l)]
0,018 (g/l por mg/kg de peso corporal)
La dosificación adicional (dosis y frecuencia de inyección) debe adaptarse al estado clínico del paciente y a los resultados de las pruebas de laboratorio.
El período de semivida biológica del fibrogeno es de 3-4 días. En consecuencia, sin consumo, generalmente no se requiere un nuevo tratamiento con fibrogeno humano. Teniendo en cuenta la acumulación que ocurre en el caso de administraciones repetidas con fines profilácticos, la dosis y la frecuencia deben determinarse según los objetivos terapéuticos establecidos por el médico para el paciente individual.
Niños y adolescentes
En el caso de un procedimiento quirúrgico o tratamiento de un episodio de sangrado, la dosis para adolescentes debe calcularse según la fórmula anterior para adultos, mientras que la dosis para niños menores de 12 años debe calcularse de la siguiente manera:
Dosis (mg/kg de peso corporal) = [Concentración objetivo (g/l) - concentración determinada (g/l)]
0,014 (g/l por mg/kg de peso corporal)
La dosificación adicional debe adaptarse al estado clínico del paciente y a los resultados de las pruebas de laboratorio.
Personas de edad avanzada
Los estudios clínicos de Fibryga no incluyeron a pacientes de 65 años o más para presentar pruebas concluyentes de que hubiera diferencias en la respuesta al tratamiento en comparación con pacientes más jóvenes.
- 2. Tratamiento de sangrado
Sangrado en pacientes con deficiencia congénita de fibrogeno o afibrinogenemia
El tratamiento de los episodios de sangrado debe realizarse según las fórmulas anteriores para adultos/adolescentes y niños para lograr la concentración objetivo de fibrogeno en suero de 1 g/l y mantenerla hasta que se logre la hemostasia.
Sangrado en pacientes con deficiencia adquirida de fibrogeno Adultos
Por lo general, se administra inicialmente 1-2 g, y se administran infusiones adicionales según sea necesario. En el caso de un sangrado grave, por ejemplo, durante un procedimiento quirúrgico importante, puede ser necesaria una cantidad mayor de fibrogeno (4-8 g).
Niños y adolescentes
La dosis debe determinarse según el peso corporal y las indicaciones clínicas, pero generalmente es de 20-30 mg/kg.
Instrucciones para la preparación y administración Instrucciones generales
- La solución preparada debe ser casi incolora y ligeramente opalescente. No debe usarse si la solución es turbia o contiene precipitados.
- El producto Fibryga está destinado a un solo uso. No debe volver a usarse ningún componente.
- Para garantizar la seguridad microbiológica, la solución debe administrarse de inmediato después de la reconstitución. Se ha demostrado la estabilidad química y física de la solución preparada durante 24 horas a temperatura ambiente (hasta 25 °C). No debe conservarse en el refrigerador ni congelarse el producto Fibryga después de la reconstitución.
Reconstitución
- 1. Asegurarse de que el frasco con polvo (Fibryga) y la ampolla con disolvente tengan temperatura ambiente. Debe mantenerse esta temperatura durante todo el proceso de reconstitución. Si se utiliza un baño de agua para calentar, debe tener cuidado de no permitir que el agua entre en contacto con los tapones de goma o las tapas de los contenedores. La temperatura del baño de agua no debe exceder los 37 °C.
- 2. Retirar las tapas de los frascos con polvo (Fibryga) y la ampolla con disolvente para exponer la parte central del tapón de inyección. Limpiar los tapones de goma con un hisopo de algodón empapado en alcohol y dejar que se sequen.
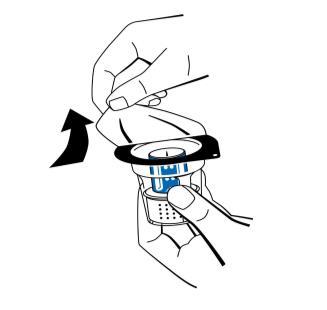
- 3. Abrir el paquete del dispositivo de reconstitución (nextaro) retirando la tapa (fig. 1). Para mantener la esterilidad, dejar el dispositivo de reconstitución en el paquete de plástico transparente. No tocar la aguja.
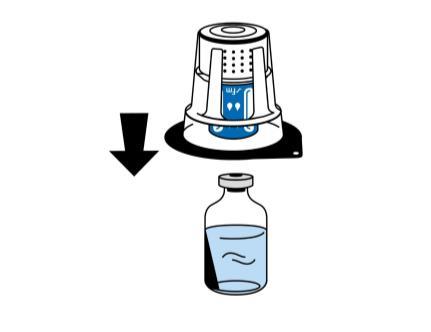
- 4. Colocar la ampolla con disolvente en una superficie plana y limpia, y sujetarla firmemente. Con el dispositivo de reconstitución todavía en el paquete de plástico transparente, colocar la parte azul del dispositivo de reconstitución sobre la ampolla con disolvente. Empujar hacia abajo con firmeza hasta que se bloquee (fig. 2). No girar durante la conexión.
Precaución:
El dispositivo de reconstitución debe conectarse primero a la ampolla con disolvente y luego al frasco con polvo. De lo contrario, se perderá la presión negativa y no se transferirá el disolvente.
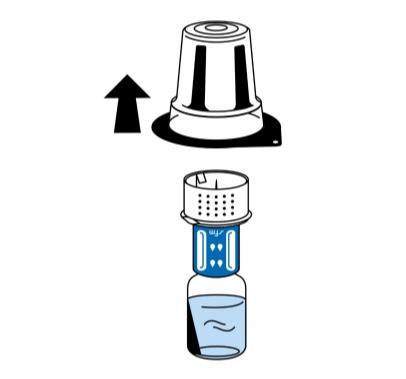
- 5. Sujetando la ampolla con disolvente, retirar cuidadosamente el paquete de plástico transparente del dispositivo de reconstitución (nextaro) tirando hacia arriba. Asegurarse de que el dispositivo de reconstitución esté firmemente conectado a la ampolla con disolvente (fig. 3).
- 6. Colocar el frasco con polvo (Fibryga) en una superficie plana y limpia, y sujetarlo firmemente. Tomar la ampolla con disolvente con el dispositivo de reconstitución conectado y girarla hacia abajo. Colocar la parte blanca del conector del dispositivo de reconstitución sobre el frasco con polvo (Fibryga) y empujar hacia abajo con firmeza hasta que se bloquee (fig. 4). No girar durante la conexión. El disolvente se transferirá automáticamente al frasco con polvo (Fibryga).
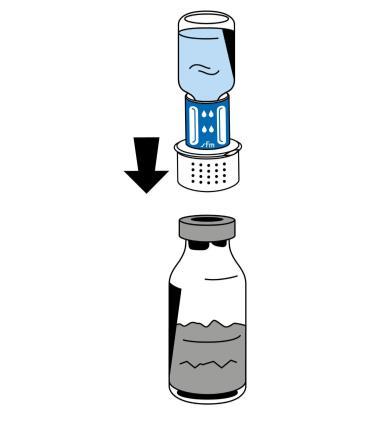
- 7. Con la ampolla con disolvente todavía conectada, girar suavemente el frasco con el producto Fibryga hasta que el polvo se disuelva completamente. Para evitar la formación de espuma, no debe agitarse el frasco. El polvo debe disolverse completamente en unos 5 minutos.
La disolución del polvo no debe tardar más de 20 minutos. Si el polvo no se disuelve en 20 minutos, el producto debe desecharse.
- 8. En el caso poco frecuente de que se observe flotación de producto no reconstituido durante el trasvase del agua para inyección, o si el tiempo de reconstitución se prolonga inesperadamente, el proceso de disolución puede acelerarse mediante un movimiento de mezcla más enérgico de la ampolla en sentido horizontal.
- 9. Después de completar la reconstitución, girar el dispositivo de reconstitución (parte azul) en sentido contrario a las agujas del reloj para separarlo en dos partes (fig. 5). No tocar el conector luer lock en la parte blanca del dispositivo de reconstitución.
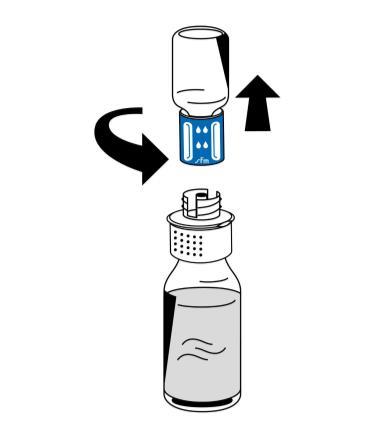
- 10. Desechar la ampolla vacía con disolvente junto con la parte azul del dispositivo de reconstitución.
Administración
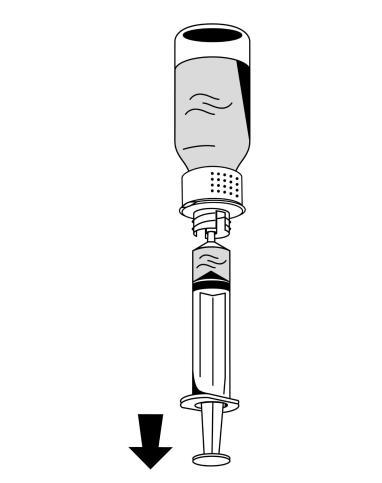
- 1. Conectar cuidadosamente una jeringa al conector luer lock en la parte blanca del dispositivo de reconstitución (fig. 6).
- 2. Girar el frasco Fibryga hacia abajo y aspirar la solución en la jeringa (fig. 7).
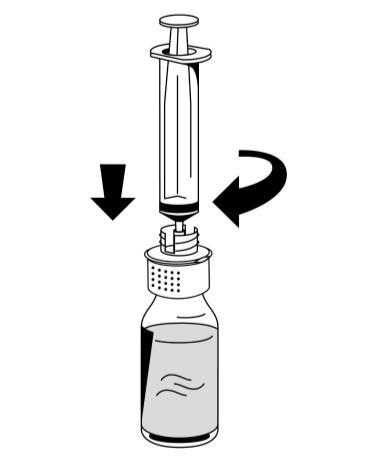
- 3. Sujetando firmemente el émbolo de la jeringa (con el émbolo de la jeringa orientado hacia abajo), retirar la jeringa del dispositivo de reconstitución (fig. 8).

- 4. Desechar la parte blanca del dispositivo de reconstitución junto con el frasco vacío de Fibryga.
Se recomienda administrar la solución preparada por vía intravenosa a temperatura ambiente utilizando un conjunto estándar para infusión.
Todos los residuos del producto o desechos deben eliminarse de acuerdo con las regulaciones locales.
Forma de administración
Infusión o inyección intravenosa.
El producto Fibryga debe administrarse lentamente por vía intravenosa a una velocidad máxima recomendada de 5 ml por minuto en pacientes con hipo o afibrinogenemia congénita y a una velocidad máxima recomendada de 10 ml por minuto en pacientes con deficiencia adquirida de fibrogeno.
Incompatibilidades farmacéuticas
No mezclar el producto Fibryga con otros medicamentos.
- País de registro
- Principio activo
- Requiere recetaNo
- Fabricante
- ImportadorOctapharma AB Octapharma GmbH Octapharma Pharmazeutika Produktionsges.m.g.H.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a FibrigaForma farmacéutica: Polvo, 1 gPrincipio activo: fibrinógeno humanoFabricante: CSL Behring GmbHNo requiere recetaForma farmacéutica: Polvo, 1000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 2000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere receta
Alternativas a Fibriga en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Fibriga en Ucrania
Alternativa a Fibriga en España
Médicos online para Fibriga
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Fibriga – sujeta a valoración médica y normativa local.














