
Beriate 1000

Consulta con un médico sobre la receta médica de Beriate 1000

Cómo usar Beriate 1000
HOJA DE INSTRUCCIONES DEL PAQUETE: INFORMACIÓN PARA
USUARIOS
Beriate
Beriate 250, 250 UI. Polvo y disolvente para solución inyectable / para infusión. Beriate 500, 500 UI. Polvo y disolvente para solución inyectable / para infusión. Beriate 1000, 1000 UI. Polvo y disolvente para solución inyectable / para infusión. Beriate 2000, 2000 UI. Polvo y disolvente para solución inyectable / para infusión. Factor VIII humano
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Beriate y para qué se utiliza
- 2. Información importante antes de usar Beriate
- 3. Cómo usar Beriate
- 4. Posibles efectos adversos
- 5. Cómo conservar Beriate
- 6. Contenido del paquete y otra información
1. Qué es Beriate y para qué se utiliza
Qué es Beriate?
Beriate consiste en un polvo y un disolvente. La solución reconstituida se administra por vía intravenosa en forma de inyección o infusión. Beriate se produce a partir de plasma humano (la parte líquida de la sangre) y contiene factor VIII humano. Se utiliza para la profilaxis y el tratamiento de hemorragias causadas por la falta de factor VIII (hemofilia tipo A) en la sangre. También se puede utilizar para el tratamiento de la deficiencia adquirida de factor VIII.
2. Información importante antes de usar Beriate
Las siguientes secciones contienen información que debe considerar antes de usar Beriate.
Cuándo no usar Beriate
- Si el paciente es alérgico al principio activo (factor VIII humano) o a alguno de los componentes de este medicamento (enumerados en el punto 6).
Precauciones y advertencias
Identificabilidad
Se recomienda que, en cada administración de Beriate al paciente, se registre en el diario de tratamiento la fecha de administración del medicamento, el número de lote y el volumen inyectado.
Antes de iniciar el tratamiento con Beriate, debe discutirlo con su médico o farmacéutico.
- Es posible que ocurran reacciones de hipersensibilidad de tipo alérgico. Los pacientes deben ser informados por su médico sobre los síntomas tempranos de una reacción de hipersensibilidad,como urticaria, erupción cutánea generalizada, opresión en el pecho, respiración silbante, caída de la presión arterial y anafilaxia (una reacción alérgica grave que puede causar dificultades respiratorias graves o mareos). Si ocurren estos síntomas, los pacientes deben dejar de usar el producto y ponerse en contacto con su médico de inmediato.
- La formación de inhibidores(anticuerpos) es una complicación conocida que puede ocurrir durante el tratamiento con todos los medicamentos que contienen factor VIII. Estos inhibidores, especialmente a altas concentraciones, interrumpen el tratamiento efectivo y el paciente será monitoreado de cerca para detectar la formación de estos inhibidores. Si la hemorragia del paciente no se controla adecuadamente con Beriate, debe informar a su médico de inmediato.
- Si existe una enfermedad cardíaca preexistente o un riesgo de enfermedad cardíaca, debe informar a su médico o farmacéutico.
- Si se requiere un dispositivo de acceso venoso central (ang. central venous access device, CVAD) para administrar Beriate, el médico debe considerar el riesgo de complicaciones asociadas con el CVAD, incluyendo infecciones locales, bacteriemia y trombosis en el lugar de inserción del catéter.
El médico debe sopesar cuidadosamente los beneficios del tratamiento con Beriate en relación con el riesgo de estas complicaciones.
Seguridad en cuanto a la posibilidad de transmisión de virus
En el caso de los medicamentos producidos a partir de sangre o plasma humano, se toman medidas preventivas para evitar la transmisión de infecciones a los pacientes.
Estas medidas incluyen la selección cuidadosa de los donantes de sangre y plasma para excluir a los portadores de enfermedades infecciosas, así como la prueba de cada donación y pool de plasma para detectar virus / infecciones.
Los fabricantes de estos productos también incorporan procedimientos en el proceso de fabricación que inactivan o eliminan los virus u otros patógenos. A pesar de la implementación de estas medidas, no se puede excluir completamente la posibilidad de transmisión de agentes infecciosos al administrar medicamentos derivados de sangre o plasma humano. Esto incluye virus desconocidos o recientemente descubiertos y otros tipos de infecciones.
Las medidas de seguridad implementadas se consideran efectivas contra los virus envueltos, como el virus de la inmunodeficiencia humana (VIH, el virus que causa el SIDA), el virus de la hepatitis B y C (hepatitis), y contra los virus no envueltos, como el virus de la hepatitis A y el parvovirus B19.
En el caso de la administración regular o repetida de productos derivados de plasma humano (por ejemplo, factor VIII), el médico puede recomendar la vacunación contra la hepatitis A y B.
Beriate y otros medicamentos
- Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
- Beriate no debe mezclarse con otros productos médicos, diluyentes y disolventes, excepto los recomendados por el fabricante (véase el punto 6).
Embarazo, lactancia y fertilidad
- Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
- Beriate debe usarse durante el embarazo y la lactancia solo si es absolutamente necesario.
- No hay datos disponibles sobre el impacto en la fertilidad.
Conducción de vehículos y uso de máquinas
Beriate no afecta la capacidad de conducir vehículos o operar máquinas.
Beriate contiene sodio
Beriate 250 UI y 500 UI contiene menos de 1 mmol de sodio (23 mg) por vial, por lo que se considera esencialmente "libre de sodio".
Beriate 1000 UI y 2000 UI contiene 27,55 mg de sodio (principal componente de la sal común) por vial. Esto es equivalente al 1,4% de la ingesta diaria máxima recomendada de sodio para un adulto.
3. Cómo usar Beriate
Este medicamento debe usarse siempre según las indicaciones de su médico o farmacéutico. Si tiene alguna duda, debe consultar a su médico o farmacéutico.
El tratamiento de la hemofilia A debe iniciarse y realizarse bajo la supervisión de un médico con experiencia en el tratamiento de este tipo de trastornos.
Dosis recomendada
La cantidad de factor VIII necesaria y la duración del tratamiento dependen de varios factores, como el peso corporal, la gravedad de la enfermedad, el lugar y la intensidad de la hemorragia o la necesidad de prevenir una hemorragia durante una operación o examen.
Si se prescribe el uso de Beriate en el hogar, el médico debe informar al paciente sobre cómo inyectar el medicamento y cuánto usar.
Debe seguir las instrucciones recibidas de su médico o enfermera del centro de tratamiento de hemofilia.
Hemofilia.
Uso en niños y adolescentes
La dosis se determina según el peso corporal, utilizando el mismo principio que para los adultos.
Uso de una dosis mayor que la recomendada de Beriate
No se han observado síntomas de sobredosis de FVIII.
Omisión de una dosis de Beriate
La siguiente dosis debe administrarse de inmediato y continuar con el horario regular según las indicaciones del médico. No debe administrarse una dosis doble para compensar una dosis omitida.
Reconstitución y administración Recomendaciones generales:
- El polvo debe mezclarse (reconstituirse) con el disolvente (parte líquida) y extraerse de la ampolla en condiciones asépticas.
- La solución reconstituida debe ser transparente o ligeramente opalescente, es decir, puede brillar cuando se observa a la luz. A veces, pueden aparecer partículas individuales o grumos en la ampolla. El filtro que forma parte del dispositivo Mix2Vial elimina las partículas sólidas. La filtración no afecta el cálculo de la dosis. Antes de la administración, después de la filtración y la extracción del producto en la jeringa (véase a continuación), la solución debe inspeccionarse visualmente para excluir la presencia de partículas pequeñas y decoloración. No debe usarse la solución si está turbia o contiene sedimento o partículas en la jeringa.
- Después de transferir el producto a la jeringa, debe usarse de inmediato. No debe almacenarse el producto en la jeringa.
- Todos los restos del producto no utilizado o desechos deben eliminarse según las regulaciones locales y las recomendaciones del médico.
Reconstitución:
No abra las ampollas, calienta el polvo Beriate y el disolvente a temperatura ambiente o temperatura corporal. Puede hacerlo dejando las ampollas durante aproximadamente una hora a temperatura ambiente o sosteniéndolas en las manos durante unos minutos.
Nosometa las ampollas a calor directo. La ampolla no debe calentarse a una temperatura superior a la temperatura corporal (37°C).
Retire con cuidado las tapas de las ampollas que contienen el polvo y el disolvente, frote la superficie de los tapones de goma con un algodón empapado en alcohol y déjelos secar antes de abrir el paquete con Mix2Vial, y luego siga las instrucciones a continuación.
- 1. Abra el paquete Mix2Vial retirando la tapa. Noretire Mix2Vial del blister.
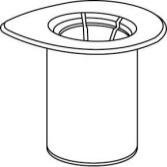
- 2. Coloque la ampolla del disolvente en una superficie plana y limpia y sujétela firmemente. No retire el conjunto Mix2Vial del blister. Presionando el extremo del conector azul hacia abajo, perfórese el tapón de la ampolla del disolvente.
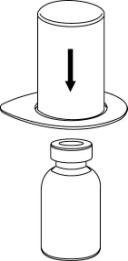
- 3. Retire con cuidado el blister del conjunto Mix2Vial sujetando el borde y tirando hacia arriba. Debe tener cuidado de retirar solo el blister y no todo el conjunto Mix2Vial.
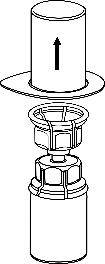
4. Coloque la ampolla del producto en una superficie plana y dura.
Invirtiendo la ampolla del disolvente con el conjunto Mix2Vial conectado, presione el extremo del conector transparente hacia abajo para perfurar el tapón de la ampolla del producto. El disolvente fluirá automáticamente hacia la ampolla del producto.
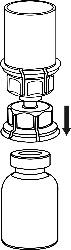
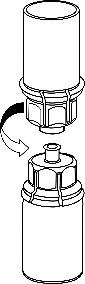
- 5. Sujete la ampolla del producto conectada al conjunto Mix2Vial con una mano y la ampolla del disolvente también conectada al conjunto Mix2Vial con la otra mano, y gire el conjunto en sentido contrario a las agujas del reloj para separarlo en dos partes. Retire la ampolla del disolvente con el conector azul del conjunto Mix2Vial.
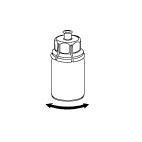
- 6. Asegúrese de que el producto se disuelva completamente, moviendo suavemente la ampolla del producto con el conector transparente en un movimiento rotativo. No agite.
7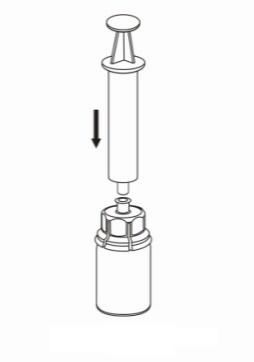 |
|
Extracción y administración:
- 8. Sosteniendo el émbolo de la jeringa hacia abajo, invierta todo el conjunto y llene la jeringa con la solución, retirando lentamente el émbolo de la jeringa.
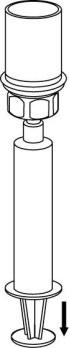
- 9. La solución ahora se encuentra en la jeringa. Sosteniendo firmemente el cilindro de la jeringa (con el émbolo de la jeringa hacia abajo), desconecte el conector transparente del conjunto Mix2Vial de la jeringa, girando en sentido contrario a las agujas del reloj.
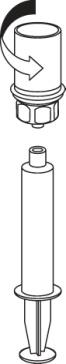
Introduzca la aguja en la vena utilizando el conjunto de punción venosa suministrado. Permita que la sangre fluya hacia el extremo de la cánula. Conecte la jeringa al extremo roscado del conjunto de punción venosa. Según las instrucciones del médico, debe inyectar lentamentela solución reconstituida por vía intravenosa. La velocidad de inyección o infusión no debe exceder 2 ml por minuto. Debe tener cuidado de que la sangre no entre en la jeringa que contiene el producto.
Si es necesario administrar un volumen mayor, también se puede hacer mediante infusión. Para ello, debe transferir el producto reconstituido a un conjunto de infusión aprobado para su uso. La infusión debe realizarse según las instrucciones del médico.
Debe prestar atención a la aparición de cualquier efecto adverso. Si este efecto adverso puede estar relacionado con la administración de Beriate, la inyección o la infusión debe interrumpirse (véase también el punto 2).
Si tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Si ocurre alguno de los siguientes síntomas, debe informar a su médico o servicios de emergencia o al departamento de tratamiento de hemofilia en el hospital más cercano:
- Síntomas de edema angioneurótico, como
- hinchazón de la cara, la lengua o la garganta
- dificultad para tragar
- erupción cutánea y dificultad para respirar. Estos efectos adversos se han observado muy raramente (pueden ocurrir en menos de 1 de cada 10,000 pacientes) y, en algunos casos, pueden conducir a reacciones alérgicas graves (anafilaxia), incluyendo shock.
- Falta de efectividad del tratamiento (hemorragias persistentes). En el caso de niños no tratados previamente con medicamentos que contienen factor VIII, los anticuerpos bloqueadores (véase el punto 2) pueden ocurrir muy frecuentemente (en más de 1 de cada 10 pacientes). Sin embargo, en pacientes que han sido tratados previamente con factor VIII (más de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 de cada 100 pacientes). Si esto ocurre, los medicamentos del paciente pueden dejar de funcionar adecuadamente y el paciente puede experimentar hemorragias persistentes. Si esto ocurre, debe informar a su médico de inmediato.
Otros efectos adversos:
- Reacciones alérgicas (hipersensibilidad), que pueden incluir:
- picazón y ardor en el lugar de la inyección o infusión
- escalofríos, fiebre, erupción cutánea generalizada, ampollas
- dolor de cabeza
- caída de la presión arterial, ansiedad, taquicardia, opresión en el pecho, respiración silbante
- sensación de fatiga (letargo)
- náuseas, vómitos
- entumecimiento. Estos efectos adversos se han observado muy raramente y, en algunos casos, pueden conducir a reacciones alérgicas graves (anafilaxia), incluyendo shock.
- Se ha observado muy raramente un aumento de la temperatura corporal.
Efectos adversos en niños y adolescentes
La frecuencia, tipo y gravedad de las reacciones adversas en niños son comparables a las de los adultos.
Notificación de efectos adversos
Si ocurren efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico o enfermera.
Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social
Calle de Alcalá, 56
28071 Madrid
Teléfono: 900 41 63 35
Fax: 913 53 33 32
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Beriate
No use este medicamento después de la fecha de caducidad que se indica en el etiquetado y el paquete después de "CAD" (EXP). La fecha de caducidad es el último día del mes indicado.
Número de lote es el número que se encuentra en el etiquetado y el paquete después de "Lote" (Lot).
- Conservar en refrigerador (2°C - 8°C).
- Durante el período de validez, Beriate puede conservarse a una temperatura no superior a 25°C durante un período total de 1 mes. Los períodos individuales de conservación a temperatura ambiente deben registrarse en la documentación del tratamiento para asegurarse de que el período total de conservación a esta temperatura no supere 1 mes.
- Beriate no contiene conservante y se prefiere su administración inmediata después de la reconstitución.
- Si el producto reconstituido no se administra de inmediato, su período de conservación en la ampolla no debe exceder 8 horas a temperatura ambiente. Después de transferir el producto a la jeringa, debe usarse de inmediato.
- No congelar.
- Conservar el envase en el embalaje exterior para protegerlo de la luz.
- El medicamento debe conservarse en un lugar donde no pueda ser visto o alcanzado por los niños.
6. Contenido del paquete y otra información
Qué contiene Beriate El principio activo de este medicamento es:
Beriate está disponible en forma de polvo (que contiene nominalmente 250 UI, 500 UI, 1000 UI o 2000 UI de factor VIII humano por ampolla) y parte líquida (disolvente). La solución reconstituida se administra por vía intravenosa en forma de inyección o infusión.
Beriate 250/500/1000 reconstituido con 2,5 ml, 5 ml y 10 ml de agua para inyección, respectivamente, contiene aproximadamente 100 UI/ml de factor VIII humano.
Beriate 2000 debe reconstituirse con 10 ml de agua para inyección, y la solución resultante contiene aproximadamente 200 UI/ml de factor VIII humano.
Los demás componentes son:
Glicina, cloruro de calcio, hidróxido de sodio (en cantidades pequeñas) para ajustar el pH, sacarosa, cloruro de sodio. Disolvente:agua para inyección 2,5 ml, 5 ml y 10 ml, respectivamente.
Cómo se presenta Beriate y qué contiene el paquete
Beriate está disponible en forma de polvo blanco y se suministra con agua para inyección.
La solución reconstituida debe ser transparente o ligeramente opalescente, es decir, puede brillar cuando se sostiene a la luz, pero no debe contener partículas visibles.
Presentaciones disponibles
Paquete de 250 UI que contiene:
1 ampolla de polvo
1 ampolla de agua para inyección de 2,5 ml
1 sistema de transferencia 20/20 con filtro
Conjunto para administración (embalaje interior):
1 jeringa de un solo uso de 5 ml
1 conjunto de punción venosa
2 algodones empapados en alcohol
1 parche no estéril
Paquete de 500 UI que contiene:
1 ampolla de polvo
1 ampolla de agua para inyección de 5 ml
1 sistema de transferencia 20/20 con filtro
Conjunto para administración (embalaje interior):
1 jeringa de un solo uso de 5 ml
1 conjunto de punción venosa
2 algodones empapados en alcohol
1 parche no estéril.
Paquete de 1000 UI que contiene:
1 ampolla de polvo
1 ampolla de agua para inyección de 10 ml
1 sistema de transferencia 20/20 con filtro
Conjunto para administración (embalaje interior):
1 jeringa de un solo uso de 10 ml
1 conjunto de punción venosa
2 algodones empapados en alcohol
1 parche no estéril.
Paquete de 2000 UI que contiene:
1 ampolla de polvo
1 ampolla de agua para inyección de 10 ml
1 sistema de transferencia 20/20 con filtro
Conjunto para administración (embalaje interior):
1 jeringa de un solo uso de 10 ml
1 conjunto de punción venosa
2 algodones empapados en alcohol
1 parche no estéril.
No todas las tallas de paquete pueden estar en circulación.
Título del responsable y fabricante
CSL Behring GmbH
Emil-von-Behring-Str. 76
35041 Marburgo
Alemania
Este medicamento está autorizado para su comercialización en los países miembros
del Espacio Económico Europeo bajo el nombre
Austria:
Beriate 100 UI/ml Polvo y disolvente para solución inyectable o para infusión (250 UI, 500 UI, 1000 UI)
Beriate 200 UI/ml Polvo y disolvente para solución inyectable o para infusión (2000 UI)
Bulgaria:
Beriate 250 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 500 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 1000 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 2000 UI Polvo y disolvente para solución inyectable o para infusión
Croacia:
Beriate 250 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 500 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 1000 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 2000 UI Polvo y disolvente para solución inyectable o para infusión
República Checa:
Beriate 250 UI, Beriate 500 UI, Beriate 1000 UI, Beriate 2000 UI
Eslovenia:
Beriate 250 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 500 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 1000 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 2000 UI Polvo y disolvente para solución inyectable o para infusión
Eslovaquia:
Beriate 250 UI
Beriate 500 UI
Beriate 1000 UI
Beriate 2000 UI
Letonia:
Beriate 250 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 500 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 1000 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 2000 UI Polvo y disolvente para solución inyectable o para infusión
Lituania:
Beriate 250 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 500 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 1000 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 2000 UI Polvo y disolvente para solución inyectable o para infusión
Hungría:
Beriate 250 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 500 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 1000 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 2000 UI Polvo y disolvente para solución inyectable o para infusión
Alemania:
Beriate 250 UI, Beriate 500 UI, Beriate 1000 UI, Beriate 2000 UI
Polonia:
Beriate 250 UI
Beriate 500 UI
Beriate 1000 UI
Beriate 2000 UI
Portugal:
Beriate
Rumania:
Beriate 250 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 500 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 1000 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 2000 UI Polvo y disolvente para solución inyectable o para infusión
Eslovaquia:
Beriate 250 UI
Beriate 500 UI
Beriate 1000 UI
Beriate 2000 UI
Finlandia:
Beriate 250 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 500 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 1000 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 2000 UI Polvo y disolvente para solución inyectable o para infusión
Reino Unido:
Beriate 250 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 500 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 1000 UI Polvo y disolvente para solución inyectable o para infusión
Beriate 2000 UI Polvo y disolvente para solución inyectable o para infusión
Fecha de la última actualización de la hoja de instrucciones: septiembre de 2021
Información destinada exclusivamente al personal médico especializado:
Dosis
Monitorización del tratamiento
During the treatment, the levels of factor VIII must be properly determined in order to measure the appropriate dose to be administered to the patient and the frequency of repeated infusions.
The response of individual patients to factor VIII may vary, depending on the different recovery levels and half-lives. Dosing based on body weight may require adjustment in patients who are overweight or underweight. In particular, in the case of major surgical procedures, close monitoring of substitution therapy is necessary through control of the coagulation process (factor VIII activity level in plasma).
Patient must be monitored for the development of factor VIII inhibitors. See also section 2.
The number of units of factor VIII administered is expressed in international units (UI), which are related to the current WHO standards for factor VIII concentrates. Factor VIII coagulant activity in plasma is expressed as a percentage (relative to normal human plasma) or in UI (relative to the international standards for factor VIII in plasma).
One international unit of factor VIII activity is equivalent to the activity of factor VIII contained in 1 ml of normal human plasma.
Tratamiento a demanda
The calculation of the required dosing of factor VIII is based on the empirical finding that 1 UI of factor VIII per kg of body weight increases the factor VIII activity in plasma by approximately 2% of normal activity (2 UI/dl). The required dose is calculated using the following formula:
Required units = body weight (kg) x desired increase in factor VIII level (%) x 0,5.
The dose of the product and the frequency of administration should always be tailored to the individual clinical response in each patient.
In the event of the following types of bleeding, factor VIII activity should not fall below the levels indicated for activity in plasma (as a percentage of normal or in UI/dl) during the corresponding time period. The following table shows the possible dosing in case of bleeding and surgical procedures:
| Tipo de hemorragia / procedimiento quirúrgico | Nivel de factor VIII requerido (% o UI/dl) | Frecuencia de dosificación (horas) / duración del tratamiento (días) |
| Hemorragias | ||
| Hemorragia menor en las articulaciones, hemorragia muscular o en la boca | 20-40 | Repetir cada 12 a 24 horas, durante al menos 1 día, hasta que el dolor y la hemorragia cesen o se resuelva. |
| Hemorragia mayor en las articulaciones, hemorragia muscular o hematoma | 30-60 | Repetir la infusión cada 12-24 horas durante 3 a 4 días o más, hasta que el dolor y la disfunción aguda cesen. |
| Hemorragias que ponen en peligro la vida | 60-100 | Repetir la infusión cada 8 a 24 horas, hasta que el peligro haya pasado. |
| Procedimientos quirúrgicos | ||
| Procedimientos quirúrgicos menores, incluyendo la extracción de dientes | 30-60 | Cada 24 horas, durante al menos 1 día, hasta que se resuelva. |
| Procedimientos quirúrgicos importantes | 80-100 (pre y postoperatorio) | Repetir la infusión cada 8 – 24 horas hasta la adecuada cicatrización de la herida, luego terapéuticamente durante al menos 7 días para mantener el nivel de factor VIII entre 30% - 60% (30-60 UI/dl, lo que equivale a 0,30-0,60 UI/ml). |
Profílaxis
En el tratamiento a largo plazo para la prevención de hemorragias en pacientes con hemofilia tipo A grave, se administra generalmente de 20 a 40 UI de factor VIII por kilogramo de peso corporal cada 2 a 3 días. En algunos casos, especialmente en pacientes jóvenes, puede ser necesario un tratamiento más frecuente o dosis más altas.
Niños y adolescentes
La dosis en niños depende del peso corporal, por lo que se determina la dosis según el mismo principio que para los adultos. La frecuencia de administración debe determinarse siempre individualmente, dependiendo de la eficacia clínica. Se han descrito casos de tratamiento en niños menores de 6 años.
Información sobre las propiedades farmacológicas del VWF
Además de su papel como proteína de protección para el factor VIII, el factor de von Willebrand media la adhesión de las plaquetas en el lugar del daño vascular y juega un papel en la agregación de las plaquetas.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorCSL Behring GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Beriate 1000Forma farmacéutica: Polvo, 2000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 250 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 500 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere receta
Alternativas a Beriate 1000 en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Beriate 1000 en España
Alternativa a Beriate 1000 en Ucrania
Médicos online para Beriate 1000
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Beriate 1000 – sujeta a valoración médica y normativa local.














