
Priorix-tetra

Consulta con un médico sobre la receta médica de Priorix-tetra

Cómo usar Priorix-tetra
Hoja de instrucciones del paquete: información para el usuario
Priorix-Tetra, polvo y disolvente para preparar una solución para inyección en jeringa precargada
jeringa
Vacuna contra el sarampión, la rubéola, la rubeola y el sarampión, viva
Es importante leer atentamente el contenido de la hoja de instrucciones antes de administrar la vacuna, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a un médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
El contenido de esta hoja de instrucciones se ha redactado partiendo del supuesto de que será leído por la persona que recibe la vacuna. Sin embargo, dado que la vacuna puede administrarse a adultos y niños, es posible que la hoja de instrucciones sea leída por un padre o tutor del niño.
Índice de la hoja de instrucciones
- 1. Qué es la vacuna Priorix-Tetra y para qué se utiliza
- 2. Información importante antes de administrar la vacuna Priorix-Tetra
- 3. Cómo administrar la vacuna Priorix-Tetra
- 4. Posibles efectos adversos
- 5. Cómo conservar la vacuna Priorix-Tetra
- 6. Contenido del paquete y otra información
1. Qué es la vacuna Priorix-Tetra y para qué se utiliza
Priorix-Tetra es una vacuna utilizada en personas a partir de 11 meses para prevenir enfermedades causadas por los virus del sarampión, la rubéola, la rubeola y el sarampión. En ciertas circunstancias, Priorix-Tetra también puede administrarse a niños a partir de 9 meses de edad.
Cómo actúa la vacuna Priorix-Tetra
Después de la administración de la vacuna Priorix-Tetra, el sistema inmunológico de la persona vacunada comenzará a producir anticuerpos que protegen contra la infección por los virus del sarampión, la rubéola, la rubeola y el sarampión.
Aunque Priorix-Tetra contiene virus vivos, han sido debilitados hasta el punto de que no pueden causar sarampión, rubéola, rubeola o sarampión en personas sanas.
Al igual que con todas las vacunas, Priorix-Tetra puede no proteger completamente a todas las personas vacunadas.
2. Información importante antes de administrar la vacuna Priorix-Tetra
Cuándo no administrar la vacuna Priorix-Tetra
- si el paciente ha experimentado una reacción alérgica a alguno de los componentes de la vacuna (enumerados en el punto 6). Los síntomas de una reacción alérgica incluyen erupciones cutáneas con picazón, dificultad para respirar, hinchazón de la cara o la lengua,
- si el paciente ha experimentado una reacción alérgica después de una vacuna anterior contra el sarampión, la rubéola o la rubeola,
- si el paciente es alérgico a la neomicina (un antibiótico). La dermatitis de contacto causada por la neomicina (erupción cutánea que aparece después del contacto directo de la piel con el alérgeno, como la neomicina) no debe ser un problema, pero primero debe consultar a un médico,
si el paciente tiene una infección grave con fiebre. En este caso, la vacunación debe retrasarse hasta que el paciente se recupere. Una infección leve, como un resfriado, no debe ser una contraindicación para la vacunación, pero primero debe consultar a un médico,
- si el paciente tiene una enfermedad (como una infección por el virus de la inmunodeficiencia humana (VIH) o el síndrome de inmunodeficiencia adquirida (SIDA)) o si el paciente está tomando medicamentos que pueden debilitar el sistema inmunológico. La decisión de administrar la vacuna dependerá del nivel de inmunidad,
- si el paciente está embarazada. Además, es importante evitar el embarazo durante un mes después de la vacunación.
Precauciones y advertencias
Debe consultar a un médico o farmacéutico antes de administrar la vacuna Priorix-Tetra si:
- el paciente o un familiar han experimentado convulsiones, incluidas convulsiones febriles. En este caso, el paciente debe ser observado cuidadosamente después de la vacunación, ya que la fiebre asociada con la vacunación puede ocurrir especialmente entre 5 y 12 días después de la administración de la vacuna (véase el punto 4),
- el paciente ha experimentado una reacción alérgica grave al huevo,
- el paciente ha experimentado efectos adversos después de una vacuna contra el sarampión, la rubéola o la rubeola que incluyeron moretones fáciles o sangrado más prolongado de lo habitual (véase el punto 4),
- el paciente tiene un sistema inmunológico debilitado (por ejemplo, en el caso de una infección por el VIH). El paciente debe ser sometido a una observación cuidadosa, ya que la respuesta a la vacuna puede no ser suficiente para proporcionar protección contra la enfermedad (véase el punto 2 "Cuándo no administrar la vacuna Priorix-Tetra").
Si el paciente es vacunado dentro de las 72 horas después del contacto con una persona con sarampión o varicela, la vacuna Priorix-Tetra puede proporcionar cierta protección contra la enfermedad.
Después de la vacunación, el paciente debe evitar el contacto cercano con:
- personas con sistema inmunológico debilitado,
- mujeres embarazadas que no han tenido varicela o no han sido vacunadas contra la varicela,
- recién nacidos de madres que no han tenido varicela o no han sido vacunadas contra la varicela.
Después de la administración de cualquier vacuna inyectable, puede ocurrir una pérdida de conocimiento (especialmente en adolescentes). Por lo tanto, debe informar a su médico o enfermera si el paciente ha experimentado una pérdida de conocimiento después de una inyección.
Al igual que con todas las vacunas, la vacuna Priorix-Tetra puede no proteger completamente a todas las personas vacunadas. Sin embargo, en personas vacunadas, el curso de la enfermedad suele ser mucho más suave que en personas no vacunadas.
Interacción con otros medicamentos
Debe informar a su médico sobre todos los medicamentos que está tomando actualmente o recientemente, los medicamentos que planea tomar y las vacunas que ha recibido recientemente.
La vacunación puede retrasarse por el médico durante al menos 3 meses si el paciente ha recibido una transfusión de sangre o inmunoglobulina humana.
Si el paciente debe someterse a una prueba de tuberculina (prueba cutánea para la tuberculosis), debe realizarse antes o al mismo tiempo que la administración de la vacuna, o después de 6 semanas de la vacunación.
Debe evitar tomar salicilatos (sustancias que se encuentran en muchos medicamentos para la fiebre y el dolor) durante 6 semanas después de la vacunación.
Priorix-Tetra puede administrarse al mismo tiempo que otras vacunas. Cada vacuna debe administrarse en un lugar diferente del cuerpo.
Embarazo y lactancia
La vacuna Priorix-Tetra no debe administrarse a mujeres embarazadas.
En el embarazo y la lactancia, o si se sospecha que la mujer está embarazada, o si planea tener un hijo, debe consultar a un médico o farmacéutico antes de tomar esta vacuna. Además, es importante que la paciente no quede embarazada durante un mes después de la vacunación. Durante este tiempo, debe usar un método anticonceptivo efectivo para evitar el embarazo.
Conducción de vehículos y uso de máquinas
No hay datos que sugieran que la vacuna Priorix-Tetra afecte la capacidad de conducir vehículos o usar máquinas.
Priorix-Tetra contiene sorbitol, para-aminobenzoato de potasio, fenilalanina, sodio y potasio
Esta vacuna contiene 14 mg de sorbitol por dosis.
Priorix-Tetra contiene para-aminobenzoato de potasio. Puede causar reacciones alérgicas (posibles reacciones tardías) y, raramente, espasmo bronquial.
La vacuna contiene 583 microgramos de fenilalanina por dosis. La fenilalanina puede ser perjudicial para pacientes con fenilcetonuria (una enfermedad genética rara en la que la fenilalanina se acumula en el cuerpo porque el cuerpo no la elimina adecuadamente).
Esta vacuna contiene menos de 1 mmol (23 mg) de sodio por dosis, es decir, la vacuna se considera "libre de sodio".
Esta vacuna contiene potasio, menos de 1 mmol (39 mg) de potasio por dosis, es decir, la vacuna se considera "libre de potasio".
3. Cómo administrar la vacuna Priorix-Tetra
Priorix-Tetra se administra por vía subcutánea o intramuscular, en la parte superior del brazo o en la parte externa del muslo.
Priorix-Tetra está indicado para personas a partir de 11 meses de edad.
La fecha de vacunación y el número de dosis que recibirá el paciente serán determinados por el médico según las recomendaciones oficiales.
Las vacunas no deben administrarse por vía intravenosa.
4. Posibles efectos adversos
Al igual que con cualquier medicamento, los efectos adversos también pueden ocurrir después de la administración de esta vacuna, aunque no en todos los casos.
Después de la administración de la vacuna, pueden ocurrir los siguientes efectos adversos:
♦
Muy frecuentes (pueden ocurrir con más frecuencia de 1 de cada 10 dosis de vacuna):
- dolor y enrojecimiento en el lugar de la inyección
- fiebre de 38°C o superior*
- hinchazón en el lugar de la inyección, en el caso de que la vacuna se administre a jóvenes y adultos
♦
Frecuentes (pueden ocurrir con una frecuencia no mayor de 1 de cada 10 dosis de vacuna):
- hinchazón en el lugar de la inyección, en el caso de que la vacuna se administre a niños
- fiebre superior a 39,5°C*
- irritabilidad
- erupción (manchas y/o ampollas)
♦
No muy frecuentes (pueden ocurrir con una frecuencia no mayor de 1 de cada 100 dosis de vacuna):
- llanto inusual, nerviosismo, insomnio
- malestar general, letargo, fatiga
- hinchazón de las glándulas salivales
- diarrea, vómitos
- pérdida de apetito
- infección de las vías respiratorias superiores
- resfriado
- hinchazón de los ganglios linfáticos
♦
Raros (pueden ocurrir con una frecuencia no mayor de 1 de cada 1.000 dosis de vacuna):
- infección del oído medio
- convulsiones febriles
- tos
- bronquitis
* Se ha observado una frecuencia más alta de fiebre después de la primera dosis de la vacuna Priorix-Tetra en comparación con la administración separada de la vacuna contra el sarampión, la rubéola y la rubeola y la vacuna contra la varicela durante la misma visita.
Los siguientes efectos adversos han sido notificados durante el uso rutinario de la vacuna contra el sarampión, la rubéola y la rubeola o la vacuna contra la varicela producidas por GlaxoSmithKline Biologicals:
- dolor en las articulaciones y los músculos
- reacciones alérgicas (alérgicas). Este estado puede manifestarse como una erupción cutánea con picazón o ampollas, hinchazón de los párpados y la cara, dificultad para respirar o tragar, caída repentina de la presión arterial y pérdida de conciencia. Las reacciones mencionadas pueden ocurrir incluso antes de salir de la consulta del médico. Si el paciente experimenta alguno de los síntomas anteriores, debe consultar inmediatamente a un médico
- infección o inflamación del cerebro, la médula espinal y los nervios periféricos que pueden causar dificultades para caminar (ataxia) y/o pérdida de coordinación, accidente cerebrovascular, inflamación de algunos nervios con posible sensación de hormigueo o pérdida de sensibilidad o trastornos del movimiento (síndrome de Guillain-Barré)
- estrechamiento o obstrucción de los vasos sanguíneos
- pequeñas hemorragias locales o moretones fáciles de producir debido a una disminución del número de plaquetas
- erupción multiforme (síntomas que incluyen manchas rojas, a menudo con picazón, similares a la erupción que ocurre en la varicela, que aparecen en las extremidades y, a veces, en la cara y otras partes del cuerpo)
- erupción similar a la varicela
- herpes zóster
- síntomas que se asemejan al sarampión y la rubéola (incluyendo un aumento temporal y doloroso de los testículos y ganglios linfáticos hinchados en el cuello)
Notificación de efectos adversos
Si ocurren efectos adversos, incluidos los efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Calle de Alcalá, 56
28071 Madrid
Teléfono: 91 596 34 00
Fax: 91 596 34 01
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Gracias a la notificación de efectos adversos, se pueden recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar la vacuna Priorix-Tetra
Conservar la vacuna en un lugar fuera del alcance de los niños.
No usar esta vacuna después de la fecha de caducidad que figura en la etiqueta después de "VENC".
La fecha de caducidad es el último día del mes indicado.
El código "Lote" es el número de lote de la vacuna.
Conservar y transportar a una temperatura de 2°C a 8°C.
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Después de la reconstitución, la vacuna debe administrarse inmediatamente o conservarse en la nevera (2°C - 8°C). Si no se usa dentro de las 24 horas, debe desecharse.
No debe tirar los medicamentos por el desagüe ni los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene la vacuna Priorix-Tetra?
Los principios activos de la vacuna son: virus vivos atenuados del sarampión, la rubéola, la rubeola y la varicela.
Los demás componentes de la vacuna son:
Pólvora: aminoácidos (incluyendo fenilalanina), lactosa anhidra, manitol (E 421), sorbitol (E 420), medio 199 (que incluye fenilalanina, para-aminobenzoato de potasio, sodio y potasio).
Disolvente: agua para inyección.
Cómo se presenta la vacuna Priorix-Tetra y qué contiene el paquete?
La vacuna se presenta en forma de polvo y disolvente para preparar una solución para inyección (el polvo se encuentra en una ampolla de una dosis, el disolvente en una jeringa precargada de 0,5 ml), con agujas separadas o sin agujas, en los siguientes paquetes:
- con 2 agujas separadas: paquetes de 1 o 10,
- sin agujas: paquetes de 1 o 10.
La vacuna Priorix-Tetra tiene la forma de un polvo blanco o ligeramente rosado, parte del cual puede ser amarillento, y un disolvente transparente y sin color (agua para inyección) para disolver el polvo.
No todos los tamaños de paquete deben estar en circulación.
Titular de la autorización de comercialización y fabricante
GlaxoSmithKline Biologicals S.A.
Calle de la Institución, 89
1330 Rixensart
Bélgica
Fecha de la última actualización de la hoja de instrucciones:marzo 2025
Otras fuentes de información
Información detallada sobre esta vacuna está disponible en el sitio web del Ministerio de Sanidad .
-------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico:
Al igual que con todas las vacunas inyectables, siempre debe asegurarse la posibilidad de un tratamiento adecuado y una supervisión médica en caso de reacciones anafilácticas raramente ocurridas después de la vacunación.
El alcohol y otros desinfectantes deben evaporarse de la piel antes de administrar la vacuna, ya que pueden inactivar los virus atenuados presentes en la vacuna.
La vacuna Priorix-Tetra no debe administrarse por vía intravenosa ni intradérmica.
Dado que no se han realizado estudios sobre la compatibilidad, no debe mezclarse el producto con otros medicamentos.
Después de la reconstitución, la vacuna debe someterse a una evaluación visual. Debido a los pequeños cambios de pH, la vacuna reconstituida puede tener un color que varía desde un tono claro de melocotón hasta un tono rosa fuerte. Después de la reconstitución, pueden ser visibles partículas semitransparentes del producto. Este es un fenómeno normal y no afecta la eficacia de la vacuna.
Si la vacuna tiene un color diferente o contiene otras partículas sólidas, no debe administrarse.
La vacuna debe reconstituirse agregando todo el disolvente de la jeringa precargada a la ampolla de polvo.
Para unir la aguja a la jeringa precargada, debe seguir atentamente las instrucciones presentadas en las figuras 1 y 2. La jeringa precargada suministrada con la vacuna Priorix-Tetra puede diferir ligeramente de la presentada en la figura (puede no tener rosca para atornillar la aguja). En este caso, la aguja debe fijarse sin atornillar.
Aguja
Jeringa precargada
Debe sostener siempre la jeringa precargada por su cuerpo, no por el émbolo ni por el adaptador Luer Lock, y sostener la aguja en el eje de la jeringa precargada (como se muestra en la figura 2). No seguir estas recomendaciones puede causar que el adaptador Luer Lock se doble y que se produzca una fuga de la jeringa precargada.
Si durante la unión de la aguja a la jeringa precargada se produce una separación del adaptador Luer Lock, debe usar una nueva dosis de vacuna (nueva jeringa precargada y ampolla).
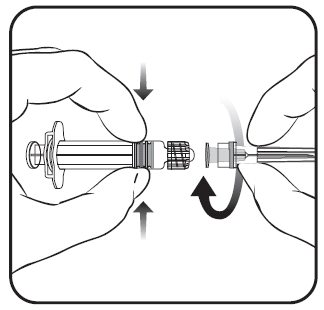
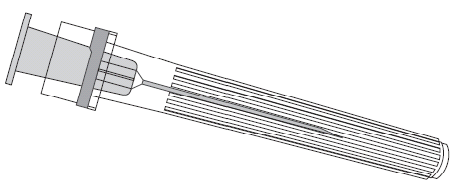
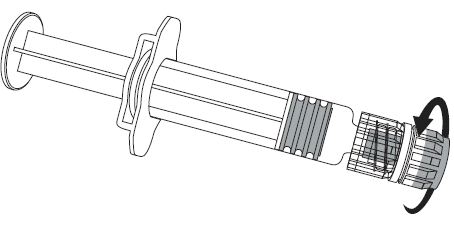
Figura 1. Figura 2.
- 1. Debe girar la tapa de la jeringa precargada en el sentido contrario a las agujas del reloj (como se muestra en la figura 1).
Independientemente de que el adaptador Luer Lock gire o no, debe seguir las instrucciones a continuación:
- 2. Debe fijar la aguja a la jeringa precargada mediante la unión suave de la punta de la aguja al adaptador Luer Lock y girarla un cuarto de vuelta en el sentido de las agujas del reloj, hasta que se sienta un bloqueo de la aguja (como se muestra en la figura 2).
- 3. Debe quitar la cubierta de la aguja, que puede ofrecer resistencia.
- 4. Debe agregar el disolvente al polvo. Luego debe agitar enérgicamente hasta que el polvo se disuelva completamente.
- 5. Debe extraer todo el contenido de la ampolla.
- 6. Para administrar la vacuna, debe usar una aguja nueva. Para ello, debe seguir las instrucciones del punto 2.
- 7. Después de la reconstitución, la vacuna debe administrarse inmediatamente o conservarse en la nevera (2°C - 8°C). Si no se usa dentro de las 24 horas, debe desecharse.
Los restos de producto no utilizado o sus desechos deben eliminarse de acuerdo con las regulaciones locales.
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorGlaxoSmithKline Biologicals S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Priorix-tetraForma farmacéutica: Polvo, -Principio activo: measles, combinations with mumps, rubella and varicella, live attenuatedFabricante: GlaxoSmithKline Biologicals S.A.Requiere recetaForma farmacéutica: Polvo, -Principio activo: measles, combinations with mumps and rubella, live attenuatedFabricante: GlaxoSmithKline Biologicals S.A.Requiere recetaForma farmacéutica: Suspensión, 160 unidades antigénicas ELISA del virus de la hepatitis A, cepa GBM/0,5 ml; 1 dosis (0,5 ml)Principio activo: hepatitis A, inactivated, whole virusRequiere receta
Alternativas a Priorix-tetra en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Priorix-tetra en Hiszpania
Alternativa a Priorix-tetra en Ukraina
Médicos online para Priorix-tetra
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Priorix-tetra – sujeta a valoración médica y normativa local.














