

Priorix

Consulta con un médico sobre la receta médica de Priorix

Cómo usar Priorix
HOJA DE INSTRUCCIONES PARA EL PACIENTE
Hoja de instrucciones del paquete: información para el usuario
Priorix,polvo y disolvente para preparar una solución para inyección
Vacuna contra el sarampión, la rubéola y la rubeola, viva
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de administrar la vacuna, ya que contiene información importante para el paciente.
- Es importante conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, consulte a su médico o farmacéutico.
- La vacuna está prescrita para una persona específica. No debe ser transferida a otros.
- Si el paciente experimenta algún efecto adverso, incluidos cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4. El contenido de esta hoja de instrucciones se ha redactado con el supuesto de que será leído por la persona que recibe la vacuna. Sin embargo, como esta vacuna puede ser administrada a adultos y niños, es posible que los padres o tutores del niño lean el contenido de esta hoja de instrucciones.
Índice de la hoja de instrucciones:
- 1. Qué es la vacuna Priorix y para qué se utiliza
- 2. Información importante antes de administrar la vacuna Priorix
- 3. Cómo administrar la vacuna Priorix
- 4. Posibles efectos adversos
- 5. Cómo almacenar la vacuna Priorix
- 6. Contenido del paquete y otra información
1. Qué es la vacuna Priorix y para qué se utiliza
Priorix es una vacuna utilizada en niños después de los 9 meses de edad, adolescentes y adultos para prevenir el sarampión, la rubéola y la rubeola.
Cómo funciona Priorix
El sistema inmunológico (sistema de defensa natural del cuerpo) de la persona a quien se administra la vacuna Priorix producirá anticuerpos, lo que protegerá al paciente contra la infección por los virus del sarampión, la rubéola y la rubeola.
Aunque la vacuna Priorix contiene virus vivos, son demasiado débiles para causar la enfermedad del sarampión, la rubéola y la rubeola en personas sanas.
2. Información importante antes de administrar la vacuna Priorix
Cuándo no administrar la vacuna Priorix:
- si ha habido una reacción alérgica a cualquier componente de esta vacuna (enumerado en el punto 6). Los síntomas de alergia incluyen erupción cutánea picazón, dificultad para respirar, hinchazón de la cara o la lengua,
- si ha habido una reacción alérgica a la neomicina (antibiótico). La dermatitis de contacto causada por la neomicina (erupción cutánea en situaciones en que hay contacto directo con el alérgeno como la neomicina) no es una contraindicación para la administración de la vacuna, pero debe informar a su médico,
- si hay una enfermedad aguda y grave con fiebre. En este caso, la vacunación se pospondrá hasta la recuperación. Una infección leve, como un resfriado, no debe ser una contraindicación para la vacunación, pero debe hablar con su médico,
- si hay alguna enfermedad (por ejemplo, infección por el virus de la inmunodeficiencia humana (VIH) o síndrome de inmunodeficiencia adquirida (SIDA)) o si el paciente está tomando medicamentos que pueden debilitar el sistema inmunológico. Si el paciente recibirá la vacuna dependerá del nivel de inmunidad,
- si se ha confirmado el embarazo. Además, debe evitar el embarazo durante 1 mes después de la vacunación.
Precauciones y advertencias
Antes de administrar la vacuna Priorix, debe discutir con su médico o farmacéutico si:
- el paciente tiene trastornos del sistema nervioso central, convulsiones con fiebre alta o si ha habido convulsiones en su familia. En caso de que se produzca una fiebre alta después de la vacunación, debe consultar a su médico de inmediato,
- el paciente ha tenido una reacción alérgica grave a la proteína del huevo,
- el paciente ha experimentado efectos adversos después de la vacunación contra el sarampión, la rubéola o la rubeola que incluyen moretones fáciles o sangrado más largo de lo habitual (véase el punto 4),
- el paciente tiene un sistema inmunológico debilitado (por ejemplo, en caso de infección por el virus de la inmunodeficiencia humana (VIH)). El paciente debe estar bajo estrecha observación debido a que la respuesta a la vacuna puede no ser suficiente para proporcionar protección contra la enfermedad (véase el punto 2 "Cuándo no administrar la vacuna Priorix").
Después o incluso antes de la administración de cualquier vacuna en forma de inyección, puede ocurrir un desmayo (especialmente en adolescentes). En este caso, debe informar a su médico o enfermera si el paciente ha tenido un desmayo durante la administración de una inyección.
Si el paciente es vacunado dentro de las 72 horas después del contacto con una persona con sarampión, la vacuna Priorix puede proporcionar cierta protección contra la enfermedad.
Niños menores de 12 meses
Los niños vacunados en el primer año de vida pueden no estar completamente protegidos. Si es necesario administrar dosis adicionales de la vacuna, el médico recomendará su administración.
Al igual que con todas las vacunas, la vacuna Priorix puede no proporcionar protección completa a todas las personas vacunadas.
Interacción de la vacuna Priorix con otros medicamentos
Debe informar a su médico sobre todas las vacunas y medicamentos que el paciente esté tomando actualmente o recientemente, así como sobre los medicamentos o vacunas que el paciente planea tomar.
La vacuna Priorix puede ser administrada al mismo tiempo que otras vacunas, como:
vacuna contra la difteria, el tétanos y la tos ferina (acelular), vacuna contra la infección por Haemophilus influenzae tipo b, vacuna oral o inactivada contra la polio, vacuna contra la hepatitis A, vacuna contra la hepatitis B, vacuna contra la varicela, vacuna contra la meningitis por meningococos del grupo B, así como vacuna conjugada contra meningococos del serogrupo C, vacuna conjugada contra meningococos de los grupos A, C, W135 y Y, y vacuna conjugada contra neumococos. Para obtener información adicional, debe consultar a su médico o enfermera.
Cada vacuna debe ser inyectada en un lugar diferente.
Si la vacuna Priorix no puede ser administrada al mismo tiempo que otras vacunas que contienen virus vivos atenuados, debe mantenerse un intervalo de al menos un mes entre las vacunaciones.
La vacunación puede ser pospuesta durante al menos 3 meses si el paciente ha recibido recientemente una transfusión de sangre o ha recibido inmunoglobulina humana.
Si el paciente debe someterse a una prueba de tuberculina (prueba cutánea para la tuberculosis), debe realizarse antes o al mismo tiempo que la administración de la vacuna, o después de 6 semanas de la vacunación.
Embarazo, lactancia y fertilidad
La vacuna Priorix no debe ser administrada a mujeres embarazadas .
Si la paciente está embarazada o en período de lactancia, sospecha que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de recibir esta vacuna.
Además, es importante que la paciente no quede embarazada durante 1 mes después de la vacunación. Durante este tiempo, debe utilizar un método anticonceptivo efectivo para evitar el embarazo.
La administración no intencional de la vacuna Priorix a una mujer embarazada no debe ser motivo para interrumpir el embarazo.
Priorix contiene sorbitol, ácido para-aminobenzoico, fenilalanina, sodio y potasio
Esta vacuna contiene 9 mg de sorbitol por dosis.
Priorix contiene ácido para-aminobenzoico. Puede causar reacciones alérgicas (posibles reacciones de tipo tardío) y, excepcionalmente, espasmo bronquial.
La vacuna contiene 334 microgramos de fenilalanina por dosis. La fenilalanina puede ser perjudicial para los pacientes con fenilcetonuria (PKU), una enfermedad genética rara en la que la fenilalanina se acumula en el cuerpo porque el cuerpo no la elimina adecuadamente.
Esta vacuna contiene menos de 1 mmol (23 mg) de sodio por dosis, es decir, la vacuna se considera "libre de sodio".
Esta vacuna contiene potasio, menos de 1 mmol (39 mg) de potasio por dosis, es decir, la vacuna se considera "libre de potasio".
3. Cómo administrar la vacuna Priorix
La vacuna Priorix se administra por vía subcutánea o intramuscular, en la parte superior del brazo o en la parte externa del muslo.
Priorix está indicado para su uso en niños después de los 9 meses de edad, adolescentes y adultos.
El momento adecuado para la vacunación y el número de dosis administradas será determinado por el médico según las recomendaciones oficiales.
Las vacunas no deben ser administradas por vía intravenosa.
4. Posibles efectos adversos
Al igual que con cualquier medicamento, esta vacuna puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Después de la administración de la vacuna Priorix durante los ensayos clínicos, se produjeron los siguientes efectos adversos:
♦ Muy frecuentes (pueden ocurrir con más frecuencia de 1 de cada 10 dosis de vacuna):
- Enrojecimiento en el lugar de la inyección
- Fiebre (38°C o superior)
♦ Frecuentes (pueden ocurrir con menos frecuencia de 1 de cada 10 dosis de vacuna):
- Dolor y hinchazón en el lugar de la inyección
- Fiebre (superior a 39,5°C)
- Erupción
- Infección de las vías respiratorias superiores
♦ Poco frecuentes (pueden ocurrir con menos frecuencia de 1 de cada 100 dosis de vacuna):
- Otitis media
- Aumento de tamaño de los ganglios linfáticos (ganglios en el cuello, axilas o ingle)
- Pérdida de apetito
- Nerviosismo
- Llanto inusual
- Insomnio
- Enrojecimiento, irritación o lagrimeo de los ojos (conjuntivitis)
- Bronquitis
- Tos
- Hinchazón de las glándulas salivales parietales (ganglios en la región de la mejilla)
- Diarrhea
- Vómitos
♦ Raros (pueden ocurrir con menos frecuencia de 1 de cada 1000 dosis de vacuna):
- Convulsiones con fiebre alta
- Reacciones alérgicas
Después de la comercialización de la vacuna, se han notificado muy raramente los siguientes efectos adversos:
- Dolor en las articulaciones y los músculos
- Hemorragias o moretones fáciles causados por una disminución en el número de plaquetas
- Reacciones alérgicas graves que ponen en peligro la vida
- Infección o inflamación del cerebro, la médula espinal y los nervios periféricos que causan dificultades transitorias para caminar (ataxia) y/o pérdida transitoria de coordinación, inflamación de algunos nervios con posible sensación de hormigueo o pérdida de sensibilidad o trastornos del movimiento (síndrome de Guillain-Barré)
- Estrechamiento o obstrucción de los vasos sanguíneos
- Erupción multiforme (erupción cutánea con puntos rojos, a menudo picazón, similares a la erupción que ocurre en el sarampión, que aparecen primero en las extremidades y sometimes en la cara y otras partes del cuerpo)
- Síntomas similares al sarampión y la rubéola (incluyendo hinchazón transitoria y dolorosa de los testículos y glándulas hinchadas en el cuello)
Notificación de efectos adversos
Si se producen algún efecto adverso, incluidos cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Reacciones Adversas de Medicamentos del Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas:
Al. Jerozolimskie 181C
02-222 Varsovia
Tel.: 22 49 21 301
Fax: 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Gracias a la notificación de los efectos adversos, podrá recopilarse más información sobre la seguridad del medicamento.
5. Cómo almacenar la vacuna Priorix
La vacuna debe almacenarse en un lugar no visible y no accesible para los niños.
No debe utilizarse esta vacuna después de la fecha de caducidad indicada en el paquete exterior.
Debe almacenarse y transportarse a una temperatura de 2°C a 8°C.
No debe congelarse.
Debe almacenarse en el paquete original para protegerlo de la luz.
Después de la reconstitución, la vacuna debe administrarse de inmediato. Si no es posible, debe almacenarse en la nevera (2°C a 8°C) y utilizarse dentro de las 8 horas después de la reconstitución.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene la vacuna Priorix?
Los principios activos de la vacuna son virus vivos atenuados: sarampión, rubéola y rubeola.
Los demás componentes de la vacuna son:
Polvere: aminoácidos (incluyendo fenilalanina), lactosa (anhidra), manitol (E 421), sorbitol (E 420),
medio 199 (incluyendo fenilalanina, ácido para-aminobenzoico, sodio y potasio).
Disolvente: agua para inyección.
Cómo se presenta la vacuna Priorix y qué contiene el paquete?
La vacuna Priorix se presenta como polvo y disolvente para preparar una solución para inyección (polvo en una ampolla de dosis única y disolvente en una jeringa precargada de 0,5 ml) en los siguientes tamaños de paquete:
- con 2 agujas separadas: paquetes de 1 o 10 unidades,
- sin agujas: paquetes de 1 o 10 unidades.
Priorix se suministra en forma de polvo blanco a ligeramente rosado, cuya parte puede ser amarilla a ligeramente anaranjada, y disolvente transparente e incoloro (agua para inyección). Estos componentes forman la vacuna después de la reconstitución.
No todos los tipos de paquetes pueden estar disponibles en el mercado.
Título responsable y fabricante
GlaxoSmithKline Biologicals S.A.
rue de l’Institut 89
1330 Rixensart, Bélgica
Fecha de la última actualización de la hoja de instrucciones:07/2025
Otras fuentes de información
Información detallada sobre este medicamento está disponible en el sitio web del Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas .
------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Al igual que con todas las vacunas administradas por inyección, existe la posibilidad de una reacción anafiláctica rara, por lo que debe garantizarse la posibilidad de atención médica especializada inmediatamente después de la vacunación.
El alcohol y otros medios desinfectantes deben evaporarse de la piel antes de administrar la vacuna, ya que pueden inactivar los virus atenuados que contiene la vacuna.
La vacuna Priorix no debe administrarse por vía intravenosa.
Debido a la falta de estudios de compatibilidad, la vacuna no debe mezclarse con otros productos medicinales.
El disolvente y la vacuna después de la reconstitución deben evaluarse visualmente antes de la reconstitución y antes de la administración para detectar la presencia de partículas extrañas y (o) cambios físicos. En caso de que se detecten irregularidades en el aspecto, no debe utilizarse el disolvente o la vacuna preparada.
La vacuna debe someterse a reconstitución mediante la adición de todo el disolvente de la jeringa precargada a la ampolla de polvo.
Para conectar la aguja a la jeringa precargada, debe seguir las instrucciones presentadas en las figuras 1 y 2. La jeringa precargada suministrada con la vacuna PRIORIX puede diferir ligeramente de la presentada en la figura (puede no tener rosca para atornillar la aguja). En este caso, la aguja debe conectarse sin atornillar.
Aguja
Jeringa precargada
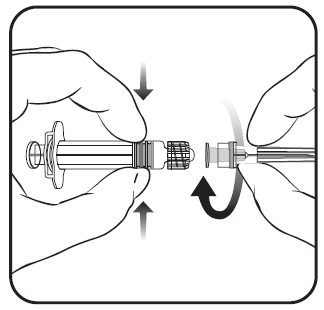
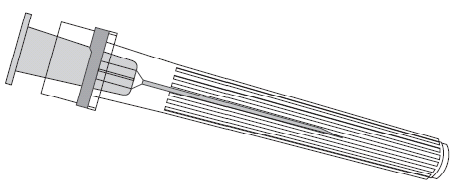
Debe sostener siempre la jeringa precargada por su cuerpo, no por el émbolo ni por el adaptador Luer Lock (inglés Luer Lock Adaptor, LLA), y la aguja debe mantenerse en el eje de la jeringa precargada (como se muestra en la figura 2). No seguir estas recomendaciones puede causar que el adaptador LLA se tuerza y se produzca una fuga de la jeringa precargada.
Si durante la conexión de la aguja a la jeringa precargada se produce la separación del adaptador LLA, debe utilizar una nueva dosis de la vacuna (nueva jeringa precargada y ampolla de polvo).
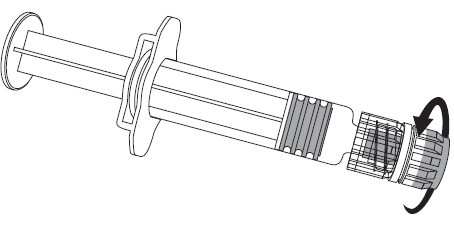
Figura 1. Figura 2.
- 1. Debe desenroscar la tapa de la jeringa precargada girándola en sentido contrario a las agujas del reloj (como se muestra en la figura 1).
Independientemente de que el adaptador LLA gire o no, debe seguir las instrucciones siguientes:
- 2. Debe conectar la aguja a la jeringa precargada mediante la conexión suave de la tapa de la aguja al adaptador LLA y girándola un cuarto de vuelta en el sentido de las agujas del reloj, hasta que se sienta el bloqueo de la aguja (como se muestra en la figura 2).
- 3. Debe retirar la cubierta de la aguja, que puede ofrecer resistencia.
- 4. Debe agregar el disolvente al polvo. Luego, debe agitar enérgicamente hasta que el polvo se disuelva completamente.
Dependiendo de las pequeñas fluctuaciones del pH, la vacuna después de la reconstitución puede tener un color desde el bronceado hasta el rosa con un tinte de fucsia, lo que no afecta su eficacia.
- 5. Debe extraer todo el contenido de la ampolla.
- 6. Para administrar la vacuna, debe utilizar una aguja nueva. Para ello, debe desenroscar la aguja de la jeringa precargada y conectar la aguja para inyección, siguiendo las instrucciones del punto 2.
Después de la reconstitución, la vacuna debe administrarse de inmediato. Si no es posible, debe almacenarse a una temperatura de 2°C a 8°C y utilizarse dentro de las 8 horas después de la reconstitución.
Los restos del producto no utilizado o sus desechos deben eliminarse de acuerdo con las regulaciones locales.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorGlaxoSmithKline Biologicals S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a PriorixForma farmacéutica: Polvo, -Principio activo: measles, combinations with mumps, rubella and varicella, live attenuatedRequiere recetaForma farmacéutica: Polvo, -Principio activo: measles, combinations with mumps, rubella and varicella, live attenuatedFabricante: GlaxoSmithKline Biologicals S.A.Requiere recetaForma farmacéutica: Suspensión, 160 unidades antigénicas ELISA del virus de la hepatitis A, cepa GBM/0,5 ml; 1 dosis (0,5 ml)Principio activo: hepatitis A, inactivated, whole virusRequiere receta
Alternativas a Priorix en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Priorix en España
Alternativa a Priorix en Ucrania
Médicos online para Priorix
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Priorix – sujeta a valoración médica y normativa local.














