Cómo usar Menopur
HOJA DE INSTRUCCIONES PARA EL PACIENTE
Para uso interno - Interno
Hoja de instrucciones adjunta al embalaje: información para el paciente
MENOPUR 600 UI solución inyectable en inyector
Menotropina
Es importante leer el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede dañar a otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es MENOPUR y para qué se utiliza
- 2. Información importante antes de usar MENOPUR
- 3. Cómo usar MENOPUR
- 4. Posibles efectos adversos
- 5. Cómo conservar MENOPUR
- 6. Contenido del embalaje y otra información
1. Qué es MENOPUR y para qué se utiliza
MENOPUR es una solución inyectable en un inyector semiautomático. La inyección se administra bajo la piel (inyección subcutánea) - generalmente en el abdomen. MENOPUR contiene menotropina, que es una mezcla de dos hormonas naturales llamados:
- Hormona folitropina (FSH) y
- Hormona luteinizante (LH). Permiten el funcionamiento normal de los órganos reproductivos. Las hormonas FSH y LH contenidas en la menotropina se obtienen de la orina de mujeres posmenopáusicas.
Para qué se utiliza MENOPUR
MENOPUR se utiliza para tratar a mujeres que no pueden quedar embarazadas, en las siguientes situaciones: en mujeres que no pueden quedar embarazadas porque sus ovarios no producen óvulos (también en casos de síndrome de ovario poliquístico). MENOPUR se utiliza en mujeres a las que se les ha administrado previamente un medicamento llamado "citrate de clomifeno" para tratar la infertilidad, pero el medicamento no ha sido efectivo; en mujeres que participan en programas de reproducción asistida, como:
fecundación in vitro (FIV, en inglés) o transferencia de embriones (ET, en inglés), transferencia de gametos a la trompa de Falopio (GIFT, en inglés), inyección intracitoplasmática de espermatozoides (ICSI, en inglés).
Cómo funciona MENOPUR
MENOPUR ayuda a producir varios folículos ováricos en los ovarios, donde pueden desarrollarse los óvulos. Esto se llama desarrollo de folículos ováricos múltiples. Para uso interno - Interno
2. Información importante antes de usar MENOPUR
Qué debe verificar antes de comenzar a usar MENOPUR
Antes de comenzar a usar MENOPUR, el médico debe evaluar las causas de los trastornos de la fertilidad en ambos socios. Debe verificar especialmente si no hay enfermedades que requieran un tratamiento diferente, como:
hipotiroidismo y enfermedad de Addison; niveles elevados de prolactina - llamada hiperprolactinemia; tumores pituitarios - glándula ubicada en la base del cerebro; tumores hipotalámicos - área ubicada debajo de la parte del cerebro llamada hipotálamo. Si el paciente tiene alguna de estas enfermedades, debe informar a su médico antes de comenzar el tratamiento con MENOPUR.
Cuándo no debe usar MENOPUR
Si el paciente es alérgico a la menotropina o a alguno de los demás componentes de este medicamento (enumerados en el punto 6); si el paciente tiene tumores uterinos, ováricos, mamarios o cerebrales, como pituitarios o hipotálamo; si el paciente tiene quistes ováricos o agrandamiento ovárico - no causado por el síndrome de ovario poliquístico; si el paciente tiene malformaciones uterinas o de otros órganos genitales; si el paciente tiene sangrado vaginal de causa desconocida; si el paciente tiene miomas uterinos - son tumores en el útero que no son cáncer; si el paciente está embarazada o en período de lactancia.
Advertencias y precauciones Síndrome de hiperestimulación ovárica (OHSS)
Un efecto adverso grave de este medicamento, especialmente en mujeres con síndrome de ovario poliquístico, es el "síndrome de hiperestimulación ovárica" o "OHSS" (véase el punto 4). Debe informar a su médico de inmediato si el paciente experimenta síntomas de OHSS, incluso si:
- han pasado varios días desde la última administración del medicamento
- el paciente ha dejado de usar MENOPUR. Pueden ser síntomas de una actividad ovárica excesiva, lo que puede tener un curso grave. En tal caso, el médico suspenderá el tratamiento con MENOPUR y iniciará un tratamiento adecuado en el hospital.
El cumplimiento de la dosis prescrita y la observación cuidadosa del curso del tratamiento reducen la probabilidad de que ocurran estos síntomas.
Exámenes y pruebas
Durante el uso de este medicamento, el médico generalmente remite al paciente para exámenes de ultrasonido (USG) y, a veces, para análisis de sangre para verificar la respuesta al tratamiento.
Riesgos asociados con el embarazo
El tratamiento con hormonas como MENOPUR puede aumentar el riesgo de:
embarazo ectópico (fuera del útero) en mujeres con enfermedades de las trompas de Falopio previamente diagnosticadas; aborto; embarazo múltiple (gemelos, trillizos, etc.); defectos físicos presentes en el niño al nacer (defectos congénitos). En algunas mujeres tratadas por infertilidad, se desarrollaron tumores ováricos o de otros órganos reproductivos. Hasta ahora, no se sabe si esto fue causado por el tratamiento con hormonas como MENOPUR. Para uso interno - Interno
Coágulos de sangre
La probabilidad de que ocurran coágulos en las venas o arterias es mayor en mujeres embarazadas. El tratamiento de la infertilidad puede aumentar la probabilidad de coágulos, especialmente si:
el paciente tiene sobrepeso; el paciente tiene una enfermedad de coagulación de la sangre "trombofilia"; los coágulos han ocurrido previamente o en alguien de la familia del paciente. El paciente debe informar a su médico si cree que esto lo afecta.
Niños y adolescentes
El uso de MENOPUR en niños y adolescentes no es adecuado.
MENOPUR y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que está tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar. El citrato de clomifeno es otro medicamento utilizado para tratar la infertilidad. Si MENOPUR se administra al mismo tiempo que el citrato de clomifeno, el efecto en los ovarios puede aumentar.
Embarazo y lactancia
No debe usar MENOPUR durante el embarazo o la lactancia.
Conducción de vehículos y uso de máquinas
Es poco probable que MENOPUR afecte la capacidad de conducir vehículos o operar máquinas.
Información importante sobre algunos componentes de MENOPUR
MENOPUR contiene menos de 1 mmol de sodio (23 mg) por dosis, lo que significa que el medicamento se considera esencialmente "libre de sodio".
3. Cómo usar MENOPUR
Este medicamento debe usarse siempre según las indicaciones de su médico. En caso de dudas, debe consultar a su médico.
Mujeres que no producen óvulos (no ovulan)
El tratamiento debe comenzar dentro de los primeros 7 días del ciclo menstrual. El día 1 es el primer día de la menstruación. El medicamento debe administrarse diariamente durante al menos 7 días. Cuánto MENOPUR debe usar?
La dosis inicial es generalmente de 75 UI (unidades internacionales) a 150 UI por día. Dependiendo de la respuesta del paciente, la dosis puede aumentarse - hasta un máximo de 225 UI. La dosis determinada debe administrarse durante al menos 7 días antes de que el médico cambie la dosis. Se recomienda aumentar la dosis en 37,5 UI, pero no más de 75 UI. El médico verificará los resultados del tratamiento con MENOPUR. El ciclo de tratamiento debe suspenderse si no se observa respuesta al tratamiento después de 4 semanas. Cuando la respuesta al tratamiento con MENOPUR es satisfactoria:
El paciente recibirá una inyección única de una hormona llamada "gonadotropina coriónica humana" (hCG). La dosis será de 5.000 UI a 10.000 UI. El paciente recibirá hCG al día siguiente de la última inyección de MENOPUR. Para uso interno - Interno
Se recomienda tener relaciones sexuales el día de la administración y al día siguiente de la administración de hCG. Alternativamente, se puede realizar una inseminación (administración de semen directamente en el útero). El paciente permanece bajo la observación cuidadosa del médico durante al menos 2 semanas. Cuando no hay respuesta al tratamiento con MENOPUR:
El médico verificará los resultados del uso de MENOPUR. Dependiendo del progreso del tratamiento, el médico puede decidir suspender la administración de MENOPUR y no administrar hCG.
Mujeres que participan en programas de reproducción asistida
Las pacientes que participan en un programa de reproducción asistida también recibirán un medicamento que ayuda a la acción de una hormona llamada "hormona liberadora de gonadotropina", en inglés "Gonadotropin Releasing Hormone" - GnRH. Este medicamento se llama "agonista de GnRH". La administración de MENOPUR debe comenzar aproximadamente 2 semanas después de comenzar el tratamiento con el agonista de GnRH. La paciente también puede recibir un medicamento llamado "antagonista de GnRH". La administración de MENOPUR debe comenzar el 2.º o 3.º día del ciclo menstrual (el 1.º día de sangrado menstrual es el 1.º día del ciclo). Cuánto MENOPUR debe usar?
El medicamento MENOPUR debe administrarse diariamente durante al menos 5 días. La dosis inicial de MENOPUR es generalmente de 150 UI a 225 UI. Dependiendo de la respuesta del paciente al tratamiento, esta dosis puede aumentarse hasta un máximo de 450 UI por día. No debe aumentar la dosis en más de 150 UI de una vez. El tratamiento generalmente no debe durar más de 20 días. Después de verificar que hay un número suficiente de folículos ováricos del tamaño adecuado, la paciente recibirá una inyección única de hCG en una dosis de hasta 10.000 UI para inducir la ovulación (liberación del óvulo). La paciente permanece bajo la observación cuidadosa del médico durante al menos 2 semanas después de la administración de hCG. El médico verificará los resultados del uso de MENOPUR. Dependiendo del progreso del tratamiento, el médico puede decidir suspender la administración de MENOPUR y no administrar hCG. En tal caso, la paciente será informada sobre la necesidad de usar un método anticonceptivo mecánico (por ejemplo, condón). De lo contrario, debe abstenerse de tener relaciones sexuales hasta que tenga su próximo período menstrual.
Uso de MENOPUR
Debe seguir muy cuidadosamente las "Instrucciones de uso" proporcionadas con el inyector. La primera inyección de MENOPUR debe ser administrada bajo la supervisión de un médico o enfermera. El médico decidirá si la paciente puede administrar las inyecciones siguientes por sí misma en casa - después de una capacitación completa. MENOPUR se administrará en una inyección subcutánea (bajo la piel), generalmente en el abdomen. Cada inyector prefabricado puede usarse para varias inyecciones.
Uso de una dosis mayor de la recomendada de MENOPUR
En caso de que se use una dosis mayor de la recomendada de MENOPUR, debe informar a su médico. Para uso interno - Interno
Omision de la administración de MENOPUR
No debe usar una dosis doble para compensar una dosis omitida. En caso de que se omita la administración de MENOPUR, debe informar a su médico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Efectos adversos graves
Síndrome de hiperestimulación ovárica (OHSS)
Debe informar a su médico de inmediatosi el paciente experimenta alguno de los siguientes síntomas, que pueden ser síntomas de OHSS: dolor abdominal o hinchazón abdominal; malestar general (sensación de enfermedad); diarrea; aumento de peso; dificultad para respirar; disminución de la frecuencia de micción.
En caso de que ocurra alguno de estos síntomas, debe comunicarse con su médico de inmediato, incluso si el síntoma ocurre varios días después de la última administración del medicamento o si
el paciente ha dejado de usar MENOPUR.El paciente puede necesitar atención médica de emergencia. Estos efectos adversos pueden indicar una actividad ovárica excesiva, lo que se conoce como síndrome de hiperestimulación ovárica (OHSS). En casos graves de OHSS, se han observado complicaciones como la acumulación de líquido en la cavidad abdominal, la cavidad pélvica o la cavidad pleural, dificultad para respirar y disminución de la frecuencia o cantidad de orina eliminada, formación de coágulos de sangre en los vasos sanguíneos (trastornos tromboembólicos) y torsión ovárica; como complicación de la hiperestimulación ovárica inducida por la estimulación excesiva.
Reacciones alérgicas (hipersensibilidad)
Debe informar a su médico de inmediato si ocurre: erupción cutánea; picazón; hinchazón de la garganta y dificultad para respirar. En caso de que ocurra alguno de estos síntomas, debe comunicarse con su médico de inmediato.
Otros efectos adversos
Los siguientes efectos adversosocurren frecuentemente, es decir, en 1 de cada 10 pacientes tratados: dolor de cabeza; sensación de enfermedad (náuseas); dolor o hinchazón abdominal; dolor en la pelvis; reacciones en el lugar de inyección, como dolor, enrojecimiento, hinchazón, picazón o moretones. Los siguientes efectos adversosocurren con poca frecuencia, es decir, en 1 de cada 100 pacientes tratados: sensación de enfermedad (vómitos); trastornos abdominales; diarrea; sensación de cansancio; mareo; quistes ováricos con líquido (quiste ovárico); trastornos mamarios, incluyendo dolor mamario, sensibilidad mamaria, sensación de incomodidad, dolor en los pezones y hinchazón mamaria; sofocos. Los siguientes efectos adversosocurren con muy poca frecuencia, es decir, en 1 de cada 1.000 pacientes tratados: acné. Además de los anteriormente mencionados, se han observado los siguientes efectos adversoscon una frecuencia desconocida: trastornos de la visión; fiebre; sensación de enfermedad; aumento de peso; dolor muscular y articular; torsión ovárica, como complicación de la hiperestimulación ovárica inducida por la estimulación excesiva; urticaria; coágulos de sangre, como complicación de la hiperestimulación ovárica inducida por la estimulación excesiva.
Notificación de efectos adversos
Si ocurren efectos adversos, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos de la Agencia de Registro de Medicamentos: Aleje Jerozolimskie 181C, 02-222 Varsovia, Tel: +48 22 49 21 301, Fax: +48 22 49 21 309, sitio web: https://smz.ezdrowie.gov.pl. Los efectos adversos también pueden notificarse al titular de la autorización de comercialización. Al notificar los efectos adversos, se pueden recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar MENOPUR
El medicamento debe conservarse en un lugar no visible y no accesible para los niños. No debe usar este medicamento después de la fecha de caducidad que figura en la etiqueta del inyector prefabricado y la caja de cartón, después de "EXP". La fecha de caducidad es el último día del mes indicado. Antes de usar:
Conservar en el refrigerador a una temperatura de 2°C a 8°C. No congelar. Después de abrir:
Usar cada inyector semiautomático dentro de los 28 días después de abrir. Conservar a una temperatura inferior a 25°C. El inyector debe conservarse siempre con la cubierta puesta para protegerlo de la luz. Los medicamentos no deben tirarse por el desagüe ni a los contenedores de basura doméstica. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del embalaje y otra información
Para uso interno - Interno
Qué contiene MENOPUR
- El principio activo del medicamento es menotropina altamente purificada (gonadotropina menopáusica humana, hMG)
MENOPUR 600 UI solución inyectable en inyector:
Un inyector semiautomático contiene menotropina en una cantidad equivalente a 600 UI de FSH (hormona folitropina) y 600 UI de LH (hormona luteinizante). Los demás componentes son: fenol, metionina, clorhidrato de arginina, polisorbato 20, hidróxido de sodio, ácido clorhídrico diluido, agua para inyección.
Cómo es MENOPUR y qué contiene el embalaje
MENOPUR es una solución inyectable transparente y sin color en un inyector. MENOPUR 600 UI solución inyectable en inyector semiautomático está disponible en embalajes que contienen 1 inyector y 12 agujas para inyección.
Título del responsable y del importador:
Ferring GmbH, Wittland 11, D-24109 Kiel, Alemania. Representante local del titular de la autorización de comercialización: Ferring Pharmaceutical Poland Sp. z o.o., ul. Szamocka 8, 01-748 Varsovia, Tel.: +48 22 246 06 80
Este medicamento está autorizado para su comercialización en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Bélgica, República Checa, Irlanda, Luxemburgo, Eslovaquia: Menotropina Ferring; Bulgaria, Croacia, Chipre, Dinamarca, Estonia, Finlandia, Grecia, Hungría, Islandia, Letonia, Lituania, Malta, Noruega, Polonia, Portugal, Rumania, Eslovenia, España, Suecia: Menopur; Alemania: Menogon HP; Italia: Meropur; Fecha de la última actualización de la hoja de instrucciones:julio 2024; Para uso interno - Interno
Instrucciones de uso
Menotropinum, solución inyectable

Antes de la primera inyección, un profesional de la salud (médico, enfermera o farmacéutico) debe demostrar cómo preparar y administrar correctamente el medicamento MENOPUR. Debe leer esta instrucción completa antes de usar el inyector MENOPUR y cada vez que reciba un nuevo inyector. Puede haber nueva información. Debe seguir esta instrucción al pie de la letra, incluso si ha usado un inyector similar en el pasado. Un uso incorrecto del inyector puede causar la administración de una dosis incorrecta del medicamento. En caso de tener alguna pregunta sobre la inyección de MENOPUR, debe comunicarse con un profesional de la salud. El inyector MENOPUR es un inyector de dosis ajustable que permite administrar más de 1 dosis del medicamento MENOPUR. Los números visibles en la ventana de dosis corresponden a la cantidad de unidades internacionales (UI) del medicamento MENOPUR. Hay 2 versiones diferentes del inyector con diferentes concentraciones:
- 600 UI
- 1200 UI
Inyector semiautomático MENOPUR y sus componentes
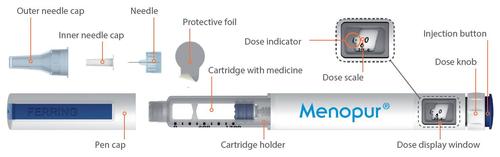
Instrucciones de uso - Inyector semiautomático MENOPUR
Para uso interno - Interno
Información importante
- El inyector MENOPUR y las agujas están diseñados para uso individual y no deben prestarse a otros.
- El inyector debe usarse solo para la afección para la que ha sido recetado y según las indicaciones del médico.
- Las personas ciegas o con visión deficiente que no puedan leer la escala de dosis en la ventana de dosis no deben usar este inyector sin ayuda. Estas personas deben pedir ayuda a alguien con buena visión que haya sido capacitado en el uso del inyector.
Información sobre el inyector MENOPUR
El inyector permite ajustar dosis desde 6,25 UI hasta 450 UI del medicamento MENOPUR, en incrementos de dosis de 6,25 UI. La escala de dosis del inyector tiene una graduación numérica desde 0 hasta 450 UI.
- La ventana de dosis del inyector muestra la dosis ajustada.
- Al pasar de un incremento de dosis con marca a otro sin marca, la dosis aumenta o disminuye en 6,25 UI, dependiendo de si se está aumentando o disminuyendo la dosis. Véase "Ejemplos que ilustran cómo ajustar la dosis" en la página 20 a 21.
- Al girar el botón de ajuste de dosis para ajustar la dosis, se escucha un clic y se siente una resistencia en el botón antes de cada aumento de dosis, lo que ayuda a ajustar la dosis correcta.
Limpieza
- Si es necesario, la superficie exterior del inyector se puede limpiar con un paño húmedo con agua.
- No sumergir el inyector en agua ni en ningún otro líquido.
Conservación
- No congelar.
- Antes de usar, conservar el inyector en el refrigerador a una temperatura de 2°C a 8°C.
- Después del primer uso, el inyector puede conservarse durante un máximo de 28 días a una temperatura inferior a 25°C.
- Siempre conservar el inyector con la cubierta puesta y sin la aguja puesta.
- No usar el inyector después de la fecha de caducidad (EXP) que figura en la etiqueta. La fecha de caducidad es el último día del mes indicado.
- No conservar el inyector en temperaturas extremas, ni en lugares expuestos a la luz solar directa o a temperaturas muy bajas, como en un automóvil o congelador. Conservar el inyector en un lugar inaccesible para los niños.
Materiales necesarios para la inyección de MENOPUR
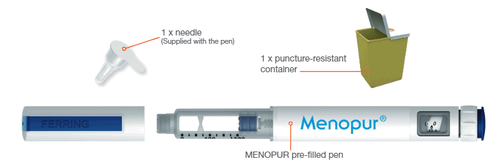
Para uso interno - Interno
Antes de usar - (Paso 1)
1.
- Lavar las manos.
- Asegurarse de que se está usando un inyector con la concentración correcta del medicamento.
- Verificar la fecha de caducidad en la etiqueta del inyector.
Poner la aguja - (Pasos del 2 al 6)
Importante:
- Debe poner una aguja nueva para cada inyección.
- Use solo agujas de un solo uso con un mecanismo de fijación de aguja que vengan con el inyector.

Después de abrir:
2.
- Quitar la cubierta del inyector.
- Verificar que el inyector no esté dañado.
- Verificar que la solución sea transparente y no contenga partículas sólidas no disueltas.
- No usar el inyector si está dañado, contiene partículas sólidas en el cartucho o la solución es turbia.
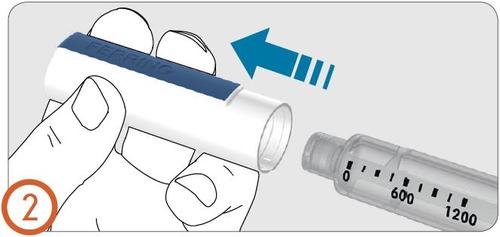
3.
- Quitar el forro protector de la aguja.
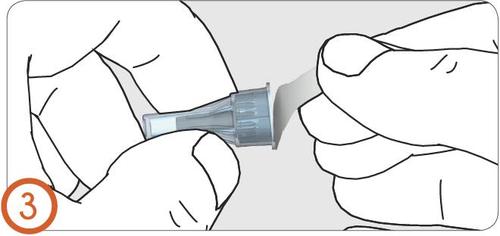
4.
Para uso interno - Interno
- Empujar la aguja en el inyector.
- Debe escucharse o sentirse un clic cuando la aguja se fije correctamente.
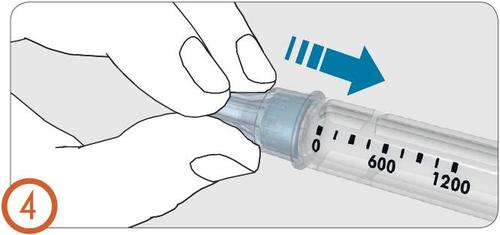
5.
- Quitar la cubierta exterior de la aguja.
- Notirar la cubierta exterior de la aguja. Se necesitará para quitar y tirar la aguja después de la inyección.
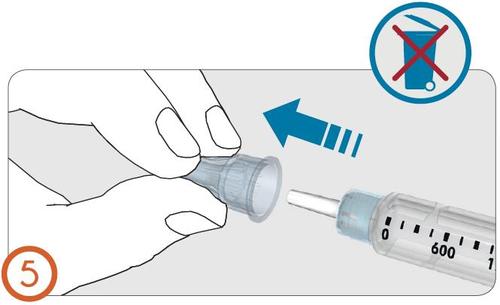
6.
- Quitar y tirar la cubierta interior de la aguja.
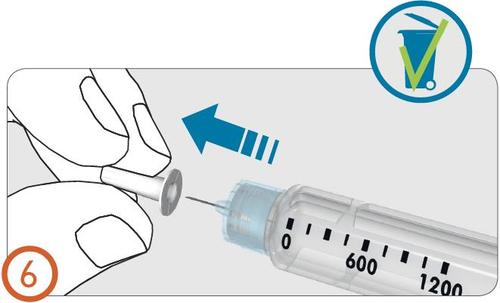
Eliminación de burbujas de aire - (Pasos del 7 al 9)
- Antes de usar el inyector por primera vez, debe eliminar las burbujas de aire del cartucho para asegurarse de que se pueda ajustar la dosis correctamente.
- La eliminación de burbujas de aire solo se realiza antes del primer uso del inyector.
- Debe realizar los pasos del 7 al 9, incluso si no ve burbujas de aire.
- Si el inyector ya se ha usado anteriormente, puede pasar directamente al paso 10.
7.
- Girar el botón de ajuste de dosis en el sentido de las agujas del reloj hasta que el símbolo de la gota se alinee con el indicador de dosis.
- Si se ajusta una dosis incorrecta para la eliminación de burbujas de aire, se puede corregir la dosis hacia arriba o hacia abajo sin perder medicamento, girando el botón de ajuste de dosis en cualquier dirección hasta que el símbolo de la gota se alinee con el indicador de dosis.
Para uso interno - Interno
Indicador de dosis
Símbolo de la gota
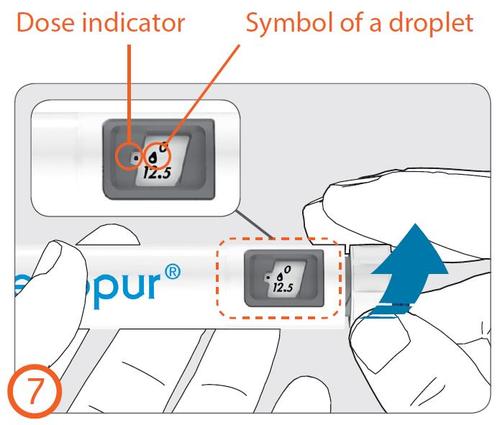
Indicador de dosis
Símbolo de la gota
8.
- Sostener el inyector en posición vertical con la aguja hacia arriba.
- Golpear suavemente el cartucho con el dedo para que cualquier burbuja de aire en el cartucho se mueva hacia la parte superior del cartucho.
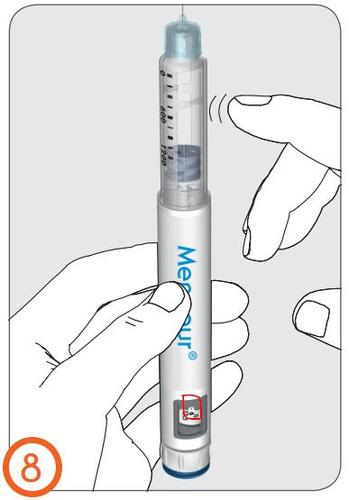
9.
- Sostener el inyector con la aguja todavía hacia arriba (lejos de la cara), presionar completamente el botón de inyección hasta que el número "0" se alinee con el indicador de dosis. Verificar que haya una gota de líquido en la punta de la aguja.
Para uso interno - Interno
- Si no aparece una gota, repetir los pasos del 7 al 9 (eliminación de burbujas de aire), hasta que aparezca una gota.
- Si después de 5 intentos no aparece una gota, quitar la aguja (véase el paso 13), poner una aguja nueva (véase los pasos del 3 al 6) y repetir la eliminación de burbujas de aire (véase los pasos del 7 al 9).
- Si todavía no se ve una gota después de usar una aguja nueva, probar con un inyector nuevo.
Ajuste de la dosis - (Paso 10)
- Girar el botón de ajuste de dosis en el sentido de las agujas del reloj hasta que la dosis prescrita se alinee con el indicador de dosis en la ventana de dosis.
- La dosis se puede corregir, sin perder medicamento, aumentándola o disminuyéndola, girando el botón de ajuste de dosis en cualquier dirección hasta que la dosis correcta se alinee con el indicador de dosis.
- No presionar el botón de inyección mientras se ajusta la dosis para evitar perder medicamento. Véase "Ejemplos que ilustran cómo ajustar la dosis" en la página 20 a 21.
División de la dosis:
- A veces es necesario usar más de 1 inyector para administrar la dosis completa prescrita.
- Si no es posible ajustar la dosis completa prescrita, significa que no queda suficiente medicamento en el inyector para administrar la dosis completa. Debe administrar la dosis restante del medicamento en el inyector y luego usar un nuevo inyector para administrar el resto de la dosis, o puede tirar (desechar) el inyector actual y usar un nuevo inyector para la inyección.
Véase "Administración de una dosis dividida de MENOPUR" en la página 22 a 23
Indicador de dosis
VENTANA DE DOSIS
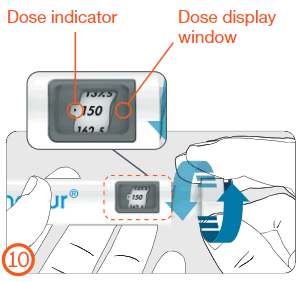
Para uso interno - Interno
donde se proporcionan ejemplos de cómo calcular y registrar una dosis dividida.
Administración de la dosis - (Pasos del 11 al 12)
Importante:
- Lea la descripción del paso 11 y 12 en las páginas 14 a 15 antes de administrar la inyección.
- El medicamento debe inyectarse justo debajo de la piel (inyección subcutánea) en el abdomen, en la zona del estómago.
- Cada inyección posterior debe administrarse en un lugar diferente para reducir el riesgo de reacciones en la piel, como enrojecimiento e irritación.
- No inyectar en un lugar que sea doloroso (sensible), magullado, enrojecido, endurecido, cicatrizado o con estrías.
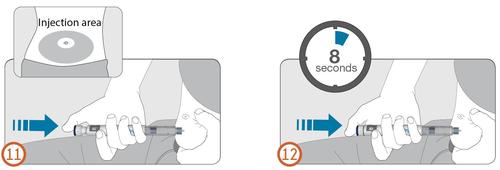
11.
- Sostener el inyector de manera que la ventana de dosis sea visible durante la inyección.
- Aguantar un pliegue de piel y insertar la aguja recta en la piel, como lo demostró el profesional de la salud. No presionar el botón de inyección todavía. (Véase la Figura 11).
- Colocar el pulgar en el botón de inyección.
- Presionar completamente el botón de inyección y mantenerlo presionado.
- Mantener el botón de inyección presionado y, cuando se vea el número "0" alineado con el indicador de dosis, esperar 8 segundos (contar lentamente hasta ocho) (Véase la Figura 12). De esta manera, se asegura que se ha administrado la dosis completa.
segundos
12.
- Después de mantener el botón de inyección presionado durante 8 segundos, soltar el botón de inyección. Luego, retirar la aguja lentamente del lugar de la inyección, sacándola recta de la piel.
- Si aparece sangre en el lugar de la inyección, presionar suavemente un trozo de gasa o una bola de algodón en el lugar de la inyección.
Nota:
- No inclinar el inyector mientras se administra la inyección y se retira la aguja de la piel.
- Inclinar el inyector puede causar que la aguja se doble o se separe.
- Si la aguja se separa y queda en el cuerpo o bajo la piel, debe buscar atención médica de inmediato.
Retirada de la aguja - (Paso 13)
13.
Para uso interno - Interno
- Poner cuidadosamente la cubierta exterior en la aguja, presionándola firmemente (Véase la Figura 13 A).
- Desenroscar la aguja, girándola en el sentido contrario a las agujas del reloj, para desconectarla del inyector (Véase la Figura 13 B y 13 C).
- Tirar la aguja usada con cuidado (Véase la Figura 13 D).
- Véase "Eliminación" en la página 18.
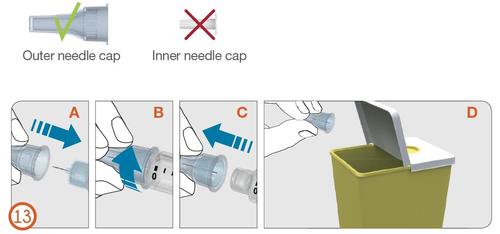
Cubierta exterior de la aguja
Cubierta interior de la aguja
Nota:
- Después de cada uso, siempre debe retirar la aguja. Las agujas están diseñadas para un solo uso.
- No conservar el inyector con la aguja puesta.
Poner la cubierta del inyector - (Paso 14)
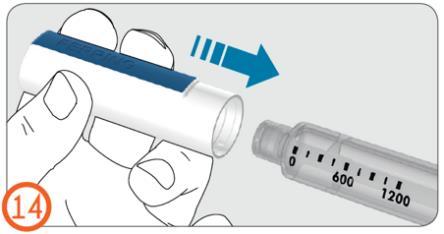
14.
- Poner firmemente la cubierta en el inyector para protegerlo durante el tiempo que no se esté usando.
Nota:
- La cubierta del inyector no cabe en la aguja.
- Cuando el inyector no se esté usando, debe estar protegido con la cubierta.
Eliminación
Agujas:
Las agujas usadas deben colocarse en un contenedor resistente a los pinchazos, como un contenedor para objetos punzocortantes, inmediatamente después de su uso. Para uso interno - Interno
Si no se dispone de un contenedor para objetos punzocortantes, se puede usar un contenedor que cumpla con todos los siguientes requisitos:
- está hecho de un material plástico resistente,
- puede cerrarse herméticamente con una tapa resistente a los pinchazos para evitar que los objetos punzocortantes caigan,
- se mantiene en posición vertical y estable durante su uso,
- es resistente a los derrames, y
- está debidamente etiquetado con una advertencia sobre los residuos peligrosos dentro del contenedor.
El contenedor para objetos punzocortantes debe tirarse cuando esté casi lleno. Debe preguntar a su médico, enfermera o farmacéutico cómo eliminar los residuos correctamente. No tire el contenedor lleno de objetos punzocortantes en la basura doméstica, a menos que las regulaciones locales lo permitan.
Inyectores MENOPUR:
- Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan.
En las siguientes páginas se pueden encontrar más información sobre los siguientes temas
:
- Ejemplos que ilustran cómo ajustar la dosis.................. página 20 a 21
- Administración de una dosis dividida de MENOPUR.................. página 22
- Dosis divididas .................................................. página 23
Y también:
- Preguntas más frecuentes……………........................... página 24
- Advertencias............................................................................ página 25
- Contacto.................................................................................. página 25
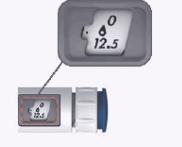
Ejemplos que ilustran cómo ajustar la dosis
Ejemplos que ilustran cómo ajustar la dosis en el inyector MENOPUR.
La tabla a la derecha muestra ejemplos de dosis prescritas, cómo ajustar las dosis prescritas y cómo se ve la ventana de dosis para las dosis prescritas.

Para uso interno - Interno





Administración de una dosis dividida de MENOPUR
Si no es posible ajustar la dosis completa prescrita en el inyector, significa que no queda suficiente medicamento en el inyector para administrar la dosis completa. Debe administrar la dosis restante del medicamento en el inyector y luego usar un nuevo inyector para administrar el resto de la dosis, o puede tirar (desechar) el inyector actual y usar un nuevo inyector para la inyección. Debe seguir las instrucciones que se presentan a continuación y registrar la dosis dividida, como se muestra en el diario de dosis divididas en la página 23.
- La columna A muestra ejemplos de dosis prescritas. Registre la dosis prescrita en la columna A.
- La columna B muestra ejemplos de dosis que quedan en el inyector (es igual a la dosis que se puede ajustar en el inyector).
- Registre la dosis que queda en el inyector en la columna B. Administre la inyección, utilizando el medicamento restante en el inyector.
- Prepare y elimine el aire del nuevo inyector (pasos del 1 al 9).
- Calcule y registre la dosis restante a administrar en la columna C, restando el valor de la columna B del valor de la columna A. Si es necesario, verifique los cálculos con una calculadora.
- Si es necesario, véase "Ejemplos que ilustran cómo ajustar la dosis" en la página 20 a 21.
- En caso de duda sobre el cálculo de la dosis dividida, debe comunicarse con un profesional de la salud.
- Administre la dosis restante del medicamento (valor de la columna C), utilizando el nuevo inyector, para completar la dosis prescrita.
Diario de dosis divididas
Preguntas más frecuentes
Para uso interno - Interno
- 1. Es necesario ventilar la jeringuilla antes de cada inyección?
- No. La ventilación solo debe realizarse antes de la primera inyección con una jeringuilla nueva.
- 2. Cómo se sabe que la inyección ha terminado?
- El botón de administración de la dosis está presionado hasta el final.
- El número "0" está establecido en la línea con el indicador de dosis.
- Se cuenta lentamente hasta 8 mientras se mantiene presionado el botón de administración de la dosis con la aguja aún insertada bajo la piel.
- 3. Por qué es necesario contar hasta 8 mientras se mantiene presionado el botón de administración de la dosis?
- Mantener presionado el botón de administración de la dosis durante 8 segundos permite la inyección de toda la dosis y su absorción bajo la piel.
- 4. Y si no se puede ajustar el selector de dosis a la dosis requerida?
- El cartucho en la jeringuilla puede no contener suficiente medicamento para administrar la dosis prescrita.
- La jeringuilla no permite ajustar una dosis mayor que la dosis que queda en el cartucho.
- Se puede inyectar el medicamento restante en la jeringuilla y completar la administración de la dosis prescrita con una nueva jeringuilla (dosis dividida) o usar una nueva jeringuilla para administrar la dosis prescrita completa.
- 5. Qué hacer si no tengo suficientes agujas?
- Si se necesitan agujas adicionales, debe comunicarse con el médico. Debe usar solo agujas suministradas con la jeringuilla MENOPUR o prescritas por el médico.
Advertencias
- No usar la jeringuilla que ha sido dejada caer o que ha golpeado una superficie dura.
- Si el botón de administración de la dosis no se puede presionar fácilmente, no debe forzarse. Debe cambiar la aguja. Si el botón de administración de la dosis sigue sin poder presionarse fácilmente después de cambiar la aguja, debe usar una nueva jeringuilla.
- No intentar reparar una jeringuilla dañada. Si la jeringuilla está dañada, debe comunicarse con un profesional de la salud o con el representante local de la entidad responsable.
Contacto
En caso de cualquier pregunta o problema relacionado con la jeringuilla, debe comunicarse
con un profesional de la salud o con el representante de la entidad responsable.
Representante local de la entidad responsable:
Ferring Pharmaceutical Poland Sp. z o.o.
ul. Szamocka 8
01-748 Varsovia
Tel.: + 48 22 246 06 80
Última actualización: marzo 2025
Para uso interno - Interno
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorFerring GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a MenopurForma farmacéutica: Polvo, 75 UI FSH + 75 UI LHPrincipio activo: human menopausal gonadotrophinFabricante: Ferring GmbHRequiere recetaForma farmacéutica: Polvo, 600 UI FSH + 600 UI LHPrincipio activo: human menopausal gonadotrophinRequiere recetaForma farmacéutica: Polvo, 1200 UI FSH + 1200 UI LHPrincipio activo: human menopausal gonadotrophinRequiere receta
Alternativas a Menopur en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Menopur en España
Alternativa a Menopur en Ucrania
Médicos online para Menopur
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Menopur – sujeta a valoración médica y normativa local.