Cómo usar Fastum
HOJA DE INSTRUCCIONES DEL PAQUETE: INFORMACIÓN PARA EL PACIENTE
Atención! Conservar la hoja de instrucciones, la información en el embalaje primario en idioma extranjero.
Fastum(Gel de Fastum)
25 mg/g, gel
Ketoprofeno
Fastum y Fastum Gel son diferentes nombres comerciales del mismo medicamento.
Es importante leer atentamente el contenido de la hoja de instrucciones antes de usar el medicamento porque contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a un médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Fastum y para qué se utiliza.
- 2. Información importante antes de usar Fastum.
- 3. Cómo usar Fastum.
- 4. Posibles efectos adversos.
- 5. Cómo almacenar Fastum.
- 6. Contenido del paquete y otra información.
1. Qué es Fastum y para qué se utiliza
Fastum es un medicamento del grupo de medicamentos antiinflamatorios no esteroideos (AINE) para uso tópico.
El ketoprofeno, principio activo de Fastum, se absorbe a través de la piel en las áreas inflamadas de las articulaciones, tendones, ligamentos y músculos. No se acumula en el organismo. El gel, gracias a su base de agua y alcohol, también tiene un efecto refrescante y calmante en la superficie. La base adecuada garantiza la liberación adecuada del ketoprofeno y un bajo riesgo de efectos adversos sistémicos. El medicamento es bien tolerado, incluso en caso de piel sensible.
Indicaciones
- Tratamiento tópico del dolor muscular y articular, por ejemplo, causado por lesiones (lesiones deportivas, lesiones de articulaciones con distensión de ligamentos sin luxación, lesiones de tendones y músculos debido a esfuerzo excesivo),
- Tratamiento tópico del dolor en la región lumbar en caso de discopatía.
2. Información importante antes de usar Fastum
Cuándo no usar Fastum
No use el medicamento si ha habido hipersensibilidad en el historial a ketoprofeno o a alguno de los demás componentes de Fastum, ácido tiaprofenico, ácido acetilsalicílico o otros AINE, fenofibrato, filtros UV o perfumes.
No se debe usar ketoprofeno en pacientes que han experimentado ataques de "asma aspirínica", erupciones o rinitis después de la administración de ácido acetilsalicílico y sus derivados.
El medicamento está contraindicado en personas con asma aspirínica en el historial o que han experimentado otras reacciones de hipersensibilidad.
Fastum no debe usarse en heridas abiertas ni en personas con erupciones, eccemas o lesiones cutáneas de origen desconocido.
Deje de usar el medicamento inmediatamente si aparecen reacciones cutáneas, incluyendo reacciones cutáneas después del uso simultáneo de productos que contienen octocrileno (el octocrileno es uno de los ingredientes auxiliares utilizados en varios cosméticos y productos de higiene personal, como champú, productos para después del afeitado, geles de ducha y baño, cremas para la piel, pomadas, cremas antiarrugas, productos para eliminar el maquillaje, lacas para el cabello, con el fin de retrasar la degradación bajo la influencia de la luz).
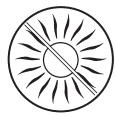
No exponga la piel tratada a la radiación solar (incluso cuando el cielo esté nublado) ni a la radiación UV en un solario, durante el tratamiento y 2 semanas después de dejar de usar el medicamento.
No se recomienda el uso de ketoprofeno en niños menores de 15 años, debido a la falta de estudios clínicos controlados sobre la eficacia y seguridad del medicamento. No use en mujeres desde el sexto mes de embarazo.
Precauciones y advertencias
La exposición a la luz solar (incluso cuando el cielo esté nublado) o a la radiación UVA en las áreas de la piel donde se ha aplicado Fastum puede causar reacciones cutáneas graves (hipersensibilidad a la luz solar). Por lo tanto, es necesario:
- proteger las áreas de la piel tratadas mediante la ropa durante el tratamiento y dos semanas después de dejar de usar el medicamento, para evitar el riesgo de hipersensibilidad a la luz solar
- lavarse las manos cuidadosamente después de cada aplicación del medicamento. El uso prolongado de medicamentos tópicos puede causar, en algunos pacientes, reacciones alérgicas o irritaciones locales. En caso de enrojecimiento, erupción, picazón o náuseas, debe dejar de usar el medicamento inmediatamente y consultar a un médico. No use el medicamento en heridas abiertas o cortes, y si aparecen cambios en la piel en el lugar de aplicación del gel, debe suspender el medicamento. Debe proteger los ojos y las membranas mucosas del contacto con el medicamento, no use bajo vendajes oclusivos. No use el medicamento por vía oral ni en grandes superficies del cuerpo. La administración tópica de grandes cantidades del medicamento puede causar efectos sistémicos, incluyendo reacciones de hipersensibilidad y asma. Debe usar el medicamento con precaución en pacientes con insuficiencia circulatoria, trastornos graves de la función renal o hepática, ya que se han descrito casos aislados de efectos adversos sistémicos. En pacientes con epilepsia en el historial, debe tener precaución al usar el producto, debido a la presencia de un ingrediente auxiliar en la composición del producto - un derivado de terpeno (aroma de lavanda). Después de aplicar el gel, debe lavarse las manos, a menos que sean las manos el lugar del tratamiento. Durante el uso prolongado, se recomienda el uso de guantes protectores. Debe suspender el tratamiento inmediatamente en caso de desarrollo de cualquier reacción cutánea después del uso de Fastum. El medicamento contiene alcohol, no use cerca del fuego. En pacientes con asma y rinitis crónica, sinusitis crónica y (o) pólipos nasales, el riesgo de reacción alérgica a la aspirina y (o) AINE es mayor que en el resto de la población.
Fastum y otros medicamentos
No se han descrito interacciones de Fastum con otros medicamentos. Sin embargo, debe tener precaución en pacientes que toman medicamentos anticoagulantes orales al mismo tiempo.
Embarazo
Antes de usar cualquier medicamento, debe consultar a un médico.
El uso de AINE durante el tercer trimestre del embarazo puede causar un efecto perjudicial en el corazón y los pulmones del feto. Los AINE pueden causar un retraso en el parto. Debe evitar el uso del medicamento en el primer y segundo trimestre del embarazo. No use en mujeres desde el tercer trimestre del embarazo.
Lactancia
Antes de usar cualquier medicamento, debe consultar a un médico.
El ketoprofeno pasa en pequeñas cantidades a la leche materna. No se recomienda la administración del medicamento a mujeres durante la lactancia.
Conducción de vehículos y uso de máquinas
No se ha descrito el efecto del medicamento en la capacidad para conducir vehículos o usar máquinas.
Fastum contiene aroma de naranja y aroma de lavanda.
Este medicamento contiene aromas con la composición: citral, citronelol, cumarina, farnesol, geraniol, d-limoneno y linalol, que pueden causar reacciones alérgicas.
3. Cómo usar Fastum
Fastum se usa 1 a 2 veces al día, debe aplicar una capa delgada de gel (una tira de gel de 3 cm a 5 cm de largo) en la piel en el área del lugar doloroso y masajear suavemente para facilitar la absorción. Si después de 7 días de uso del medicamento los síntomas no desaparecen, empeoran o aparecen nuevos síntomas, debe consultar a un médico.
No use Fastum en niños menores de 15 años.
Uso de una dosis mayor que la recomendada de Fastum
No se han registrado casos de sobredosis o intoxicación con Fastum.
En caso de ingesta accidental del gel, pueden aparecer: somnolencia, náuseas, vómitos. La ingesta de grandes cantidades puede causar depresión de la función respiratoria, coma, convulsiones, hemorragia gastrointestinal, aumento o disminución de la presión arterial, insuficiencia renal aguda. El médico aplicará las medidas y el tratamiento sintomáticos adecuados, generalmente utilizados en el tratamiento de intoxicaciones con AINE. Si han transcurrido menos de 1 hora desde la sobredosis, debe hacerse un lavado gástrico y tratamiento sintomático.
4. Posibles efectos adversos
Como cualquier medicamento, Fastum puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Las siguientes frecuencias de aparición suelen ser la base para la evaluación de los efectos adversos:
Muy frecuentes: más de 1 de cada 10 pacientes tratados;
Frecuentes: menos de 1 de cada 10 pero más de 1 de cada 100 pacientes tratados;
No muy frecuentes: menos de 1 de cada 100 pero más de 1 de cada 1.000 pacientes tratados;
Raros: menos de 1 de cada 1.000 pero más de 1 de cada 10.000 pacientes tratados;
Muy raros: menos de 1 de cada 10.000 pacientes tratados, desconocidos (no pueden estimarse a partir de los datos disponibles).
Se han observado casos de reacciones cutáneas locales que pueden extenderse más allá del lugar de aplicación del medicamento. Raramente se han producido casos de reacciones graves, como erupciones ampollares o pustulosas, que pueden extenderse o ser generalizadas.
Otros efectos adversos sistémicos (por ejemplo, relacionados con el sistema gastrointestinal o renal) causados por AINE se deben a la absorción del principio activo a través de la piel, por lo tanto, dependen de la cantidad de gel aplicado, la superficie de la piel tratada, el grado de absorción por el tejido, la duración del tratamiento y el posible uso de un vendaje oclusivo (hipersensibilidad, trastornos gastrointestinales y trastornos de la función renal).
Desde la comercialización del medicamento, se han observado los siguientes efectos adversos, que se presentan a continuación, agrupados por sistemas y frecuencia de aparición como: muy frecuentes (mayores o iguales al 10%), frecuentes (en el rango del 1% al 10%), no muy frecuentes (en el rango del 0,1% al 1%), raros (en el rango del 0,01% al 0,1%) o muy raros (por debajo del 0,01%) junto con casos aislados.
Trastornos del sistema inmunológico
Muy raros:
Trastornos gastrointestinales
Reacción anafiláctica, reacciones de hipersensibilidad
Muy raros:
Enfermedad ulcerosa del estómago y (o) duodeno, hemorragia gastrointestinal, diarrea
Trastornos de la piel y del tejido subcutáneo
No muy frecuentes:
Enrojecimiento, picazón, erupción, ardor
Raros:
Hipersensibilidad a la luz, erupción ampollar, urticaria
Muy raros:
Dermitis de contacto, edema angioneurótico
Trastornos renales y urinarios
Muy raros:
Insuficiencia renal o empeoramiento de los trastornos de la función renal
Los pacientes de edad avanzada están particularmente expuestos a efectos adversos después de la administración de AINE.
Si se agrava alguno de los efectos adversos o aparecen efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico.
Notificación de efectos adversos
Si aparecen efectos adversos, incluyendo cualquier efecto adverso no mencionado en la hoja de instrucciones, debe informar a su médico o farmacéutico, o enfermera.
Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos de la Agencia de Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas.
Ul. Jerozolimskie 181C
02-222 Varsovia
Tel.: +48 22 49 21 301
Fax: +48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización o al importador paralelo.
Gracias a la notificación de efectos adversos, podrá recopilarse más información sobre la seguridad del medicamento.
5. Cómo almacenar Fastum
No hay requisitos especiales para el almacenamiento.
Debe almacenar el medicamento en un lugar donde no sea visible y no esté al alcance de los niños.
No use este medicamento después de la fecha de caducidad que aparece en el embalaje. La fecha de caducidad es el último día del mes indicado. Periodo de validez después de la primera apertura
del embalaje: 6 meses.
No deseche los medicamentos por el desagüe ni en los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Fastum
- El principio activo del medicamento es: Ketoprofeno(ketoprofeno).
- Los demás componentes del medicamento son: carboxipolimetileno, etanol al 96%, trietanolamina, aroma de naranja (que contiene citral, citronelol, farnesol, geraniol, d-limoneno y linalol), aroma de lavanda (que contiene cumarina, geraniol, d-limoneno y linalol), agua purificada.
Cómo se presenta Fastum y qué contiene el embalaje
Tubo que contiene 20 g, 30 g, 50 g o 100 g de gel.
Para obtener información más detallada, debe consultar al titular de la autorización de comercialización o al importador paralelo.
Título de autorización de comercialización en Rumania, país de exportación:
- A. Menarini Industrie Farmaceutiche Riunite S.r.l. Via Sette Santi 3 50131 Florencia Italia
Fabricante
- A. Menarini Manufacturing Logistics and Services S.r.l. Via Sette Santi 3 50131 Florencia Italia
Importador paralelo:
Medezin Sp. z o.o.
ul. Zbąszyńska 3
91-342 Łódź
Reempaquetado por:
Medezin Sp. z o.o.
ul. Zbąszyńska 3
91-342 Łódź
CEFEA Sp. z o.o. Sp. komandytowa
ul. Działkowa 56
02-234 Varsovia
Pharma Innovations Sp. z o.o.
ul. Jagiellońska 76
03-301 Varsovia
SHIRAZ PRODUCTIONS Sp. z o.o.
ul. Tymiankowa 24/28
95-054 Ksawerów
CANPOLAND SPÓŁKA AKCYJNA
ul. Beskidzka 190
91-610 Łódź
Número de autorización de comercialización en Rumania, país de exportación:
8884/2016/01
8884/2016/02
8884/2016/04
8884/2016/03
Número de autorización de importación paralela: 320/22 Fecha de aprobación de la hoja de instrucciones: 25.08.2022
[Información sobre la marca registrada]
- País de registro
- Principio activo
- Requiere recetaSí
- Titular de la autorización de comercialización (TAC, MAH)A. Menarini Industrie Farmaceutiche Riunite S.r.l.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a FastumForma farmacéutica: Gel, 25 mg/gPrincipio activo: ketoprofenoRequiere recetaForma farmacéutica: Gel, 25 mg/gPrincipio activo: ketoprofenoRequiere recetaForma farmacéutica: Gel, 25 mg/gPrincipio activo: ketoprofenoRequiere receta
Alternativas a Fastum en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Fastum en Україна
Alternativa a Fastum en Іспанія
Médicos online para Fastum
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Fastum – sujeta a valoración médica y normativa local.