Cómo usar Cabazitaxel Medical Vallei
Hoja de instrucciones para el paciente: información para el usuario
Cabazitaxel Medical Valley
60 mg, concentrado y disolvente para preparar una solución para infusión
cabazytaksel
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Cabazitaxel Medical Valley y para qué se utiliza
- 2. Información importante antes de tomar Cabazitaxel Medical Valley
- 3. Cómo tomar Cabazitaxel Medical Valley
- 4. Posibles efectos adversos
- 5. Cómo conservar Cabazitaxel Medical Valley
- 6. Contenido del envase y otra información
1. Qué es Cabazitaxel Medical Valley y para qué se utiliza
El nombre común es kabazytaksel. Pertenece a un grupo de medicamentos llamados "taksanos", que se utilizan para tratar el cáncer.
Cabazitaxel Medical Valley se utiliza para tratar el cáncer de próstata (glándula prostática), cuando la enfermedad ha progresado después de una quimioterapia diferente. El medicamento actúa deteniendo el crecimiento y la división de las células.
La terapia también incluye la ingesta diaria de un corticosteroide (prednisona o prednisolona) por vía oral. Debe consultar a su médico para obtener información sobre este medicamento.
2. Información importante antes de tomar Cabazitaxel Medical Valley
Cuándo no debe tomar Cabazitaxel Medical Valley:
- Si el paciente es alérgico (hipersensible) a kabazytaksel, otros taksanos o polisorbato 80 o a cualquiera de los demás componentes del medicamento (enumerados en el punto 6),
- Si el paciente tiene un recuento de glóbulos blancos bajo (recuento de neutrófilos menor o igual a 1500/mm),
- Si el paciente tiene trastornos hepáticos graves,
- Si el paciente ha recibido recientemente o va a recibir una vacuna contra la fiebre amarilla.
No debe tomar Cabazitaxel Medical Valley si alguna de las condiciones anteriores se aplica al paciente. En caso de duda, debe consultar a su médico antes de tomar Cabazitaxel Medical Valley.
Advertencias y precauciones
Antes de cada administración de Cabazitaxel Medical Valley, se realizan análisis de sangre del paciente para verificar que el recuento de células sanguíneas y la función hepática y renal sean adecuados para la administración de Cabazitaxel Medical Valley.
Debe informar inmediatamente a su médico si:
- Se produce fiebre. Durante el tratamiento con Cabazitaxel Medical Valley, es probable que disminuya el recuento de glóbulos blancos. El médico examinará la sangre y monitoreará el estado general del paciente para detectar signos de infección. También puede prescribir otros medicamentos para mantener un recuento adecuado de glóbulos blancos. En pacientes con parámetros de morfología sanguínea bajos, pueden ocurrir infecciones que ponen en peligro la vida. El primer signo de infección puede ser la fiebre, por lo que si ocurre, debe informar inmediatamente a su médico.
- Ha habido reacciones alérgicas previas. Durante el tratamiento con Cabazitaxel Medical Valley, pueden ocurrir reacciones alérgicas graves.
- Se produce diarrea grave o prolongada, náuseas o vómitos. Todos estos síntomas pueden provocar deshidratación grave. También pueden requerir tratamiento.
- Se siente entumecimiento, hormigueo, ardor o disminución de la sensibilidad en las manos o los pies.
- Se produce sangrado gastrointestinal, cambio de color de las heces o dolor abdominal. Si el sangrado o el dolor son graves, el médico interrumpirá el tratamiento con Cabazitaxel Medical Valley. Esto se debe a que Cabazitaxel Medical Valley puede aumentar el riesgo de sangrado o perforación del intestino.
- Trastornos renales.
- Se produce ictericia (color amarillo de la piel y los ojos), orina oscura, náuseas intensas o vómitos, que pueden ser signos de enfermedad hepática.
- Aumento o disminución significativa del volumen de orina eliminado en 24 horas.
- Presencia de sangre en la orina.
Debe informar inmediatamente a su médico si alguna de las condiciones anteriores se aplica al paciente.
Su médico puede reducir la dosis de Cabazitaxel Medical Valley o interrumpir el tratamiento.
Debe informar a su médico, farmacéutico o enfermera sobre todos los medicamentos que el paciente está tomando actualmente o ha tomado recientemente, incluyendo aquellos que se venden sin receta. Esto se debe a que algunos medicamentos pueden afectar la acción de Cabazitaxel Medical Valley o Cabazitaxel Medical Valley puede afectar la acción de otros medicamentos.
Esto incluye los siguientes medicamentos:
- ketokonazol, rifampicina (medicamentos utilizados para tratar infecciones);
- carbamazepina, fenobarbital o fenitoína (medicamentos utilizados para tratar convulsiones);
- hierba de San Juan (Hypericum perforatum) (medicamento herbal para la depresión y otros estados);
- estatinas (como simvastatina, lovastatina, atorvastatina, rosuvastatina o pravastatina) (medicamentos para reducir los niveles de colesterol en la sangre);
- valsartán (medicamento utilizado para tratar la hipertensión);
- repaglinida (medicamento utilizado para tratar la diabetes).
Antes de someterse a vacunaciones, debe informar a su médico sobre la ingesta de Cabazitaxel Medical Valley.
Embarazo, lactancia y fertilidad
Cabazitaxel Medical Valley no está indicado para su uso en mujeres.
El paciente debe usar condones durante las relaciones sexuales si su pareja está embarazada o puede quedar embarazada. Cabazitaxel Medical Valley puede estar presente en el semen y puede afectar al feto. Los pacientes que toman Cabazitaxel Medical Valley no deben ser padres durante el período de 4 meses después de terminar el tratamiento y, antes de iniciar el tratamiento, deben consultar sobre la conservación de su semen, ya que Cabazitaxel Medical Valley puede alterar la fertilidad en los hombres.
Conducción de vehículos y uso de máquinas
Durante el tratamiento, puede aparecer somnolencia o mareo. En tal caso, no debe conducir vehículos ni operar máquinas ni utilizar herramientas hasta que estos síntomas desaparezcan.
Este medicamento contiene 573 mg de alcohol (etanol) en cada ampolla de disolvente. La cantidad de alcohol en la dosis de este medicamento es equivalente a menos de 11 ml de cerveza o 5 ml de vino. La pequeña cantidad de alcohol en este medicamento no debería tener efectos notables. Si el paciente es adicto al alcohol, tiene enfermedad hepática o epilepsia, debe consultar a su médico o farmacéutico antes de tomar este medicamento.
Los polisorbatos pueden afectar la circulación y la función cardíaca (por ejemplo, presión arterial baja, trastornos del ritmo cardíaco).
3. Cómo tomar Cabazitaxel Medical Valley
Instrucciones de uso
Antes de tomar Cabazitaxel Medical Valley, se administran medicamentos anti-alérgicos a los pacientes para reducir el riesgo de reacciones alérgicas.
- Cabazitaxel Medical Valley se administra por un médico o enfermera.
- Cabazitaxel Medical Valley debe ser adecuadamente preparado (reconstituido) antes de la administración. En esta hoja de instrucciones se encuentran instrucciones prácticas para médicos, enfermeras y farmacéuticos sobre el manejo de Cabazitaxel Medical Valley y su administración.
- Cabazitaxel Medical Valley se administra en el hospital en forma de goteo (infusión) que dura aproximadamente una hora, en una de las venas del paciente (administración intravenosa).
- La terapia también incluye la ingesta diaria de un corticosteroide (prednisona o prednisolona) por vía oral por parte del paciente.
Dosis y frecuencia de administración
- La dosis habitual depende del área de la superficie corporal del paciente. El médico calcula el área de la superficie corporal del paciente en metros cuadrados (m²) y, sobre esta base, determina el tamaño de la dosis a administrar.
- La infusión se realiza generalmente cada 3 semanas.
En caso de dudas adicionales sobre la administración del medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
El médico que lo atiende debe discutir con el paciente los posibles efectos adversos y explicar el riesgo y los beneficios potenciales del tratamiento.
Debe consultar inmediatamente a su médico si experimenta alguno de los siguientes efectos adversos:
- fiebre (temperatura corporal alta). Ocurre con frecuencia (puede afectar hasta 1 de cada 10 personas).
- pérdida grave de líquidos del organismo (deshidratación). Ocurre con frecuencia (puede afectar hasta 1 de cada 10 personas). La deshidratación puede ocurrir como resultado de diarrea grave o prolongada, fiebre o vómitos.
- dolor abdominal grave o dolor abdominal que no cede. Estos síntomas pueden ocurrir si el paciente tiene un estómago, esófago o intestino perforado (perforación del tracto gastrointestinal). Esto puede llevar a la muerte.
Debe informar inmediatamente a su médico si alguna de las condiciones anteriores se aplica al paciente.
Otros efectos adversos incluyen:
Muy frecuentes(puede afectar a más de 1 de cada 10 personas):
- disminución del recuento de glóbulos rojos (anemia) o glóbulos blancos (importantes para combatir infecciones)
- disminución del recuento de plaquetas (lo que aumenta el riesgo de sangrado)
- pérdida del apetito (anorexia)
- irritación del estómago, incluyendo náuseas, vómitos, diarrea o estreñimiento
- dolor de espalda
- presencia de sangre en la orina
- sensación de cansancio, debilidad o falta de energía.
Frecuentes(puede afectar hasta 1 de cada 10 personas):
- trastornos del gusto
- dificultad para respirar
- tos
- dolor abdominal
- pérdida temporal de cabello (en la mayoría de los casos, el crecimiento normal del cabello debería regresar)
- dolor en las articulaciones
- infección del tracto urinario
- falta de glóbulos blancos asociada con fiebre y infección
- sensación de entumecimiento, hormigueo, ardor o disminución de la sensibilidad en las manos y los pies
- mareo
- dolor de cabeza
- disminución o aumento de la presión arterial
- sensación de malestar en el estómago, acidez o reflujo
- dolor de estómago
- hemorroides
- calambres musculares
- dolor al orinar o frecuencia urinaria
- incontinencia urinaria
- enfermedad renal o trastornos de la función renal
- úlceras en la boca o labios
- infecciones o riesgo de infecciones
- aumento del nivel de azúcar en la sangre
- insomnio
- confusión
- ansiedad
- sensación anormal, pérdida de sensibilidad o dolor en las manos y los pies
- dificultad para mantener el equilibrio
- latido cardíaco rápido o irregular
- coágulo de sangre en las piernas o los pulmones
- enrojecimiento de la piel
- dolor de boca o garganta
- sangrado rectal
- malestar, debilidad o dolor muscular
- hinchazón de los pies o las piernas
- escalofríos
- trastornos de las uñas (cambio de color de las uñas; las uñas pueden desprenderse).
Poco frecuentes(puede afectar hasta 1 de cada 100 personas):
- disminución del nivel de potasio en la sangre
- zumbido en los oídos
- sensación de calor o enrojecimiento de la piel
- enrojecimiento de la piel
- infección del tracto urinario, que puede ocurrir si el paciente ha sido sometido previamente a radioterapia (infección del tracto urinario causada por la recurrencia de síntomas postradioterapia).
Frecuencia desconocida(no puede determinarse a partir de los datos disponibles):
- neumonía intersticial no infecciosa (inflamación del pulmón que causa tos y dificultad para respirar).
Notificación de efectos adversos
Si ocurren efectos adversos, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social, Paseo del Prado, 18-20, 28071 Madrid, Teléfono: +34 91 596 34 00, Fax: +34 91 596 34 01, Correo electrónico: [fv(@)agemed.es](mailto:[email protected]), Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Cabazitaxel Medical Valley
Debe conservar el medicamento en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe tomar este medicamento después de la fecha de caducidad que se indica en el envase y la etiqueta de la ampolla después de "Caducidad (EXP)". La fecha de caducidad es el último día del mes indicado.
Este medicamento no requiere condiciones especiales de conservación.
La información sobre las condiciones y el tiempo de conservación de Cabazitaxel Medical Valley después de la reconstitución y preparación para su uso se describe en el punto "INSTRUCCIONES PRÁCTICAS PARA PROFESIONALES SANITARIOS SOBRE LA PREPARACIÓN, ADMINISTRACIÓN Y MANEJO DEL MEDICAMENTO CABAZITAXEL MEDICAL VALLEY".
Debe eliminar cualquier residuo del medicamento o sus desechos según las regulaciones locales.
Esto ayudará a proteger el medio ambiente.
6. Contenido del envase y otra información
Qué contiene Cabazitaxel Medical Valley?
El principio activo es kabazytaksel. Un mililitro de concentrado contiene 40 mg de kabazytaksel.
Cada ampolla de concentrado contiene 60 mg de kabazytaksel.
Los demás componentes son: polisorbato 80 y ácido cítrico en el concentrado, y etanol al 96% y agua para inyección en el disolvente (véase el punto 2. "Cabazitaxel Medical Valley contiene alcohol").
Nota: tanto la ampolla de concentrado del medicamento Cabazitaxel Medical Valley 60 mg/1,5 ml (volumen de llenado: 73,2 mg de kabazytaksel/1,83 ml) como la ampolla de disolvente (volumen de llenado: 5,67 ml) contienen un exceso de líquido para compensar las pérdidas durante la preparación. Este exceso garantiza que, después de reconstituir con todo el disolvente suministrado, la solución resultante contenga 10 mg/ml de kabazytaksel.
Cómo se presenta Cabazitaxel Medical Valley y qué contiene el envase?
Cabazitaxel Medical Valley es un concentrado y disolvente para preparar una solución para infusión (concentrado estéril).
El concentrado es una solución oleosa transparente e incolora o ligeramente amarillenta.
El disolvente es una solución transparente e incolora.
Un envase de Cabazitaxel Medical Valley contiene:
- Una ampolla de un solo uso de vidrio incoloro (tipo I), cerrada con un tapón de goma de clorobutilo y un cierre de aluminio con una tapa de plástico tipo flip-off, que contiene 1,5 ml (volumen nominal) de concentrado.
- Una ampolla de un solo uso de vidrio incoloro (tipo I), cerrada con un tapón de goma de clorobutilo y un cierre de aluminio con una tapa de plástico tipo flip-off, que contiene 4,5 ml (volumen nominal) de disolvente.
Título de la autorización de comercialización
Medical Valley Invest AB
Brädgårdsvägen 28
236 32 Höllviken
Suecia
Importador
Pharmadox Healthcare Ltd.
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Fecha de la última revisión de la hoja de instrucciones: 13.09.2023
Información destinada exclusivamente a profesionales sanitarios.
INSTRUCCIONES PRÁCTICAS PARA PROFESIONALES SANITARIOS SOBRE LA PREPARACIÓN, ADMINISTRACIÓN Y MANEJO DEL MEDICAMENTO CABAZITAXEL MEDICAL VALLEY
La siguiente información complementa el punto 3 y 5 para el usuario.
Antes de preparar la solución para infusión, debe leer toda la descripción del procedimiento.
Incompatibilidades farmacéuticas
No mezclar este medicamento con otros medicamentos, excepto los utilizados para la dilución.
Periodo de validez y precauciones especiales de conservación
Para el envase del medicamento Cabazitaxel Medical Valley 60 mg, concentrado y disolvente
Después de la apertura
Las ampollas de concentrado y disolvente deben usarse inmediatamente después de la apertura. En caso contrario, el usuario es responsable del tiempo y las condiciones de conservación.
Desde el punto de vista microbiológico, el proceso de dilución en dos etapas del medicamento debe realizarse en condiciones controladas y asépticas (véase más adelante "Precauciones durante la preparación y la administración").
Después de la reconstitución inicialde la ampolla de concentrado del medicamento Cabazitaxel Medical Valley 60 mg utilizando todala ampolla de disolvente suministrada, se ha demostrado la estabilidad física y química durante 1 hora a temperatura ambiente.
Después de la dilución final en una bolsa y/o botella para infusión
Se ha demostrado la estabilidad química y física de la solución para infusión durante 8 horas a temperatura ambiente (15°C-30°C), incluyendo el tiempo de infusión de 1 hora, y durante 48 horas en condiciones de refrigeración, incluyendo el tiempo de infusión de 1 hora.
Desde el punto de vista microbiológico, la solución para infusión debe usarse inmediatamente después de la preparación. En caso contrario, el usuario es responsable del tiempo y las condiciones de conservación y, generalmente, el tiempo de conservación no debe exceder las 24 horas a 2°C-8°C, si la dilución se realizó en condiciones asépticas controladas y validadas.
Precauciones durante la preparación y la administración
Al igual que con cualquier medicamento citotóxico, debe tener cuidado al manejar el medicamento Cabazitaxel Medical Valley y preparar sus soluciones, considerando el uso de equipos que limiten la exposición al medicamento, medidas de protección personal (por ejemplo, guantes) y procedimientos de preparación del medicamento para su uso.
En caso de contacto del medicamento Cabazitaxel Medical Valley con la piel en cualquier momento del manejo, debe lavar inmediatamente el área afectada con agua y jabón. En caso de contacto con la mucosa, el área afectada debe lavarse inmediatamente con agua.
Cabazitaxel Medical Valley debe prepararse y administrarse solo por personal capacitado en el manejo de sustancias citotóxicas. Las mujeres embarazadas del personal no deben tener contacto con el medicamento.
El concentrado para preparar la solución para infusión siempre debe reconstituirse con todala ampolla de disolvente suministrada antes de agregarla a la solución para infusión.
Pasos de preparación
Antes de mezclar y diluir, debe leer TODOeste punto. La preparación del medicamento Cabazitaxel Medical Valley antes de la administración requiere DOSetapas de dilución. Debe seguir las instrucciones que se indican a continuación.
Nota: tanto la ampolla de concentrado del medicamento Cabazitaxel Medical Valley 60 mg/1,5 ml (volumen de llenado: 73,2 mg de kabazytaksel/1,83 ml) como la ampolla de disolvente (volumen de llenado: 5,67 ml) contienen un exceso de líquido para compensar las pérdidas durante la preparación. Este exceso garantiza que, después de reconstituir con todala ampolla de disolvente suministrada, la solución resultante contenga 10 mg/ml de kabazytaksel.
El proceso de dilución en dos etapas descrito a continuación debe realizarse de manera aséptica para preparar la solución para infusión.
Paso 1: Reconstitución inicial del concentrado para preparar la solución para infusión utilizando el disolvente suministrado.
Paso 1.1
Debe examinar cuidadosamente la ampolla de concentrado y la ampolla de disolvente suministrada.
Las soluciones del concentrado y el disolvente deben ser transparentes y prácticamente libres de partículas.
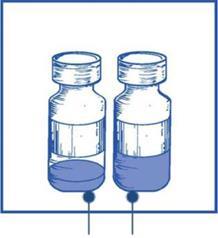
Paso 1.2
Utilizando una jeringa con aguja conectada, con mantenimiento de la esterilidad, debe extraer todala ampolla de disolvente suministrada, girando parcialmente la ampolla.
Ampolla de disolvente
Ampolla de concentrado
(60 mg - 1,5 ml)

Ampolla de disolvente
Paso 1.3
Debe inyectar todala ampolla de disolvente suministrada en la ampolla de concentrado correspondiente.
Para limitar la formación de espuma durante la inyección del disolvente, debe dirigir la aguja hacia la pared interna de la ampolla de concentrado y inyectar lentamente.
Después de la reconstitución inicial, la solución resultante contiene 10 mg/ml de kabazytaksel.
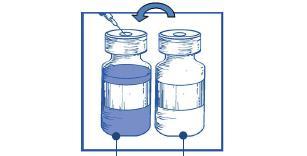
Mezcla de concentrado y disolvente
10 mg/ml
Ampolla de disolvente
Paso 1.4
Debe retirar la jeringa y la aguja, y mezclar suavemente con la mano durante varios giros para obtener una solución transparente y homogénea. Esto puede tardar alrededor de 45 segundos.
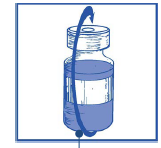
Mezcla de concentrado y disolvente 10 mg/ml
Paso 1.5
Debe dejar la solución durante unos 5 minutos y luego verificar que la solución sea homogénea y transparente.
La persistencia de espuma después de este tiempo es un fenómeno normal.
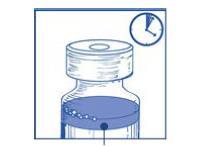
Mezcla de concentrado y disolvente 10 mg/ml
La mezcla resultante de concentrado y disolvente contiene 10 mg/ml de kabazytaksel (al menos 6 ml de volumen para administrar). La segunda dilución debe realizarse inmediatamente (dentro de 1 hora) según se describe en el punto Paso 2.
Puede ser necesario más de una ampolla de la mezcla de concentrado y disolvente para administrar la dosis prescrita.
Paso 2: Segunda (y última) dilución de la solución para infusión
Paso 2.1
Debe transferir, con mantenimiento de la esterilidad, el volumen requerido de la mezcla de concentrado y disolvente (10 mg/ml de kabazytaksel) utilizando una jeringa con graduación y aguja conectada. Por ejemplo, una dosis de 45 mg de Cabazitaxel Medical Valley requerirá la administración de 4,5 ml de la mezcla de concentrado y disolvente preparada según se describe en el punto Paso 1.
Al extraer, se recomienda colocar la aguja de la jeringa dentro, según se describe en el punto Paso 1, ya que la espuma puede persistir en las paredes de la ampolla de la solución.
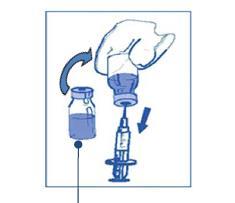
Mezcla de concentrado y disolvente 10 mg/ml
Paso 2.2
Debe inyectar en una bolsa estéril de material diferente al PVC, que contiene una solución al 5% de glucosa o una solución al 9 mg/ml (0,9%) de cloruro de sodio para infusión. La concentración de la solución para infusión debe ser de 0,10 mg/ml a 0,26 mg/ml.
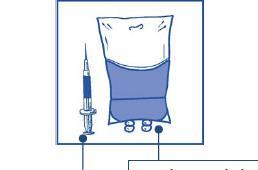
5% de solución de glucosa
o 9 mg/ml (0,9%)
de solución de cloruro de sodio para infusión
Cantidad requerida de la mezcla
de concentrado y disolvente
Paso 2.3
Debe retirar la jeringa y mezclar el contenido de la bolsa o botella para infusión agitando suavemente.

Paso 2.4
Al igual que con cualquier medicamento para administración parenteral, la solución para infusión resultante debe inspeccionarse antes de su uso. Dado que la solución para infusión es supersaturada, puede cristalizar con el tiempo. En tal caso, no debe usarse la solución para infusión y debe eliminarse.

La solución para infusión debe usarse inmediatamente después de la preparación. El tiempo de conservación de la solución para infusión preparada puede ser más largo en condiciones específicas descritas anteriormente en el punto “Periodo de validez y precauciones especiales de conservación”.
Debe eliminar cualquier residuo del medicamento o sus desechos según las regulaciones locales.
Método de administración
Cabazitaxel Medical Valley se administra en forma de infusión de 1 hora.
Se recomienda utilizar un filtro de 0,22 micras (también denominado 0,2 micras) en el conjunto de infusión durante la administración del medicamento.
No debe utilizarse bolsas de infusión de PVC o conjuntos de infusión de poliuretano para la preparación y administración del medicamento.
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorPharmadox Healthcare Ltd.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Cabazitaxel Medical ValleiForma farmacéutica: Concentrado, 10 mg/mlPrincipio activo: CabazitaxelRequiere recetaForma farmacéutica: Concentrado, 20 mg/mlPrincipio activo: CabazitaxelRequiere recetaForma farmacéutica: Concentrado, 20 mg/mlPrincipio activo: CabazitaxelFabricante: AqVida GmbHRequiere receta
Alternativas a Cabazitaxel Medical Vallei en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Cabazitaxel Medical Vallei en España
Alternativa a Cabazitaxel Medical Vallei en Ucrania
Médicos online para Cabazitaxel Medical Vallei
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Cabazitaxel Medical Vallei – sujeta a valoración médica y normativa local.