
FIBRYGA 1 g POWDER AND SOLVENT FOR INJECTABLE SOLUTION AND FOR INFUSION

How to use FIBRYGA 1 g POWDER AND SOLVENT FOR INJECTABLE SOLUTION AND FOR INFUSION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show translationContents of the leaflet
Introducción
Prospecto: información para el usuario
Fibryga 1g
Polvo y disolvente para solución inyectable y para perfusión
Fibrinógeno humano

Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Fibryga y para qué se utiliza
- Qué necesita saber antes de empezar a usar Fibryga
- Cómo usar Fibryga
- Posibles efectos adversos
- Conservación de Fibryga
- Contenido del envase e información adicional
1. Qué es Fibryga y para qué se utiliza
Fibryga contiene fibrinógeno humano, que es una proteína importante para la coagulación de la sangre. La falta de fibrinógeno significa que la sangre no coagula tan bien como debería, lo que conlleva una mayor tendencia a sangrar. La sustitución del fibrinógeno humano por Fibryga corregirá el defecto de coagulación.
Para qué se utiliza Fibryga
Fibryga sirve para:
- el tratamiento de episodios hemorrágicos y profilaxis para la cirugía en pacientes con una falta de fibrinógeno congénita (hipo o afibrinogenemia) con tendencia a las hemorragias.
- la suplementación de fibrinógeno en pacientes con hemorragias graves no controladas acompañadas de una falta de fibrinógeno adquirida durante la cirugía.
.
2. Qué necesita saber antes de empezar a usar Fibryga
No utilice Fibryga:
- si es alérgico al fibrinógeno humano o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- si ha experimentado reacciones alérgicas a Fibryga en el pasado.
Por favor, informe a su médico si es alérgico a algún medicamento.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar Fibryga.
Riesgo de coágulos en los vasos sanguíneos
Su médico debe valorar los beneficios de este medicamento frente al riesgo de coágulos en los vasos sanguíneos, en particular si:
- ha recibido una dosis alta o una dosis repetida de este medicamento
- ha tenido un ataque cardíaco (antecedentes de enfermedad coronaria del corazón o infarto de miocardio)
- padece una enfermedad hepática
- acaba de ser operado (pacientes posoperatorios)
- se va a operar (pacientes perioperatorios)
- en los recién nacidos (neonatos)
- es probable que sufra coágulos o problemas de coagulación en los vasos sanguíneos (pacientes con riesgo de acontecimientos tromboembólicos o coagulación intravascular diseminada).
Su médico puede pedirle que se haga análisis de coagulación adicionales para controlar el riesgo.
Reacciones alérgicas y de tipo anafiláctico
Cualquier medicamento, como Fibryga, que se prepara a partir de la sangre humana (que contiene proteínas) y que se inyecta en una vena (administrado por vía intravenosa) puede causar reacciones alérgicas. Si ha experimentado reacciones alérgicas a Fibryga en el pasado, su médico le aconsejará si es necesario tomar antialérgicos.
Su médico le explicará los signos de advertencia de las reacciones alérgicas o de tipo anafiláctico.
Por favor, preste atención a los primeros síntomas de las reacciones alérgicas (hipersensibilidad), como por ejemplo:
- sarpullido
- erupción cutánea
- opresión en el pecho
- sibilancias
- hipotensión,
- o anafilaxia (cuando alguno o todos los síntomas anteriores se desarrollan rápidamente y son intensos).
Si se producen, la inyección o perfusión de Fibryga deberá detenerse inmediatamente (es decir, interrumpir la inyección).
Seguridad vírica
Cuando los medicamentos se elaboran a partir de sangre o plasma humanos, se ponen en práctica ciertas medidas para evitar que las infecciones se transmitan a los pacientes. Estas incluyen:
- selección cuidadosa de los donantes de sangre y plasma para asegurarse de que se excluya a los que presentan riesgo de ser portadores de infecciones
- el análisis de cada donación y de las mezclas de plasma para detectar signos de virus o infecciones
- la inclusión de pasos en el procesamiento de la sangre o el plasma que pueden inactivar o eliminar los virus.
A pesar de estas medidas, cuando se administran medicamentos preparados a partir de sangre o plasma humanos, no se puede excluir totalmente la posibilidad de transmitir una infección. Esto también es válido para cualquier virus desconocido o emergente y otros tipos de infecciones.
Las medidas adoptadas se consideran eficaces para los virus encapsulados como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B y el virus de la hepatitis C, y para el virus no encapsulado de la hepatitis A. Las medidas adoptadas pueden tener un valor limitado contra los virus no encapsulados como el parvovirus B19.
La infección por parvovirus B19 puede ser grave en las mujeres embarazadas (infección del feto) y para los individuos cuyo sistema inmunológico está deprimido o que tienen algunos tipos de anemia (p. ej., anemia drepanocítica o descomposición anormal de los glóbulos rojos).
Se recomienda encarecidamente que cada vez que se reciba una dosis de Fibryga, se registre el nombre y el número de lote del producto para mantener un registro de los lotes utilizados.
Su médico puede recomendarle que considere la posibilidad de vacunarse contra la hepatitis A y B si recibe regular orepetidamente productos con fibrinógeno derivado del plasma humano.
Niños y adolescentes
No hay advertencias o precauciones específicas o adicionales aplicables a los niños y adolescentes.
Uso de Fibryga con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Fibryga no se debe mezclar con otros medicamentos, excepto los mencionados en la sección “Esta información está destinada únicamente a profesionales del sector sanitario / Reconstitución”.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. Este medicamento sólo debe utilizarse durante el embarazo o la lactancia después de consultar con su médico o farmacéutico.
Conducción y uso de máquinas
La influencia de Fibryga sobre la capacidad para conducir y utilizar máquinas es nula.
Fibryga contiene sodio
Este medicamento contiene 132 mg de sodio (componente principal de la sal de mesa/para cocinar) en cada frasco. Esto es equivalente al 6,6 % de la ingesta diaria máxima de sodio recomendada para un adulto. Tenga esto en cuenta si está siguiendo una dieta pobre en sodio.
3. Cómo usar Fibryga
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
Fibryga se administra en forma de perfusión intravenosa (goteo en una vena) por el personal sanitario.
La dosis y la pauta posológica dependen de:
- su peso
- la gravedad de su enfermedad
- la ubicación de la hemorragia o
- la naturaleza de su operación y
- su estado de salud
Uso en niños y adolescentes
La administración de Fibryga en niños y adolescentes (por vía intravenosa) no difiere de la administración en adultos.
Si usa más Fibryga del que debe
Para evitar el riesgo de sobredosis, su médico realizará análisis de sangre regulares para medir su nivel de fibrinógeno.
En caso de sobredosis, el riesgo de coágulos anormales en los vasos sanguíneos puede aumentar.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
Forma de administración
Este medicamento debe ser inyectado o perfundido en las venas después de la reconstitución con el disolvente suministrado. Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Por favor, consulte a su médico inmediatamente:
- si se produce alguno de los efectos adversos
- si observa algún efecto adverso que no aparece en este prospecto
Los siguientes efectos adversos han sido comunicados para Fibryga y otros medicamentos de fibrinógeno (se desconoce la frecuencia de los efectos adversos enumerados):
- Reacciones alérgicas y de tipo anafiláctico: reacciones cutáneas tales como erupción cutánea o enrojecimiento de la piel (ver la sección 2 “Advertencias y precauciones”)
- Cardiovasculares: inflamación de las venas y formación de coágulos de sangre (ver la sección 2 “Advertencias y precauciones”)
- Aumento de la temperatura corporal
Si experimenta cualquiera de los síntomas anteriores, consulte a su médico lo antes posible.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Fibryga
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y la caja. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25 °C. No congelar. Conservar el frasco en el embalaje exterior para protegerlo de la luz.
El polvo debe ser disuelto sólo directamente antes de la inyección o perfusión. Se ha demostrado la estabilidad de la solución reconstituida durante 24 horas a temperatura ambiente (máx. 25 ºC). No obstante, para evitar la contaminación, la solución debe utilizarse inmediatamente y sólo en una ocasión. El producto reconstituido no se debe conservar en nevera o congelador.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Fibryga
- El principio activo es fibrinógeno humano.
- Fibryga contiene 1 g de fibrinógeno humano por frasco o 20 mg/ml de fibrinógeno humano después de la reconstitución con el disolvente suministrado (50 ml de agua para preparaciones inyectables).
- Los demás componentes son hidrocloruro de L-arginina, glicina, cloruro de sodio y citrato de sodio dihidrato.
Aspecto del producto y contenido del envase
Fibryga se presenta como polvo y disolvente para solución inyectable y para perfusión, y está disponible en frascos de vidrio.
El polvo es blanco o amarillo pálido e higroscópico, con aspecto también de masa friable.
El disolvente es un líquido transparente e incoloro.
La solución reconstituida es prácticamente incolora y ligeramente opalescente.
Fibryga se suministra en una caja que contiene:
- 1 frasco con el polvo para solución inyectable y para perfusión
- 1 vial con el disolvente (agua para preparaciones inyectables)
- 1 dispositivo de transferencia nextaro
Titular de la autorización de comercialización
Octapharma, S.A.
Av. Castilla, 2 (P.E. San Fernando)
Ed. Dublín - 2ª Planta
28830 San Fernando de Henares
Madrid
Responsable de la fabricación
Octapharma Pharmazeutika Produktionsges.m.b.H.,
Oberlaaer Strasse 235, 1100 Vienna, Austria
ó
Octapharma AB,
Lars Forssells gata 23, 112 75 Stockholm, Suecia
ó
Octapharma GmbH
Elisabeth-Selbert-Str. 11, 40764 Langenfeld, Alemania
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) con los siguientes nombres:
Fibryga®: Alemania, Austria, Bélgica, Bulgaria, Chipre, Croacia, Dinamarca, Eslovaquia, España, Estonia, Finlandia, Francia, Hungría, Irlanda, Islandia, Italia, Letonia, Lituania, Luxemburgo, Malta, Noruega, Países Bajos, Polonia, Portugal, Reino Unido (Irlanda del Norte), República Checa, Rumania, Suecia,
Fibrema®: Eslovenia
Fecha de la última revisión de este prospecto: 11/2023
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/).
Esta información está destinada únicamente a profesionales del sector sanitario:
Posología
La dosis y la duración del tratamiento de sustitución dependen de la gravedad del trastorno, así como de la localización y alcance de las hemorragias y del estado clínico del paciente.
El nivel de fibrinógeno (funcional) debe determinarse para calcular la dosis individual, y la cantidad y la frecuencia de la administración deben determinarse en cada paciente mediante la medición regular del nivel plasmático de fibrinógeno y la monitorización continua del estado clínico del paciente y de otros tratamientos de sustitución utilizados.
En el caso de intervenciones de cirugía mayor, es esencial la monitorización precisa del tratamiento de sustitución mediante análisis de coagulación.
- Profilaxis en pacientes con hipo o afibrinogenemia congénita y tendencia al sangrado conocida.
Para prevenir el sangrado excesivo durante los procedimientos quirúrgicos, se recomienda el tratamiento profiláctico para elevar los niveles de fibrinógeno a 1 g/l y mantener el fibrinógeno a este nivel hasta que la hemostasia esté asegurada y por encima de 0,5 g/l hasta que la cicatrización de la herida sea completa.
En caso de procedimiento quirúrgico o tratamiento de un episodio hemorrágico, la dosis debe ser calculada de la siguiente manera:
Dosis (mg/kg de peso corporal) = [Nivel objetivo (g/l) - nivel medido (g/l)]
0,018 (g/l por mg/kg de peso corporal)
La posología posterior (dosis y frecuencia de las inyecciones) debe adaptarse en función del estado clínico del paciente y de los resultados de laboratorio.
La semivida biológica del fibrinógeno es de 3-4 días. Por lo tanto, en ausencia de consumo, no suele ser necesario repetir el tratamiento con fibrinógeno humano. Dada la acumulación que se produce en caso de administración repetida para uso profiláctico, la dosis y la frecuencia deben determinarse de acuerdo con los objetivos terapéuticos del médico para cada paciente determinado.
Población pediátrica
En caso de procedimiento quirúrgico o tratamiento de un episodio hemorrágico, la dosis en adolescentes debe calcularse conforme a la fórmula descrita anteriormente para los adultos, mientras que la dosis en niños <12 años de edad debe calcularse de la siguiente manera:
Dosis (mg/kg de peso corporal) = [Nivel objetivo (g/l) – nivel medido (g/l)]
0,014 (g/l por mg/kg de peso corporal)
La posología posterior debe adaptarse en función del estado clínico del paciente y de los resultados de laboratorio.
Pacientes de edad avanzada
Los estudios clínicos con Fibryga no incluyeron pacientes de 65 años o más como para proporcionar pruebas concluyentes sobre si estos pacientes responden o no de manera diferente a los pacientes más jóvenes.
- Tratamiento de hemorragias
Hemorragia en pacientes con hipo o afibrinogenemia congénita
Los episodios hemorrágicos deben ser tratados conforme a las fórmulas anteriormente indicadas para adultos/adolescentes y niños, respectivamente hasta alcanzar un nivel de fibrinógeno en plasma objetivo recomendado de 1 g/l. Este nivel debe mantenerse hasta que la hemostasia esté asegurada.
Hemorragia en pacientes con deficiencia de fibrinógeno adquirida
Adultos
Generalmente se administran 1-2 g al inicio, con perfusiones posteriores según sea necesario. En caso de hemorragia grave, por ejemplo durante una cirugía mayor, pueden requerirse cantidades mayores (4-8 g) de fibrinógeno.
Población pediátrica
La dosis se debe determinar de acuerdo con el peso corporal y las necesidades clínica, aunque normalmente es de 20-30 mg/kg.
Instrucciones para la preparación y administración
Instrucciones generales
- La solución reconstituida debe ser prácticamente incolora y ligeramente opalescente. No use soluciones turbias o con sedimentos.
- Fibryga es válido únicamente para un solo uso. No reutilice ninguno de los componentes.
- Por motivos de seguridad microbiológica, la solución se debe administrar inmediatamente tras la reconstitución. Se ha demostrado la estabilidad química y física en condiciones de uso de la solución reconstituida durante 24 horas a temperatura ambiente (máx. 25 °C). Tras la reconstitución, no refrigere ni congele la solución de Fibryga.
Reconstitución
- Asegúrese de que el frasco de polvo (Fibryga) y el vial de disolvente están a temperatura ambiente. Esta temperatura se debe mantener durante la reconstitución. Si se usa un baño maría para calentar, se debe tener cuidado de evitar que el agua entre en contacto con los tapones de goma o con las cápsulas de cierre flip-off de los envases. La temperatura del agua no debe superar los +37 °C.
- Retire las cápsula de cierre flip-off del frasco de polvo (Fibryga) y del vial de disolvente para dejar a la vista la parte central del tapón de perfusión. Limpie los tapones de goma con una toallita con alcohol y deje que se sequen.
- Retire la tapa del envase del dispositivo de transferencia (nextaro) (Fig. 1). Para mantener la esterilidad, no extraiga el dispositivo de transferencia del blíster transparente. No toque el punzón.
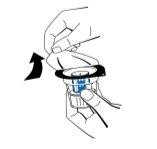

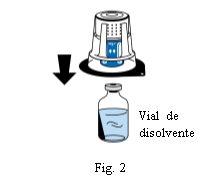
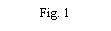 Coloque el vial de disolvente sobre una superficie plana y limpia y sujételo firmemente. Sin retirar el blíster, coloque la parte azul del dispositivo de transferencia sobre el vial de disolvente. Presione firmemente en línea recta hacia abajo hasta que encaje en posición (Fig. 2). No lo gire al acoplarlo.
Coloque el vial de disolvente sobre una superficie plana y limpia y sujételo firmemente. Sin retirar el blíster, coloque la parte azul del dispositivo de transferencia sobre el vial de disolvente. Presione firmemente en línea recta hacia abajo hasta que encaje en posición (Fig. 2). No lo gire al acoplarlo.
Nota:El dispositivo de transferencia se debe acoplar primero al vial de disolvente y después al frasco de polvo liofilizado.De lo contrario, se perderá el vacío y no tendrá lugar la transferencia del disolvente.
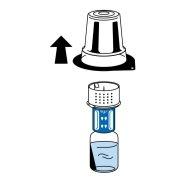
- Mientras sujeta el vial de disolvente, retire con cuidado el blíster del dispositivo de transferencia (nextaro) tirando de él hacia arriba en vertical. Asegúrese de dejar el dispositivo de transferencia acoplado firmemente al vial de disolvente (Fig. 3).

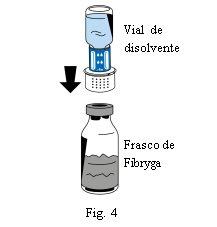
- Coloque el frasco de polvo (Fibryga) sobre una superficie plana y limpia y sujételo firmemente. Tome el vial de disolvente con el dispositivo de transferencia acoplado e inviértalo. Coloque la parte blanca del conector del dispositivo de transferencia sobre el frasco de polvo (Fibryga) y presione firmemente hacia abajo hasta que encaje en posición (Fig. 4). No lo gire al acoplarlo. El disolvente fluirá automáticamente al frasco de polvo (Fibryga).
- Con el vial de disolvente todavía acoplado, gire suavemente el frasco de Fibryga hasta que el polvo se disuelva completamente. Para evitar que se forme espuma, no agite el frasco. El polvo se debería disolver completamente en unos 5 minutos. El polvo no debería tardar más de 20 minutos en disolverse. Si no se disuelve en 20 minutos, se debe desechar el producto.
- En las raras ocasiones en las que se observe polvo sin reconstituir flotando durante la transferencia de agua para preparaciones inyectables o en las que el tiempo de reconstitución se prolongue inesperadamente, se puede favorecer el proceso de disolución agitando horizontalmente el vial de forma más enérgica.
- Una vez completada la reconstitución, desenrosque el dispositivo de transferencia (parte azul) en sentido contrario al de las agujas del reloj en dos partes (Fig. 5). No toque el conector Luer de la parte blanca del dispositivo de transferencia.
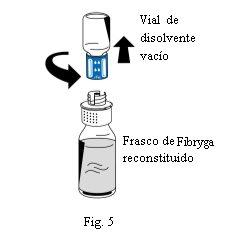
- Deseche el vial de disolvente vacío junto con la parte azul del dispositivo de transferencia.
Administración
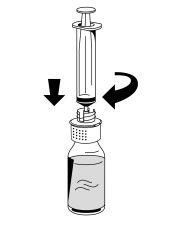
- Acople con cuidado una jeringa al conector Luer de la parte blanca del dispositivo de transferencia (Fig. 6).
- Invierta el frasco de Fibryga y extraiga la solución al interior de la jeringa (Fig. 7).
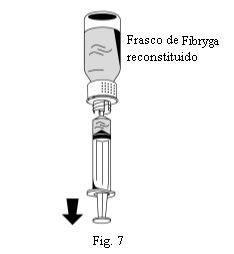

- Una vez transferida la solución, sujete firmemente el cuerpo de la jeringa (manteniendo el émbolo de la jeringa orientado hacia abajo) y retire la jeringa del dispositivo de transferencia (Fig. 8).
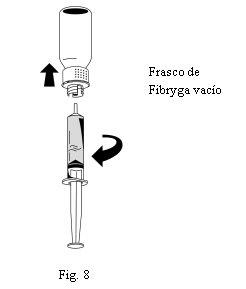
- Deseche la parte blanca del dispositivo de transferencia junto con el frasco de Fibryga vacío.
Se recomienda un equipo de perfusión estándar para la administración intravenosa de la solución reconstituida a temperatura ambiente.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Forma de administración
Perfusión o inyección intravenosa.
Fibryga se debe administrar lentamente por vía intravenosa a una velocidad máxima recomendada de 5 ml por minuto en pacientes con hipo o afibrinogenemia congénita, y a una velocidad máxima recomendada de 10 ml por minuto en pacientes con deficiencia de fibrinógeno adquirida.
Incompatibilidades
Este medicamento no debe mezclarse con otros.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to FIBRYGA 1 g POWDER AND SOLVENT FOR INJECTABLE SOLUTION AND FOR INFUSIONDosage form: INJECTABLE, 1.5 gActive substance: fibrinogen, humanPrescription requiredDosage form: INJECTABLE, 1 g (20 mg/mL)Active substance: fibrinogen, humanManufacturer: Csl Behring GmbhPrescription requiredDosage form: INJECTABLE, 1,000 IUActive substance: coagulation factor VIIIManufacturer: Takeda Manufacturing Austria AgPrescription required
Online doctors for FIBRYGA 1 g POWDER AND SOLVENT FOR INJECTABLE SOLUTION AND FOR INFUSION
Discuss questions about FIBRYGA 1 g POWDER AND SOLVENT FOR INJECTABLE SOLUTION AND FOR INFUSION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions















