
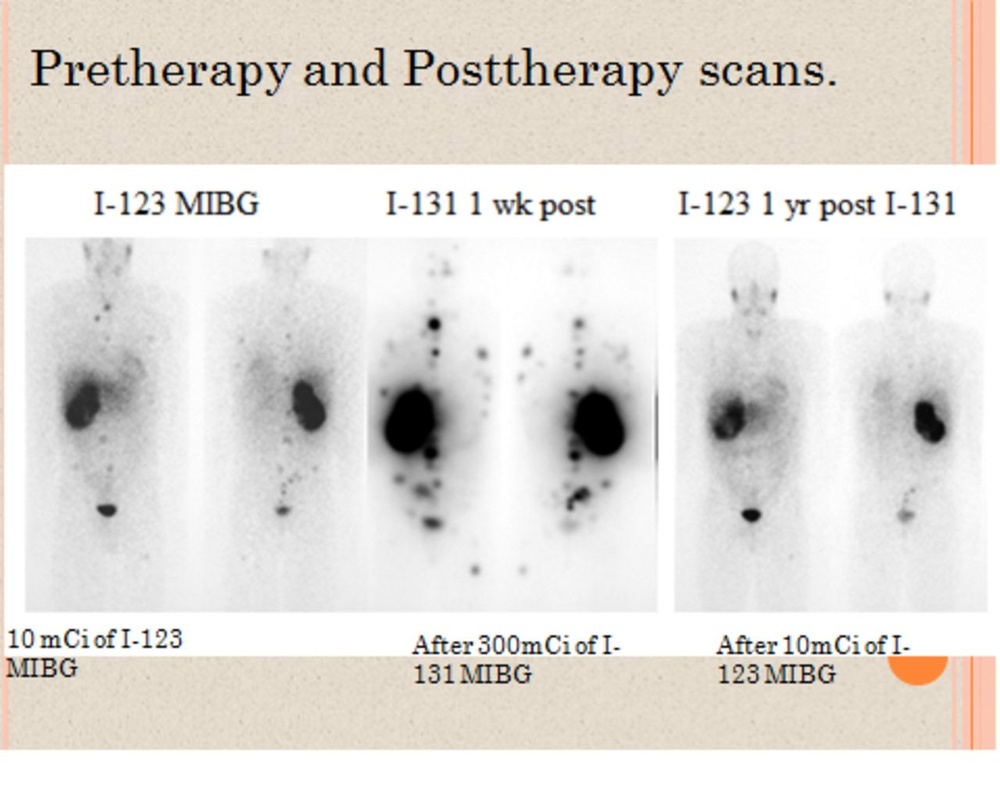
Метайодобензилогуанідина 131 І (мібг- 131 І) до терапіі

Запитайте лікаря про рецепт на Метайодобензилогуанідина 131 І (мібг- 131 І) до терапіі

Інструкція із застосування Метайодобензилогуанідина 131 І (мібг- 131 І) до терапіі
УPOSIT до пакування: інформація для користувача
Мета-йодобензилгуанідин- I (MIBG- I) для терапії,
- 370 – 740 МБк/мл, розчин для ін'єкцій
Джобенгуан (I)
Необхідно уважно ознайомитися з вмістом інструкції перед застосуванням препарату, оскільки вона містить важливу інформацію для пацієнта.
- Необхідно зберегти цю інструкцію, щоб у разі потреби мати можливість знову її прочитати.
- У разі виникнення будь-яких сумнівів необхідно звернутися до лікаря-спеціаліста ядерної медицини
- Якщо в пацієнта виникнуть будь-які побічні ефекти, включаючи всі можливі побічні ефекти, не перераховані в інструкції, необхідно повідомити про це лікаря-спеціаліста ядерної медицини. Див. пункт 4.
Зміст інструкції:
- 1. Що таке Мета-йодобензилгуанідин- I (MIBG- I) для терапії і для чого його застосовують
- 2. Інформація, важлива перед застосуванням Мета-йодобензилгуанідину- I (MIBG- I) для терапії
- 3. Як застосовувати препарат Мета-йодобензилгуанідин- I (MIBG- I) для терапії
- 4. Можливі побічні ефекти
- 5. Як зберігати препарат Мета-йодобензилгуанідин- I (MIBG- I) для терапії
- 6. Зміст пакування і інші інформації
1. ШО ТАКЕ МЕТА-ЙОДОБЕНЗИЛГУАНІДИН- I (MIBG- I) ДЛЯ ТЕРАПІЇ І
В ЯКІЙ МЕТІ ВІН ВИКОРИСТОВУЄТЬСЯ
Мета-йодобензилгуанідин- I (MIBG- I) для терапії є радіофармацевтичним препаратом, який містить
активну речовину, радіоактивний ізотоп йоду-131. Препарат вводиться внутрішньовенно в
дозах з різною радіоактивною активністю для терапевтичних цілей.
Йод [ I] є радіоізотопом короткоживучим, з періодом напіврозпаду 8,04 доби.
Мета-йодобензилгуанідин- I (MIBG- I) для терапії є радіофармацевтичним препаратом, який застосовується в
терапії пухлин. Терапевтично MIBG- I застосовується для лікування розсіяних метастатичних уражень злоякісної форми феохромоцитома, параґангліома, нейробластома,
раковіаки та іноді рак щитоподібної залози.
2. ІНФОРМАЦІЯ, ВАЖЛИВА ПЕРЕД ЗАСТОСОВАННЯМ
МЕТА-ЙОДОБЕНЗИЛГУАНІДИН- I (MIBG- I) ДЛЯ ТЕРАПІЇ
Коли не застосовувати мета-йодобензилгуанідин- I (MIBG- I) для терапії?
Якщо пацієнт має алергію на джобенгуан (I)або будь-який з інших компонентів цього препарату
(перелічених в пункті 6).
Абсолютна протипоказання до застосування препарату є:
- гіперчутливість до активної речовини або до будь-якої з допоміжних речовин,
- підтверджена, підозрювана або не виключена вагітність,
- грудне вигодовування,
- короткий очікуваний час виживання пацієнта (менше 3 місяців), крім хворих з
пухлинним болем кісток, який не піддається іншому лікуванню,
- нephропатія, яка вимагає діалізотерапії.
Відносна протипоказання є:
- швидко прогресуюча нephropatія,
- прогресуюче ушкодження кісткового мозку і/або порушення функції нирок внаслідок попереднього лікування,
- ушкодження тканини кісткового мозку,
- неакцептоване медичне ризик, пов'язане з необхідністю ізоляції хворого,
- важкі випадки недержання сечі.
Продукт містить бензиловий спирт: 10 мг/мл, тому його не можна вводити передчасно народженим чи новонародженим.
Попередження та заходи обережності
Через ризик радіаційного забруднення необхідно дотримуватися обережності під час лікування
йодом-131 у осіб:
- які можуть не підкорятися рекомендаціям медичного персоналу,
- із недержанням сечі.
Деякі пацієнти, які отримують великі активності ізотопу йоду-131, повинні бути госпіталізовані з
огляду на необхідність дотримання правил радіологічного захисту.
Введення препаратів, які містять радіоактивні ізотопи, створює ризик радіаційного впливу на інших осіб
або забруднення, спричинене плямами сечі, блювотою тощо. Через це необхідно дотримуватися основних правил гігієни.
Для зменшення дози радіаційного опромінення, що поглинається сечовим міхуром, рекомендується після
введення препарату пити трохи більше ніж зазвичай рідини (близько 1-1,5 літра на добу більше) і
частіше спорожнювати сечовий міхур.
Препарат Мета-йодобензилгуанідин- I (MIBG- I) для терапії та інші препарати
Необхідно повідомити лікаря про всі препарати, які приймає пацієнт зараз або
останнєчасно, а також про препарати, які пацієнт планує приймати.
На подовження ретенції або зниження всмоктування джобенгуану можуть впливати наступні препарати:
- Ніфедипін (блокатор кальцієвих каналів) - спричиняє подовження ретенції джобенгуану
Зниження всмоктування можуть спричиняти:
- препарати для лікування гіпертонії: резерпін, лабеталол, блокатори кальцієвих каналів (дилтіазем, ніфедипін, верапаміл)
- препарати симпатикоміметичної дії (присутні в назальних препаратах, які звужують слизову оболонку, таких як фенілефрин, ефедрин або фенілпропаноламін)
- кокаїн
- тріпірольні антидепресанти, такі як амітріптилін і похідні, іміпрамін і похідні, доксепін, амоксапін і локсапін.
Гальмування накопичення джобенгуану можуть спричиняти:
- препарати для лікування гіпертонії, які діють шляхом блокади адренергічних нейронів (бетанідин, де-бризохін, бретилій і гуанетидин).
- антидепресанти, такі як мапротилін і тразодон.
Прийом цих препаратів необхідно припинити перед початком лікування.
Вище вказані чинники свідчать про те, що лікар повинен знати історію хвороби пацієнта
Мета-йодобензилгуанідин- I (MIBG- I) для терапії з їжею і питтям
Не рекомендується жодних особливих заходів обережності.
Вагітність і грудне вигодовування
Якщо пацієнтка вагітна або годує грудьми, підозрює, що може бути вагітною або планує
мати дитину, повинна проконсультуватися з лікарем перед застосуванням цього препарату.
Абсолютна протипоказання до застосування препарату є вагітність і грудне вигодовування
Перед прийняттям препарату необхідно повідомити лікаря-спеціаліста ядерної медицини якщо:
- у жінки існує підозра вагітності,
- не відбулася менструація у передбаченому терміні,
- жінка годує грудьми. У разі сумнівів необхідна консультація з лікарем-спеціалістом у галузі ядерної медицини, який контролює перебіг дослідження.
У разі необхідності введення радіофармацевтичних препаратів жінкам репродуктивного віку, необхідно
переконатися, що жінка не вагітна. Повинна діяти правило введення йоду-131 до
десятого дня після менструації, або після отримання негативного результату тесту на вагітність. Після лікування
рекомендується уникати вагітності протягом 1 року.
Необхідно припинити грудне вигодовування після введення першої дози радіофармацевтичного препарату через можливу загрозу для здоров'я дитини. Грудне вигодовування можна відновити, коли доза
радіаційного опромінення, яку дитина могла б отримати під час годування і під час контакту з матір'ю,
буде входити у встановлені законодавством норми.
Керування транспортними засобами і обслуговування машин
Не описано впливу на здатність керувати транспортними засобами і обслуговувати машини.
3. ЯК ЗАСТОСОВУВАТИ ПРЕПАРАТ МЕТА-ЙОДОБЕНЗИЛГУАНІДИН- I
(MIBG-I) ДЛЯ ТЕРАПІЇ
Цей препарат завжди повинен застосовуватися згідно з рекомендаціями лікаря. У разі сумнівів необхідно
звернутися до лікаря.
Рекомендована доза:
Мета-йодобензилгуанідин- I (MIBG- I) для терапії є препаратом для внутрішньовенного введення в
дозах з різною радіоактивною активністю.
У терапії пухлин при допомозі MIBG- I рекомендована одноразова доза становить близько
- 3,7 ГБк. Дозу терапії необхідно розбавити фізіологічним розчином до об'єму близько 50 мл і введення її внутрішньовенно протягом 1,5-2 годин. Рекомендована доза така ж для дорослих, як і для дітей. Активність радіофармацевтичного препарату, який вводиться пацієнтам, повинна завжди розглядатися у відношенні до його діагностичної та терапевтичної цінності.
Спосіб введення
Мета-йодобензилгуанідин- I (MIBG- I) для терапії є препаратом для внутрішньовенного введення під
контролем кваліфікованого медичного персоналу.
Під час введення препарату необхідно суворо дотримуватися правил безпеки роботи у умовах
радіаційного опромінення.
Застосування більшої ніж рекомендована дози препарату
Передозування майже неможливе, оскільки доза продукту, яка вводиться пацієнту, суворо контролюється
лікарем-спеціалістом ядерної медицини. Однак у разі передозування лікар застосує відповідне лікування.
У разі будь-яких сумнівів, пов'язаних з застосуванням препарату, необхідно звернутися до лікаря-спеціаліста ядерної медицини
Якщо препарат Мета-йодобензилгуанідин- I (MIBG- I) для терапії був введений помилково
Радіофармацевтичний препарат Мета-йодобензилгуанідин- I (MIBG- I) для терапії належить до препаратів,
які вводяться у умовах суворого контролю лікаря виключно в закладах ядерної медицини, кваліфікованим персоналом, тому ризик помилкового введення надзвичайно низький.
Препарат поставляється у дозах з відомою активністю, що полегшує лікареві контроль над дозою, яка повинна бути введена пацієнту. У разі, якщо відбулося введення надмірної кількості радіоактивної речовини, ризик радіаційного опромінення може бути зменшений шляхом введення більших кількостей рідини.
4. МОЖЛИВІ ПОБІЧНІ ЕФЕКТИ
Як і будь-який препарат, цей препарат може спричиняти побічні ефекти, хоча вони не виникнуть у кожного пацієнта.
Активність дози радіофармацевтичного препарату, який вводиться пацієнтам, повинна завжди розглядатися у відношенні до його діагностичної та терапевтичної цінності. Це стосується особливо терапевтичних доз, які можуть мати серйозні побічні ефекти.
Введення препарату може спричиняти: нудоту, блювоту, нападоподібне червоніння шкіри, радіаційне ураження, гіпо- або гіперфункцію щитоподібної залози, гальмування функції кісткового мозку, анемію, тромбоцитопенію (малопластинову хворобу), нейтропенію, лейкоз, вторинні злоякісні пухлини, підвищення чутливості до інфекцій.
У разі терапевтичних доз на перелічені вище безпечні побічні ефекти, які виникають унаслідок введення препарату, накладаються також ефекти, пов'язані з радіотоксичністю.
Експозиція радіаційному опроміненню може призвести до підвищення захворюваності на пухлини, або ж призвести до виникнення генетичних дефектів.
Зголошення побічних ефектів
Якщо виникнуть будь-які побічні ефекти, включаючи всі можливі побічні ефекти, не перераховані в інструкції, необхідно повідомити про це лікаря. Побічні ефекти можна zgолошувати безпосередньо до Департаменту моніторингу побічних ефектів лікарських засобів Міністерства охорони здоров'я
вул. Єрусалимські аллеї, 181С,
02-222 Варшава,
тел.: + 48 22 49 21 301,
факс: + 48 22 49 21 309,
e-mail: [email protected].
Побічні ефекти можна zgолошувати також відповідальній особі.
Дякуючи zgолошенню побічних ефектів можна буде зібрати більше інформації про безпеку застосування препарату.
5. ЯК ЗБЕРІГАТИ ПРЕПАРАТ МЕТА-ЙОДОБЕНЗИЛГУАНІДИН- I
(MIBG-I) ДЛЯ ТЕРАПІЇ
Препарат повинен зберігатися в місці, недоступному для дітей.
Пацієнт не буде мусити зберігати цей лікарський засіб.
Радіофармацевтичні препарати зберігаються виключно особами, уповноваженими на це, у відповідних клінічних умовах. Зберігання радіофармацевтичних препаратів здійснюється у спосіб, відповідний місцевим правилам щодо радіоактивних речовин.
Нижче наведена інформація призначена виключно для медичного персоналу.
Не застосовувати продукт після закінчення терміну придатності, вказаного на упаковці.
Препарат повинен зберігатися при температурі нижче -15°C у захисті, який забезпечує радіаційну безпеку згідно з правилами Закону про атомну енергію. Захищати від світла. Після розморозки зберігати 2 години при температурі нижче 25°C. Транспортування повинно здійснюватися у сухому льоду.
Діяти згідно з рекомендаціями щодо безпеки роботи у умовах радіаційного опромінення.
Мета-йодобензилгуанідин- I (MIBG- I) для терапії, розчин для ін'єкцій повинен бути введений у течение 4 днів від дати виробництва.
Невикористаний продукт або відходи матеріалів повинні бути видалені згідно з вимогами правил щодо радіоактивних матеріалів.
6. ЗМІСТ ПАКУВАННЯ І ІНШІ ІНФОРМАЦІЇ
Що містить препарат Мета-йодобензилгуанідин- I (MIBG- I) для терапії
- Активною речовиною препарату є сульфат мета-йодобензилгуанідину з активністю 370 - 740 МБк/мл.
- Інші компоненти препарату: сульфат міді(II) п'ятиводний, сульфат натрію, оцтовий натрій тригідрат, оцтова кислота, бензиловий спирт, хлорид натрію, вода для ін'єкцій
Як виглядає препарат Мета-йодобензилгуанідин- I (MIBG- I) для терапії і що містить упаковка
Розчин MIBG- I поставляється у скляних флаконах об'ємом 10 мл з можливістю багаторазового стерильного відбору.
Флакон закритий гумовою пробкою і алюмінієвою кришкою та розміщений у свинцевому захисному контейнері.
Зовнішня упаковка для транспортування - металева коробка з наповнювачем.
До кожного джерела додається сертифікат активності.
Відповідальна особа і виробник
Національний центр ядерних досліджень
вул. Андрія Солтана, 7
05-400 Отвоцьк
Тел: 22 718 07 00
Факс: 22 718 03 50
e-mail: [email protected]
Дата затвердження інструкції:
Повна характеристика лікарського засобу (ПХЛЗ) додається як окремий документ до
упаковки продукту, з метою надання працівникам охорони здоров'я додаткової, наукової та практичної інформації щодо застосування цього радіофармацевтичного препарату.
- Країна реєстрації
- Діючі речовини
- Потрібен рецептНі
- Виробник
- ІмпортерNarodowe Centrum Badań Jądrowych
- Інформація є довідковою і не є медичною порадою. Перед прийомом будь-яких препаратів обов'язково проконсультуйтеся з лікарем. Oladoctor не несе відповідальності за медичні рішення, прийняті на основі цього контенту.
- Альтернативи до Метайодобензилогуанідина 131 І (мібг- 131 І) до терапііФорма випуску: Капсули, 37 - 7400 МБкДіючі речовини: sodium iodide (131I)Виробник: Narodowe Centrum Badań JądrowychНе потрібен рецептФорма випуску: Розчин, Розчин натрію фосфату (32P) для ін'єкцій 37-370 МБк/млДіючі речовини: sodium phosphate (32P)Виробник: Narodowe Centrum Badań JądrowychНе потрібен рецептФорма випуску: Розчин, 37,5 МБк/млДіючі речовини: strontium (89Sr) chlorideВиробник: Narodowe Centrum Badań JądrowychНе потрібен рецепт
Аналоги Метайодобензилогуанідина 131 І (мібг- 131 І) до терапіі в інших країнах
Найкращі аналоги з тією самою діючою речовиною та терапевтичним ефектом.
Аналог Метайодобензилогуанідина 131 І (мібг- 131 І) до терапіі у Іспанія
Лікарі онлайн щодо Метайодобензилогуанідина 131 І (мібг- 131 І) до терапіі
Консультація щодо дозування, побічних ефектів, взаємодій, протипоказань та поновлення рецепта на Метайодобензилогуанідина 131 І (мібг- 131 І) до терапіі – за рішенням лікаря та згідно з місцевими правилами.














