
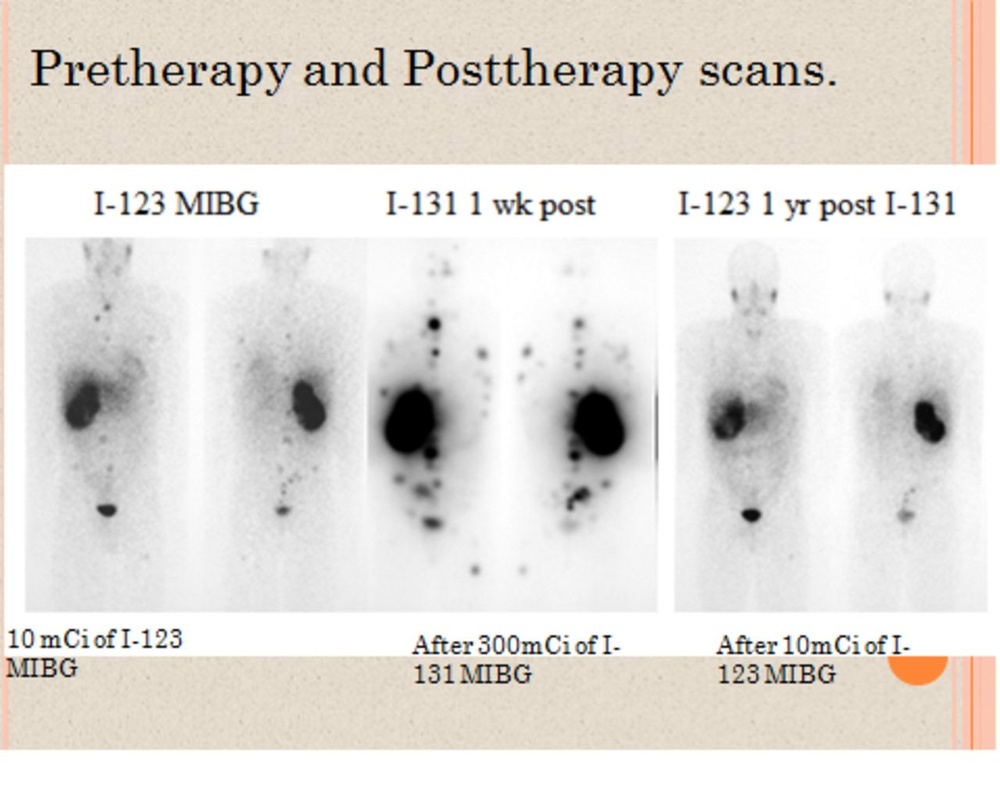
Метайодобензилогуанидина 131 И (мибг- 131 И) до терапии

Спросите врача о рецепте на Метайодобензилогуанидина 131 И (мибг- 131 И) до терапии

Инструкция по применению Метайодобензилогуанидина 131 И (мибг- 131 И) до терапии
Инструкция, прилагаемая к упаковке: информация для пользователя
Мета-йодобензилгуанидин- I (MIBG- I) для терапии,
- 370 – 740 МБк/мл, раствор для инъекций
Джобенгуан (I)
Необходимо внимательно ознакомиться с содержанием инструкции перед применением препарата, поскольку она содержит важную информацию для пациента.
- Необходимо сохранить эту инструкцию, чтобы в случае необходимости можно было ее повторно прочитать.
- В случае любых сомнений необходимо обратиться к врачу-специалисту ядерной медицины
- Если у пациента出现ят любые нежелательные симптомы, включая все возможные нежелательные симптомы, не перечисленные в инструкции, необходимо сообщить об этом врачу-специалисту ядерной медицины. См. пункт 4.
Содержание инструкции:
- 1. Что такое Мета-йодобензилгуанидин- I (MIBG- I) для терапии и для чего он используется
- 2. Важная информация перед применением Мета-йодобензилгуанидина- I (MIBG- I) для терапии
- 3. Как применять препарат Мета-йодобензилгуанидин- I (MIBG- I) для терапии
- 4. Возможные нежелательные реакции
- 5. Как хранить препарат Мета-йодобензилгуанидин- I (MIBG- I) для терапии
- 6. Содержание упаковки и другие сведения
1. ЧТО ТАКОЕ МЕТА-ЙОДОБЕНЗИЛГУАНИДИН- I (MIBG- I) ДЛЯ ТЕРАПИИ И
В КАКОМ ЦЕЛЮ ОН ПРИМЕНЯЕТСЯ
Мета-йодобензилгуанидин- I (MIBG- I) для терапии является радиофармацевтическим препаратом, содержащим радиоактивный изотоп йода-131. Препарат вводится внутривенно в дозах с различной радиоактивной активностью для терапевтических целей.
Йод-131 является радиоизотопом с коротким периодом полураспада, равным 8,04 дням.
Мета-йодобензилгуанидин- I (MIBG- I) для терапии является радиофармацевтическим препаратом, применяемым в терапии онкологических заболеваний. Терапевтически MIBG- I используется для лечения метастатических опухолей, включая злокачественные феохромоцитомы, параганглиомы, нейробластомы, раковые опухоли и иногда рак щитовидной железы.
2. ВАЖНАЯ ИНФОРМАЦИЯ ПЕРЕД ПРИМЕНЕНИЕМ
МЕТА-ЙОДОБЕНЗИЛГУАНИДИНА- I (MIBG- I) ДЛЯ ТЕРАПИИ
Когда не применять мета-йодобензилгуанидин- I (MIBG- I) для терапии?
Если пациент имеет аллергическую реакцию на джобенгуан (I)или любой другой компонент этого препарата (перечисленный в пункте 6).
Абсолютным противопоказанием к применению препарата является:
- чувствительность к активному веществу или к любому вспомогательному веществу,
- подтвержденная, предполагаемая или не исключенная беременность,
- грудное вскармливание,
- короткий ожидаемый срок жизни пациента (менее 3 месяцев), за исключением больных с
онкологическими болями костей, не поддающимися другому лечению,
- почечная недостаточность, требующая диализотерапии.
Относительным противопоказанием является:
- быстро прогрессирующая почечная недостаточность,
- прогрессирующее повреждение костного мозга и/или нарушение функции почек в результате предыдущего лечения,
- повреждение костного мозга,
- неакцептируемый медицинский риск, связанный с необходимостью изоляции больного,
- тяжелые случаи недержания мочи.
Продукт содержит бензиловый спирт: 10 мг/мл, поэтому его не следует применять у недоношенных детей или новорожденных.
Предостережения и меры предосторожности
В связи с риском радиационного заражения необходимо соблюдать осторожность при лечении радиоактивным йодом у лиц:
- которые могут не подчиняться рекомендациям медицинского персонала,
- с недержанием мочи.
Некоторые пациенты, получающие большие активности изотопа йода-131, могут быть госпитализированы в связи с необходимостью соблюдения правил радиологической защиты.
Применение препаратов, содержащих радиоактивные изотопы, создает риск воздействия на других лиц радиационного облучения или заражения, вызванного пятнами мочи, рвотой и т. д. Поэтому необходимо соблюдать основные правила гигиены.
Для снижения дозы радиации, поглощаемой мочевым пузырем, рекомендуется после применения препарата пить немного больше жидкости (около 1-1,5 литра в день больше) и чаще опорожнять мочевой пузырь.
Мета-йодобензилгуанидин- I (MIBG- I) для терапии и другие препараты
Необходимо сообщить врачу о всех препаратах, которые пациент принимает в настоящее время или принимал ранее, а также о препаратах, которые пациент планирует принимать.
На удлинение ретенции или снижение захвата джобенгуана могут влиять следующие препараты:
- Нифедипин (блокатор кальциевых каналов) - вызывает удлинение ретенции джобенгуана
Снижение захвата могут вызывать:
- противогипертензивные препараты: резерпин, лабеталол, блокаторы кальциевых каналов (дилтиазем, нифедипин, верапамил)
- симпатомиметические препараты (присутствующие в назальных препаратах, сужающих слизистую, таких как фенилэфрин, эфедрин или фенилпропаноламин)
- кокаин
- трехциклические антидепрессанты, такие как амитриптилин и его производные, имипрамин и его производные, доксепин, амоксапин и локсапин.
Торможение накопления джобенгуана могут вызывать:
- противогипертензивные препараты, действующие путем блокады адренергических нейронов (бетанидин, дебризохин, бретилиум и гуанетидин).
- антидепрессанты, такие как мапротилин и тразодон.
Применение этих препаратов должно быть прекращено перед началом лечения.
Вышеуказанные факторы указывают на то, что врач должен знать историю болезни пациента
Мета-йодобензилгуанидин- I (MIBG- I) для терапии с пищей и напитками
Не рекомендуются какие-либо особые меры предосторожности.
Беременность и грудное вскармливание
Если пациентка беременна или кормит грудью, предполагает, что может быть беременной или планирует иметь ребенка, она должна проконсультироваться с врачом перед применением этого препарата.
Абсолютным противопоказанием к применению препарата является беременность и грудное вскармливание
Прежде чем принять препарат, необходимо проинформировать врача-специалиста ядерной медицины, если:
- у женщины есть подозрение на беременность,
- не произошла менструация в预виденном сроке,
- женщина кормит грудью. В случае сомнений необходима консультация с врачом-специалистом в области ядерной медицины, контролирующим ход исследования.
В случае необходимости применения радиофармацевтических препаратов женщинам репродуктивного возраста необходимо убедиться, что женщина не беременна. Должно действовать правило применения йода-131 до десятого дня после менструации или после получения отрицательного результата теста на беременность. После лечения рекомендуется избегать беременности в течение 1 года.
Необходимо прекратить грудное вскармливание после применения первой дозы радиофармацевтического препарата из-за возможной угрозы для здоровья ребенка. Грудное вскармливание можно возобновить, когда доза радиации, которую ребенок мог бы получить во время кормления и при контакте с матерью, будет находиться в пределах, установленных законом.
Вождение транспортных средств и эксплуатация машин
Не было описано влияние на способность управлять транспортными средствами и эксплуатировать машины.
3. КАК ПРИМЕНЯТЬ ПРЕПАРАТ МЕТА-ЙОДОБЕНЗИЛГУАНИДИН- I
(MIBG-I) ДЛЯ ТЕРАПИИ
Этот препарат должен всегда применяться в соответствии с рекомендациями врача. В случае сомнений необходимо обратиться к врачу.
Рекомендуемая доза:
Мета-йодобензилгуанидин- I (MIBG- I) для терапии является препаратом для внутривенного введения в дозах с различной радиоактивной активностью.
В онкологической терапии с помощью MIBG- I рекомендованная однократная доза составляет примерно
- 3,7 ГБк. Дозу необходимо разбавить физиологическим раствором до объема примерно 50 мл и вводить внутривенно в течение 1,5-2 часов. Рекомендуемая доза одинакова для взрослых и детей. Радиоактивная активность радиофармацевтического препарата, вводимого пациентам, всегда должна рассматриваться в отношении его диагностической и терапевтической ценности.
Способ применения
Мета-йодобензилгуанидин- I (MIBG- I) для терапии является препаратом для внутривенного введения под контролем специализированного персонала.
При применении препарата необходимо строго соблюдать правила безопасности при работе с радиационным облучением.
Применение большей, чем рекомендованная, дозы препарата
Передозировка почти невозможна, поскольку доза препарата, вводимого пациенту, строго контролируется врачом-специалистом ядерной медицины. Однако в случае передозировки врач применил соответствующее лечение.
В случае любых сомнений, связанных с применением препарата, необходимо обратиться к врачу-специалисту ядерной медицины
Если препарат Мета-йодобензилгуанидин- I (MIBG- I) для терапии был применен ошибочно
Радиофармацевтический препарат Мета-йодобензилгуанидин- I (MIBG- I) для терапии относится к препаратам, применяемым в условиях строгого медицинского контроля только в учреждениях ядерной медицины, квалифицированным персоналом, поэтому риск ошибочного применения чрезвычайно низок.
Препарат поставляется в дозах с известной активностью, что позволяет врачу контролировать дозу, которая должна быть введена пациенту. В случае применения чрезмерной дозы радиоактивного вещества риск радиационного облучения может быть снижен путем применения большего количества жидкости.
4. ВОЗМОЖНЫЕ НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
Как и любой препарат, этот препарат может вызывать нежелательные реакции, хотя они не возникнут у каждого пациента.
Радиоактивная активность радиофармацевтического препарата, вводимого пациентам, всегда должна рассматриваться в отношении его диагностической и терапевтической ценности. Это особенно относится к терапевтическим дозам, которые могут давать серьезные побочные эффекты.
Применение препарата может вызывать: тошноту, рвоту, пароксизмальное покраснение кожи, радиационный ущерб, гипо- или гиперфункцию щитовидной железы, подавление функции костного мозга, анемию, тромбоцитопению (тромбопению), нейтропению, лейкоз, вторичные злокачественные опухоли, повышение восприимчивости к инфекциям.
В случае терапевтических доз на вышеперечисленные незначительные побочные эффекты, возникающие при применении препарата, накладываются эффекты, связанные с радиотоксичностью.
Воздействие радиации может привести к увеличению заболеваемости онкологическими заболеваниями или вызвать генетические дефекты.
Сообщение о нежелательных реакциях
Если возникнут любые нежелательные симптомы, включая все возможные нежелательные симптомы, не перечисленные в инструкции, необходимо сообщить об этом врачу. Нежелательные реакции можно сообщать trực tiếp в Департамент мониторинга нежелательных реакций лекарственных препаратов Управления регистрации лекарственных препаратов, медицинских изделий и биоцидных продуктов
Ал. Ерозолимских 181С,
02-222 Варшава,
тел.: + 48 22 49 21 301,
факс: + 48 22 49 21 309,
электронная почта: [email protected].
Нежелательные реакции также можно сообщать в уполномоченный орган.
Благодаря сообщению о нежелательных реакциях можно будет собрать больше информации о безопасности применения препарата.
5. КАК ХРАНИТЬ ПРЕПАРАТ МЕТА-ЙОДОБЕНЗИЛГУАНИДИН- I
(MIBG-I) ДЛЯ ТЕРАПИИ
Препарат должен храниться в месте, недоступном для детей.
Пациент не будет хранить этот лекарственный препарат.
Радиофармацевтические препараты хранятся только уполномоченными лицами в соответствующих клинических условиях. Хранение радиофармацевтических препаратов осуществляется в соответствии с местными правилами, касающимися радиоактивных веществ.
Нижеизложенная информация предназначена только для медицинского персонала.
Не применять препарат после истечения срока годности, указанного на упаковке.
Препарат должен храниться при температуре ниже -15°C в защитном контейнере, обеспечивающем радиационную безопасность в соответствии с правилами атомного законодательства. Защищать от света. После размораживания хранить 2 часа при температуре ниже 25°C. Транспортировка должна осуществляться в сухом льду.
Следовать рекомендациям по безопасности при работе с радиационным облучением.
Мета-йодобензилгуанидин- I (MIBG- I) для терапии, раствор для инъекций, должен быть применен в течение 4 дней после даты производства.
Неиспользованный препарат или отходы должны быть утилизированы в соответствии с требованиями правил, касающихся радиоактивных материалов.
6. СОДЕРЖАНИЕ УПАКОВКИ И ДРУГИЕ СВЕДЕНИЯ
ЧТО СОДЕРЖИТ ПРЕПАРАТ МЕТА-ЙОДОБЕНЗИЛГУАНИДИН- I (MIBG- I) ДЛЯ ТЕРАПИИ
- Активным веществом препарата является сульфат мета-йодобензилгуанидина с активностью 370-740 МБк/мл.
- Другими компонентами препарата являются: сульфит натрия, сульфат меди(II) пентагидрат, ацетат натрия тригидрат, уксусная кислота, бензиловый спирт, хлорид натрия, вода для инъекций
КАК ВЫГЛЯДИТ ПРЕПАРАТ МЕТА-ЙОДОБЕНЗИЛГУАНИДИН- I (MIBG- I) ДЛЯ ТЕРАПИИ И ЧТО СОДЕРЖИТ УПАКОВКА
Раствор MIBG- I поставляется в стеклянных флаконах объемом 10 мл с возможностью многократного стерильного забора.
Флакон закрыт резиновой пробкой и алюминиевой крышкой и помещен в свинцовый защитный контейнер.
Внешняя упаковка для транспортировки представляет собой металлическую банку с наполнителем.
К каждому источнику прилагается сертификат активности.
Уполномоченный орган и производитель
Национальный центр ядерных исследований
ул. Анджея Солтана 7
05-400 Отвоцк
Тел: 22 718 07 00
Факс: 22 718 03 50
электронная почта: [email protected]
Дата утверждения инструкции:
Полная характеристика лекарственного препарата (ПХЛП) прилагается как отдельный документ к упаковке препарата, чтобы предоставить работникам здравоохранения дополнительную научную и практическую информацию о применении и использовании этого радиофармацевтического препарата.
- Страна регистрации
- Активное вещество
- Требуется рецептНет
- Производитель
- ИмпортерNarodowe Centrum Badań Jądrowych
- Информация носит справочный характер и не является медицинской рекомендацией. Перед приемом любых препаратов проконсультируйтесь с врачом. Oladoctor не несет ответственности за медицинские решения, принятые на основе этого контента.
- Аналоги Метайодобензилогуанидина 131 И (мибг- 131 И) до терапииФорма выпуска: Капсулы, 37 - 7400 МБкАктивное вещество: Йодид натрия (131I)Производитель: Narodowe Centrum Badań JądrowychНе требуется рецептФорма выпуска: Раствор, Раствор натрия фосфата (32P) для инъекций 37-370 МБк/млАктивное вещество: sodium phosphate (32P)Производитель: Narodowe Centrum Badań JądrowychНе требуется рецептФорма выпуска: Раствор, 37,5 МБк/млАктивное вещество: strontium (89Sr) chlorideПроизводитель: Narodowe Centrum Badań JądrowychНе требуется рецепт
Аналоги Метайодобензилогуанидина 131 И (мибг- 131 И) до терапии в других странах
Лучшие аналоги с тем же действующим веществом и терапевтическим эффектом.
Аналог Метайодобензилогуанидина 131 И (мибг- 131 И) до терапии в Іспанія
Врачи онлайн по Метайодобензилогуанидина 131 И (мибг- 131 И) до терапии
Консультация по дозировке, побочным эффектам, взаимодействиям, противопоказаниям и продлению рецепта на Метайодобензилогуанидина 131 И (мибг- 131 И) до терапии – по решению врача и с учетом местных правил.














