
Иг Вена

Спросите врача о рецепте на Иг Вена

Инструкция по применению Иг Вена
Инструкция по применению: информация для пациента
Иг ВЕНА, 50 г/л, раствор для инфузии
Нормальный человеческий иммуноглобулин для внутривенного введения (IVIg)
Прежде чем использовать лекарство, внимательно ознакомьтесь с содержанием инструкции, поскольку она содержит важную информацию для пациента.
- Сохраните эту инструкцию, чтобы в случае необходимости вы могли ее повторно прочитать.
- Если у вас возникли какие-либо сомнения, обратитесь к врачу или медсестре.
- Если у пациента出现 какие-либо нежелательные симптомы, включая любые нежелательные симптомы, не указанные в этой инструкции, сообщите об этом врачу или медсестре. См. пункт 4.
Содержание инструкции:
- 1. Что такое лекарство Иг ВЕНА и для чего оно используется
- 2. Важная информация перед применением лекарства Иг ВЕНА
- 3. Как применять Иг ВЕНА
- 4. Возможные нежелательные реакции
- 5. Как хранить Иг ВЕНА
- 6. Состав и другие сведения
1. Что такое лекарство Иг ВЕНА и для чего оно используется
Иг ВЕНА является раствором нормального человеческого иммуноглобулина для внутривенного введения.
Иммуноглобулины являются человеческими антителами, присутствующими также в крови.
Иг ВЕНА используется в следующих терапиях:
Лечение взрослых, а также детей и подростков (0-18 лет), когда у пациента нет достаточного количества
антител (заместительная терапия) в следующих случаях:
- 1. У пациентов с врожденным дефицитом производства антител (в синдромах первичных иммунодефицитов).
- 2. У пациентов с приобретенным дефицитом производства антител (вторичный иммунодефицит), у которых возникают тяжелые или рецидивирующие инфекции, вызванные различными клиническими состояниями (например, онкологическими или аутоиммунными заболеваниями или в результате лечения этих заболеваний). Антибиотикотерапия у этих пациентов была неэффективной, и либо они не получили достаточного увеличения титра антител после вакцинации (пневмококковая полисахаридная вакцина и вакцина, содержащая полипептидный антиген), либо уровень IgG в сыворотке крови составлял менее 4 г/л.
Лечение взрослых, а также детей и подростков (0-18 лет) с определенными воспалительными заболеваниями (иммуномодуляция) в следующих случаях:
- 1. У пациентов с недостаточным количеством тромбоцитов (первичная иммунологическая тромбоцитопения) и у пациентов с высоким риском кровотечения или перед операцией для достижения достаточного количества тромбоцитов.
- 2. У пациентов с синдромом Гийена-Барре. Это острое заболевание, проявляющееся воспалением периферических нервов,导致 тяжелое мышечное ослабление, в основном в ногах и верхних конечностях.
- 3. У пациентов с болезнью Кавасаки (в сочетании с ацетилсалициловой кислотой). Болезнь Кавасаки является острым заболеванием, преимущественно у маленьких детей, проявляющимся воспалением кровеносных сосудов всего тела
- 4. У пациентов с хроническим демиелинизирующим воспалительным полиневропатием (анг. CIDP - Chronic Inflammatory Demyelinating Polyradiculoneuropathy). Это хроническое заболевание является редким расстройством периферических нервов, характеризующимся постепенно прогрессирующим ослаблением нижних и, в меньшей степени, верхних конечностей.
- 5. При многофокальной двигательной нейропатии (анг. MMN - multifocal motor neuropathy). Это редкое заболевание, поражающее двигательные нервы и проявляющееся медленным, прогрессирующим асимметричным ослаблением конечностей без потери чувствительности
2. Важная информация перед применением лекарства Иг ВЕНА
Когда не применять лекарство Иг ВЕНА
Если у пациента есть аллергия (чувствительность) к человеческому нормальному иммуноглобулину или
к любому из других компонентов этого лекарства (перечисленных в пункте 6).
Когда у пациента есть антитела к иммуноглобулину А (IgA) в крови, поскольку введение лекарства, содержащего IgA, может привести к тяжелой аллергической реакции.
Предостережения и меры предосторожности
Прежде чем начать применение лекарства Иг ВЕНА, необходимо обсудить это с врачом или медсестрой.
Пациенты должны быть тщательно отслеживаемы и внимательно наблюдаемы во время инфузии из-за риска
возможных нежелательных реакций.
Некоторые нежелательные реакции могут возникать чаще:
- в случае слишком быстрой инфузии;
- у пациентов с симптомами нелеченного инфекционного заболевания (например, лихорадки) или хронического воспалительного состояния;
- у пациентов, которые получают человеческий нормальный иммуноглобулин впервые;
- в редких случаях, когда ранее применяемый препарат человеческого нормального иммуноглобулина был заменен на другой или когда с момента последней инфузии прошло длительное время.
В определенных случаях иммуноглобулины могут увеличить риск инфаркта миокарда, инсульта, тромбоза легочной артерии или ухудшить тромбоз глубоких вен
По этой причине врач будет проявлять особую осторожность в следующих случаях:
- у пациентов с ожирением,
- у лиц пожилого возраста,
- у пациентов с диабетом,
- у пациентов с гипертонией,
- у пациентов со сниженным объемом крови (гиповолемией),
- у пациентов с сосудистыми заболеваниями,
- у пациентов с риском развития тромботических состояний крови (приобретенные или врожденные нарушения свертываемости),
- у пациентов с тромботическими состояниями в анамнезе
- у пациентов с заболеваниями, проявляющимися увеличением вязкости крови,
- у пациентов с длительной иммобилизацией,
- у пациентов с заболеваниями почек в настоящее время или в прошлом, или принимающих лекарства, которые могут повредить почки (нефротоксичные лекарства), поскольку были зарегистрированы случаи острой почечной недостаточности. В случае повреждения почечной функции следует рассмотреть возможность прекращения введения иммуноглобулина.
Пациент может иметь аллергию (чувствительность) к иммуноглобулину (антителам) без знания об этом.
Чувствительность может возникнуть даже у пациента, который ранее получал человеческий нормальный иммуноглобулин и хорошо его переносил.
Это может возникнуть особенно в случаях дефицита иммуноглобулина типа IgA (у пациентов с антителами против IgA).
В этих редких случаях могут возникать аллергические реакции (чувствительность) такие как внезапное снижение артериального давления или анафилактическая реакция.
В случае нежелательной реакции следует либо уменьшить скорость введения, либо прекратить введение иммуноглобулина.
Лечение зависит от типа и тяжести нежелательной реакции.
В случае анафилаксии следует действовать в соответствии с текущими медицинскими стандартами лечения анафилаксии.
Нужно сообщить врачу, если хотя бы один из вышеуказанных случаев относится к пациенту.
Врач примет соответствующие меры предосторожности при введении лекарства Иг ВЕНА.
Профилактика вирусных инфекций
Лекарства, изготовленные из человеческой крови или плазмы, подвергаются определенным процедурам, которые должны предотвратить передачу инфекции леченым пациентам.
К этим процедурам относится отбор доноров крови и плазмы, целью которого является исключение доноров, которые могут быть источником инфекции; исследование плазмы на наличие инфекционных агентов/вирусов.
Производители лекарств из человеческой крови или плазмы также используют процессы, которые инактивируют или удаляют вирусы.
Несмотря на эти профилактические меры, нельзя полностью исключить возможность передачи инфекционных агентов через лекарство, изготовленное из человеческой крови или плазмы.
Это относится также к неизвестным или недавно открытным вирусам и другим патогенам.
Считается, что принятые профилактические меры эффективны в отношении вирусов с оболочкой, таких как вирус иммунодефицита человека (ВИЧ), вирус гепатита Б (HBV) и вирус гепатита С (HCV), а также вирусов без оболочки, таких как вирус гепатита А (HAV).
Эти меры могут иметь ограниченную эффективность против вирусов без оболочки, таких как парвовирус В19.
Не установлено, что иммуноглобулины могут быть причиной гепатита А или инфекции парвовирусом В19, поскольку наличие антител может играть важную роль в защите от вирусных инфекций.
Рекомендуется записывать название и номер серии при каждом применении Иг ВЕНА для возможной идентификации лекарства.
Дети и подростки
После применения лекарства Иг ВЕНА у детей и подростков наблюдалась временная и легкая глюкозурия
(наличие глюкозы в моче), без клинических симптомов.
Это может быть связано с содержанием мальтозы в лекарстве Иг ВЕНА, которая в почечных канальцах подвергается гидролизу до глюкозы.
Глюкоза реабсорбируется и в очень небольшой степени выделяется в мочу.
Реабсорбция глюкозы зависит от возраста пациента.
Временное увеличение концентрации мальтозы в сыворотке может превышать почечную способность реабсорбции сахара и повлиять на положительный результат теста на глюкозу в моче.
Лекарство Иг ВЕНА и другие лекарства
Нужно сообщить врачу о всех лекарствах, которые пациент принимает в настоящее время или принимал ранее, а также о лекарствах, которые пациент планирует принимать.
Нельзя смешивать человеческий нормальный иммуноглобулин для внутривенного введения с другими лекарствами
или другими лекарствами, содержащими иммуноглобулины для внутривенного введения (IVIg).
Влияние на живые атенуированные вирусные вакцины
Введение иммуноглобулина может ослабить в течение как минимум 6 недель до 3 месяцев эффективность вакцин, содержащих живые атенуированные вирусы, такие как вирус кори, краснухи, ветряной оспы или эпидемического паротита.
После применения этого лекарства следует выдержать 3-месячный перерыв перед вакцинацией вакциной, содержащей живые атенуированные вирусы.
В случае кори это ослабление может сохраняться до года.
По этой причине пациенты, получающие вакцину против кори, должны иметь определенный титр антител.
Мочегонные средства петлевой диуретики (группа лекарств, усиливающих мочеиспускание)
Нужно избегать одновременного применения с петлевой диуретикой.
Влияние на результаты анализов крови
После введения иммуноглобулина временное увеличение в крови пациента биологически перенесенных различных антител может привести к ложноположительным результатам серологических тестов.
Пассивная передача антител к антигенам эритроцитов, например А, В, D (ответственных за группу крови), может повлиять на результаты некоторых серологических тестов на антитела к красным кровяным клеткам, например непрямого антиглобулинового теста (DAT, теста Кумбса).
Анализ глюкозы в крови
Некоторые виды анализов глюкозы в крови (например, использующие методы, основанные на дегидрогеназе глюкозы - пиrolloхинолинхиноне (GDH-PQQ) или оксидоредуктазе глюкозы-барвинка) неправильно интерпретируют мальтозу (100 мг/мл), содержащуюся в лекарстве Иг ВЕНА, как глюкозу.
Это может привести к ложно завышенному показанию глюкозы в крови во время инфузии и в течение примерно 15 часов после окончания инфузии, что может привести к неправильному введению инсулина,导致 угрожающую жизни гипогликемию.
Кроме того, случаи реальной гипогликемии могут остаться без лечения, если состояние гипогликемии будет замаскировано ложно повышенными показаниями глюкозы.
В связи с этим при введении Иг ВЕНА или других лекарств для парентерального введения, содержащих мальтозу, измерение глюкозы в крови должно проводиться методом, специфичным для глюкозы.
Нужно тщательно ознакомиться с информацией о тестах для анализа глюкозы в крови, включая информацию о тест-полосках, чтобы определить, можно ли их использовать с лекарствами для парентерального введения, содержащими мальтозу.
В случае сомнений необходимо обратиться к производителю устройства для определения возможности его использования с лекарствами для парентерального введения, содержащими мальтозу.
Дети и подростки
Хотя не проводились исследования взаимодействия у детей и подростков, не ожидается разницы между взрослой популяцией и детьми и подростками.
Беременность, грудное вскармливание и влияние на фертильность
- Если пациентка беременна или кормит грудью, предполагает, что может быть беременной или планирует иметь ребенка, она должна проконсультироваться с врачом перед применением этого лекарства.
Врач решит, можно ли применять лекарство Иг ВЕНА у беременной пациентки. - Не проводились клинические исследования с Иг ВЕНА у беременных женщин.
Было показано, что продукты иммуноглобулина для внутривенного введения проникают через плаценту, с наибольшим накоплением в третьем триместре.
Однако длительное клиническое наблюдение за применением иммуноглобулинов предполагает, что не следует ожидать какого-либо вредного влияния на течение беременности, на плод или на новорожденного. - Если пациентка кормит грудью и получает лекарство Иг ВЕНА, антитела из этого лекарства могут проникать в грудное молоко.
Это может способствовать защите новорожденного от определенных инфекций. - Клиническое наблюдение за применением иммуноглобулинов предполагает, что не следует ожидать какого-либо вредного влияния на фертильность.
Вождение транспортных средств и эксплуатация машин
Некоторые нежелательные реакции, связанные с продуктом Иг ВЕНА, могут ухудшать способность управлять транспортными средствами и эксплуатировать машины.
Пациенты, у которых возникли нежелательные реакции во время лечения, должны подождать до их исчезновения перед управлением транспортным средством или эксплуатацией машин.
Иг ВЕНА содержит мальтозу и натрий
Лекарство содержит 100 мг мальтозы в 1 мл.
Это лекарство содержит примерно 69 мг натрия в 1 литре.
Нужно учитывать это при пациентах на диете с низким содержанием натрия.
3. Как применять Иг ВЕНА
Иг ВЕНА может быть введен врачом или обученным медицинским персоналом только в условиях стационара или амбулатории.
Доза и схема дозирования зависят от показаний; врач определит соответствующую дозировку для данного пациента.
Иг ВЕНА следует вводить изначально медленно.
Если лекарство хорошо переносится, скорость инфузии можно постепенно увеличить.
Применение у детей и подростков
Дозирование у детей и подростков (0-18 лет) не отличается от того, которое применяется у взрослых, поскольку дозирование в отдельных показаниях определяется на основе массы тела и клинического состояния пациента.
Применение большей, чем рекомендованная, дозы Иг ВЕНА
Передозировка может привести к перегрузке кровообращения и чрезмерной вязкости крови, особенно у пациентов группы риска, у пациентов пожилого возраста или с сердечной или почечной недостаточностью.
В случае любых дальнейших вопросов, связанных с применением этого лекарства, необходимо обратиться к врачу или медсестре.
4. Возможные нежелательные реакции
Как и любой лекарственный препарат, это лекарство может вызывать нежелательные реакции, хотя они не возникают у каждого.
Следующие нежелательные реакции могут возникать после применения лекарства, содержащего иммуноглобулин:
- дрожь, головная боль, головокружение, лихорадка, рвота, тошнота, аллергические реакции, боль в суставах, снижение артериального давления и умеренная боль в нижней части спины могут возникать спорадически;
- единичные случаи временного снижения количества красных кровяных клеток (реверсивная гемолитическая анемия/гемолиз);
- внезапное снижение артериального давления может возникать редко, и в единичных случаях может возникать анафилактический шок, даже у пациента, у которого не было известно о чувствительности после предыдущих введений;
- наблюдались редкие случаи временных кожных реакций;
- очень редко возникали тромботические осложнения (образование тромбов), которые могут привести к инфаркту миокарда, инсульту, тромбозу легочной артерии (пульмонэмболия), тромбозу глубоких вен;
- случаи временного, не связанного с инфекцией, асеептического менингита (асептическое менингитическое синдром);
- наблюдались увеличение креатинина в сыворотке и/или внезапная почечная недостаточность;
- случаи острого постперфузионного повреждения легких (анг. TRALI - Transfusion related acute lung injury).
В клинических исследованиях и после введения лекарства Иг ВЕНА в обращение наблюдались следующие нежелательные реакции, перечисленные в порядке убывания частоты:
Часто (может затронуть менее 1 из 10 человек)
- боль в спине
- тошнота
- чувство слабости, усталость, лихорадка
- боль в мышцах
- головная боль, сонливость
Частота неизвестна (не может быть определена на основе доступных данных)
- асептическое менингитическое синдром
- разрушение красных кровяных клеток,导致 анемию
- аллергические реакции и угрожающий жизни анафилактический шок
- состояние спутанности
- инсульт, головокружение, неконтролируемое движение, онемение или покалывание кожи или конечностей
- инфаркт миокарда, синюшная окраска кожи, быстрое сердцебиение, медленное сердцебиение, нерегулярное сердцебиение
- тромбоз крови в венах и кровеносных сосудах, низкое артериальное давление, высокое артериальное давление, бледность
- тромбоз главной легочной артерии, ненормальное количество жидкости в легких, затруднение дыхания с свистящим дыханием или кашлем
- рвота, диарея, боль в животе
- быстрое распространение отека кожи, крапивница, покраснение и воспаление кожи, сыпь на коже, зуд, экзема, чрезмерное потоотделение
- боль в суставах и мышцах, боль в спине, боль в шее, скованность мышц скелета
- внезапная почечная недостаточность
- воспаление вены в месте введения лекарства, лихорадка, боль или чувство дискомфорта в грудной клетке, отек лица, общее плохое самочувствие
- увеличение креатинина в крови
Дополнительные нежелательные реакции у детей и подростков
Нужно ожидать, что частота, тип и тяжесть нежелательных реакций у детей и подростков будут такими же, как и у взрослых.
После применения лекарства Иг ВЕНА у детей и подростков наблюдалась временная и легкая глюкозурия
(наличие глюкозы в моче), без клинических симптомов.
Сведения о вирусной безопасности см. в пункте 2. «Важная информация перед применением лекарства Иг ВЕНА».
Сообщение о нежелательных реакциях
Если возникают какие-либо нежелательные симптомы, включая любые нежелательные симптомы, не указанные в инструкции, необходимо сообщить об этом врачу или медсестре.
Нежелательные реакции можно сообщать в Департамент мониторинга нежелательных реакций лекарственных средств Управления регистрации лекарственных средств, медицинских изделий и биоцидных продуктов
(ул. Аллея Ерозолимских, 181С, 02-222 Варшава),
телефон: 22 4921301,
факс: 22 4921309,
веб-сайт: https://smz.ezdrowie.gov.pl
Нежелательные реакции также можно сообщать ответственной организации.
5. Как хранить Иг ВЕНА
Лекарство должно храниться в месте, недоступном для детей.
Не применять это лекарство после истечения срока годности, указанного на этикетке ампулы и упаковки после «EXP».
Срок годности указывает последний день данного месяца.
Хранить в холодильнике (2°C - 8°C).
До использования и в течение срока годности лекарство можно хранить при комнатной температуре, не выше 25°C, в течение максимум 6 последовательных месяцев.
После этого времени лекарство должно быть уничтожено.
В любом случае не следует повторно помещать лекарство в холодильник, если оно хранилось при комнатной температуре.
На упаковке необходимо записать начальную дату хранения при комнатной температуре.
После открытия ампулы содержимое должно быть использовано немедленно.
Ампулы хранить в наружной упаковке.
Не замораживать.
Не применять это лекарство, если заметно, что раствор помутнел, изменил цвет или имеет видимый осадок.
Лекарства не следует выбрасывать в канализацию или домашние контейнеры для отходов.
Нужно спросить фармацевта, как утилизировать лекарства, которые больше не используются.
Такое действие поможет защитить окружающую среду.
6. Состав и другие сведения
Что содержит лекарство Иг ВЕНА
Активным веществом лекарства является человеческий нормальный иммуноглобулин.
1 мл раствора содержит 50 мг человеческого нормального иммуноглобулина.
Раствор содержит человеческий белок 50 г/л, включая как минимум 95% IgG (иммуноглобулин G).
Распределение подклассов IgG следующее:
ИгГ1 62,1%
ИгГ2 34,8%
ИгГ3 2,5%
ИгГ4 0,6%
Максимальное содержание IgA составляет 50 микрограммов/мл.
Лекарство произведено из плазмы доноров крови.
Другими компонентами лекарства являются мальтоза, вода для инъекций.
Как выглядит лекарство Иг ВЕНА и что содержит упаковка
Раствор для инфузии Иг ВЕНА доступен в однодозовых ампулах по 50 мл, 100 мл или 200 мл с установленным держателем (ампула + держатель).
Раствор прозрачный или слегка опалесцирующий, бесцветный или светло-желтый.
Величины упаковок:
Однодозовые упаковки:
1 ампула содержит 2,5 г/50 мл
1 ампула содержит 5 г/100 мл
1 ампула содержит 10 г/200 мл
Многодозовые упаковки:
Упаковка, содержащая 2 однодозовые упаковки по 1 ампуле 10 г/200 мл
Упаковка, содержащая 3 однодозовые упаковки по 1 ампуле 10 г/200 мл
Не все размеры упаковок могут быть в обращении.
Ответственная организация:
Кедрион С.п.А.
Местоположение Ай Конти, 55051 Каствеккьо Пасколи, Барга (Лукка), Италия
Производитель:
Кедрион С.п.А.
55027 Бологнана, Галличано (Лукка), Италия
Этот лекарственный препарат разрешен к обращению в странах-членах Европейского экономического пространства под следующими названиями:
| Австрия | Иг Вена 50г/л раствор для инфузии |
| Германия | Иг Вена 50 г/л раствор для инфузии |
| Греция | Иг ВЕНА |
| Италия | ИГ ВЕНА |
| Польша | Иг ВЕНА |
| Португалия | Иг Вена |
Для получения более подробной информации необходимо обратиться к местному представителю ответственной организации:
МБиС Медикал Бизнес энд Сайенс, ул. Хелмская, 30/34, 00-725 Варшава
Телефон/факс: 22 851 52 08
Дата последней актуализации инструкции: 11/2020
Сведения, предназначенные исключительно для медицинского персонала:
Инструкция правильного применения
- Прежде чем использовать продукт Иг ВЕНА, необходимо привести его к комнатной температуре или температуре тела.
- Прежде чем использовать раствор, его следует визуально оценить на наличие частиц и изменение цвета. Не следует использовать растворы, которые являются мутными или имеют осадок.
- Человеческий нормальный иммуноглобулин следует вводить внутривенно с начальной скоростью инфузии 0,46 - 0,92 мл/кг/час (10 - 20 капель в минуту) в течение 20 - 30 минут. В случае возникновения нежелательной реакции необходимо уменьшить скорость инфузии или прекратить введение иммуноглобулина. Если хорошо переносится, скорость инфузии можно постепенно увеличить до максимум 1,85 мл/кг/час (40 капель в минуту).
- У пациентов с первичным иммунодефицитом, которые переносят скорость инфузии 0,92 мл/кг/час, можно постепенно увеличивать скорость введения каждые 20-30 минут до 2 мл/кг/час, 4 мл/кг/час и максимум до 6 мл/кг/час, но только если пациент хорошо переносит инфузию. Обычно дозирование и скорость инфузии должны быть индивидуализированы для каждого пациента. В зависимости от массы тела пациента, дозирования и возникновения нежелательных реакций максимальная скорость инфузии может не быть достигнута. В случае возникновения нежелательных реакций необходимо немедленно прекратить инфузию, а затем возобновить ее с соответствующей для пациента скоростью.
Особые популяции
У детей и подростков (0-18 лет) и у лиц пожилого возраста (>64 лет) начальную скорость введения следует устанавливать на уровне 0,46 – 0,92 мл/кг/час (10 – 20 капель в минуту) в течение 20 - 30 минут. Если хорошо переносится, после учета клинического состояния пациента, скорость можно постепенно увеличить до максимум 1,85 мл/кг/час (40 капель в минуту).
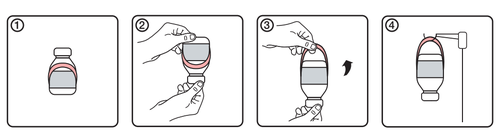
Инструкция использования держателя
- 1.Первоначальный вид ампулы с этикеткой держателя
- 2.Перевернуть ампулу вверх дном
- 3.Создать держатель, развернув его из этикетки
- 4. Повесить ампулу на стойку для инфузии
Меры предосторожности
Некоторые тяжелые нежелательные реакции могут быть связаны со скоростью инфузии.
Потенциальных осложнений можно часто избежать, обеспечив:
- что пациенты не имеют аллергии к человеческому нормальному иммуноглобулину, начиная с медленного введения препарата (скорость введения 0,46 - 0,92 мл/кг/час);
- что пациенты тщательно отслеживаются и внимательно наблюдаются во время инфузии в отношении нежелательных реакций. Особенно пациенты, получающие человеческий нормальный иммуноглобулин впервые, пациенты, которые ранее получали другой препарат IVIg, или в случае длительной паузы после предыдущей инфузии, должны быть отслеживаемы во время первой инфузии и в течение первой часа после первой инфузии, чтобы заметить симптомы потенциальных нежелательных реакций. Другие пациенты должны быть наблюдаемы в течение как минимум 20 минут после инфузии.
У всех пациентов внутривенное введение Иг требует:
- адекватного гидратации перед началом инфузии Иг
- мониторинга диуреза
- мониторинга уровня креатинина в сыворотке
- избегания одновременного применения с петлевой диуретикой. В случае нежелательной реакции необходимо либо уменьшить скорость введения, либо прекратить введение иммуноглобулина. Лечение зависит от типа и тяжести нежелательной реакции. В случае анафилаксии необходимо действовать в соответствии с текущими медицинскими стандартами лечения анафилаксии.
Реакция на инфузию
Некоторые нежелательные реакции (например, головная боль, приливы жара, дрожь, боль в мышцах, свистящее дыхание, тахикардия, боль в нижней части спины, тошнота и недомогание) могут быть связаны со скоростью инфузии.
Нужно тщательно соблюдать рекомендуемую скорость инфузии.
Пациенты должны быть тщательно отслеживаемы и внимательно наблюдаются во время инфузии из-за риска возникновения нежелательных реакций.
Некоторые нежелательные реакции могут возникать чаще:
- у пациентов, которые получают человеческий нормальный иммуноглобулин впервые, или в редких случаях, когда меняется препарат человеческого нормального иммуноглобулина на другой или когда препарат вводится после длительной паузы
- у пациентов с нелеченным инфекционным заболеванием или хроническим воспалительным состоянием.
Дети и подростки
Не имеется специальных рекомендаций, касающихся мер предосторожности или мониторинга у детей и подростков.
Не ожидается разницы у детей и подростков (от 0 до 18 лет).
Тромботическое заболевание
Существуют клинические данные о связи между внутривенным введением Иг и случаями тромботических осложнений, таких как инфаркт миокарда, эпизод цереброваскулярной недостаточности (включая инсульт), тромбоз легочной артерии (пульмонэмболия) и тромбоз глубоких вен, которые считаются имеющими связь с относительным увеличением вязкости крови после интенсивного введения иммуноглобулина у пациентов группы риска.
Нужно проявлять осторожность при назначении и введении препарата пациентам с ожирением и пациентам, у которых существует риск возникновения тромботических состояний (таких как пожилой возраст, гипертония, диабет и сосудистые заболевания или тромботические состояния в анамнезе, приобретенные или врожденные нарушения свертываемости, длительная иммобилизация, пациенты с тяжелой гиповолемией, пациенты с заболеваниями, проявляющимися увеличением вязкости крови).
У пациентов с риском нежелательных тромботических реакций иммуноглобулины для внутривенного введения должны вводиться с минимальной скоростью инфузии и в максимально возможной минимальной дозе.
Острая почечная недостаточность
Были зарегистрированы случаи острой почечной недостаточности у пациентов, леченных иммуноглобулинами для внутривенного введения.
У большинства из них были выявлены факторы риска, такие как предшествующая почечная недостаточность, диабет, значительное снижение объема циркулирующей крови, избыточный вес, одновременный прием нефротоксичных препаратов или возраст старше 65 лет.
Нужно оценить почечные параметры перед введением Иг и повторно в соответствующих временных интервалах, особенно у пациентов, у которых выявлен потенциально увеличенный риск возникновения острой почечной недостаточности.
У пациентов с риском острой почечной недостаточности иммуноглобулины для внутривенного введения должны вводиться с минимальной скоростью инфузии и в максимально возможной минимальной дозе.
В случае повреждения почечной функции следует рассмотреть возможность прекращения внутривенного введения Иг.
Сообщения о нарушении почечной функции и острой почечной недостаточности касались применения нескольких лицензированных препаратов иммуноглобулина для внутривенного введения, содержащих различные вспомогательные вещества, такие как сахароза, глюкоза и мальтоза.
В общем числе случаев доля препаратов, содержащих сахарозу в качестве стабилизатора, была неравномерно высокой.
У пациентов группы риска можно рассмотреть применение препаратов иммуноглобулина для внутривенного введения, не содержащих этих вспомогательных веществ.
Асептический менингит
Во время лечения иммуноглобулинами для внутривенного введения было зарегистрировано возникновение синдрома асептического менингита (анг. AMS - aseptic meningitis syndrome).
Синдром обычно начинается в течение нескольких часов до 2 дней после применения Иг.
В исследованиях спинномозговой жидкости часто обнаруживается плейцитоз до нескольких тысяч клеток на мм, в основном гранулоцитов, и повышенные уровни белка до нескольких сотен мг/дл.
AMS может возникать чаще в связи с лечением высокими дозами Иг (2 г/кг).
Пациенты с объективными и субъективными симптомами должны быть подвергнуты тщательному неврологическому обследованию, включая исследование спинномозговой жидкости, для исключения других причин менингита.
Прекращение лечения Иг приводило к разрешению AMS в течение нескольких дней без возникновения последствий.
Гемолитическая анемия
Продукты иммуноглобулина для внутривенного введения могут содержать антитела к группам крови, которые могут действовать как гемолизины и индуцировать в условиях in vivo оплачивание красных кровяных клеток иммуноглобулином,导致 положительную прямую антиглобулиновую реакцию (тест Кумбса) и, редко, гемолиз.
Гемолитическая анемия может развиться во время лечения Иг в результате усиленной секвестрации красных кровяных клеток.
Пациенты, получающие иммуноглобулин внутривенно, должны быть отслеживаемы в отношении возможности возникновения клинических симптомов гемолиза.
Нейтропения/лейкопения
После лечения Иг сообщались временные снижения количества нейтрофилов и/или эпизоды нейтропении, иногда тяжелые.
Обычно это возникает в течение нескольких часов или дней после применения Иг и разрешается самостоятельно в течение 7-14 дней.
Острое постперфузионное повреждение легких (анг. TRALI - Transfusion related acute lung injury)
У пациентов, получающих препараты Иг, сообщались случаи острого некардиогенного отека легких (острое постперфузионное повреждение легких - TRALI).
TRALI характеризуется тяжелой гипоксией (пониженным содержанием кислорода в крови), дыхательной недостаточностью, нарушениями дыхания, синюшностью, лихорадкой и недомоганием.
Симптомы TRALI обычно возникают в течение 6 часов после применения Иг, часто в течение 1-2 часов.
Поэтому необходимо отслеживать пациентов; в случае возникновения нежелательных реакций со стороны дыхательной системы необходимо немедленно прекратить инфузию Иг.
Возникновение TRALI может угрожать жизни, требует немедленного лечения в отделении интенсивной терапии.
Этот препарат содержит 100 мг мальтозы в 1 мл в качестве вспомогательного вещества.
Наличие мальтозы в крови может повлиять на результат анализа глюкозы, давая ложно повышенное значение глюкозы в крови, что может привести к неправильному введению инсулина,导致 угрожающую жизни гипогликемию.
Кроме того, случаи реальной гипогликемии могут остаться без лечения, если состояние гипогликемии будет замаскировано ложно повышенными значениями глюкозы.
В связи с этим при введении Иг ВЕНА или других препаратов для парентерального введения, содержащих мальтозу, измерение глюкозы в крови должно проводиться методом, специфичным для глюкозы.
Нужно тщательно ознакомиться с информацией о тестах для анализа глюкозы в крови, включая информацию о тест-полосках, чтобы определить, можно ли их использовать с препаратами для парентерального введения, содержащими мальтозу.
В случае сомнений необходимо обратиться к производителю устройства для определения возможности его использования с препаратами для парентерального введения, содержащими мальтозу.
Дозирование
Заместительная терапия должна быть начата и контролируется специалистом-доктором, имеющим опыт в лечении иммунодефицитных состояний.
Дозирование
Доза и схема дозирования зависят от показаний. Дозу необходимо устанавливать индивидуально для каждого пациента в зависимости от клинической реакции. Доза, зависящая от массы тела, может потребовать корректировки у пациентов с недостатком веса или ожирением.
Ниже приведены рекомендуемые схемы дозирования.
Заместительная терапия при первичных иммунодефицитных состояниях
Дозу необходимо устанавливать так, чтобы достичь уровня IgG (измеряемого перед следующей инфузией) не менее 6 г/л или в пределах нормы для данной популяции. С момента начала лечения до стабилизации уровня иммуноглобулина требуется три-шесть месяцев (стабильный уровень IgG). Рекомендуется начальная доза 0,4-0,8 г/кг, введенная однократно, а затем не менее 0,2 г/кг, вводимой каждые три-четыре недели. Доза, необходимая для достижения минимальной концентрации IgG 6 г/л, составляет 0,2-0,8 г/кг/месяц. После достижения стабильного состояния интервалы между инфузиями составляют 3-4 недели. Необходимо определять и оценивать уровень иммуноглобулина в отношении частоты инфекций. Для снижения частоты бактериальных инфекций может быть необходимо увеличить дозу для достижения более высокой концентрации.
Вторичные иммунодефицитные состояния
Рекомендуемая доза составляет 0,2-0,4 г/кг каждые три-четыре недели.
Необходимо определять и оценивать минимальный уровень IgG в отношении частоты инфекций. Дозу необходимо корректировать по мере необходимости для достижения адекватной защиты от инфекций; может быть необходимо увеличить дозу у пациентов с сохраняющейся инфекцией; снижение дозы можно рассмотреть, если пациент не имеет инфекции.
Первичная иммунная тромбоцитопения
Два альтернативных режима лечения:
- доза 0,8-1,0 г/кг в первый день; доза может быть повторена один раз в течение 3 дней
- 0,4 г/кг в день в течение двух-пяти дней. Лечение можно повторить, если происходит рецидив заболевания.
Синдром Гийена-Барре
0,4 г/кг/день в течение более пяти дней (возможно повторение дозирования при рецидиве).
Болезнь Кавасаки
Необходимо вводить 2,0 г/кг в виде однократной дозы. Пациенты должны получать одновременно ацетилсалициловую кислоту.
Хроническая воспалительная демиелинизирующая полинейропатия (CIDP)
Начальная доза: 2 г/кг в течение 2-5 последовательных дней.
Поддерживающая доза: 1 г/кг в течение 1-2 последовательных дней каждые три недели.
Эффективность лечения необходимо оценивать после каждого цикла; если наблюдается отсутствие эффективности после шести месяцев, лечение должно быть прекращено.
Если терапия эффективна, врач должен принять решение о долгосрочном лечении, учитывая реакции пациента и ответ на поддерживающее лечение. Дозирование и интервалы между лечением могут потребовать корректировки в зависимости от индивидуального течения заболевания.
Мультифокальная мотонейропатия (MMN)
Начальная доза: 2 г/кг, вводимая в течение 2-5 последовательных дней.
Поддерживающая доза: 1 г/кг каждые 2-4 недели или 2 г/кг каждые 4-8 недель.
Эффективность лечения необходимо оценивать после каждого цикла; если наблюдается отсутствие эффективности после шести месяцев, лечение должно быть прекращено.
Если терапия эффективна, врач должен принять решение о долгосрочном лечении, учитывая реакции пациента и ответ на поддерживающее лечение. Дозирование и интервалы между лечением могут потребовать корректировки в зависимости от индивидуального течения заболевания.
Рекомендуемое дозирование представлено в следующей таблице:
| Показания | Доза | Частота введения |
| Заместительная терапия | ||
| Первичные иммунодефицитные состояния | начальная доза: 0,4-0,8 г/кг, поддерживающая доза: 0,2-0,8 г/кг | каждые 3-4 недели |
| Вторичные иммунодефицитные состояния | 0,2-0,4 г/кг | каждые 3-4 недели |
| Иммуномодулирующая терапия | ||
| Первичная иммунная тромбоцитопения | 0,8-1 г/кг или 0,4 г/кг/день | в первый день, возможное повторение один раз в течение 3 дней, в течение 2-5 дней |
| Синдром Гийена-Барре | 0,4 г/кг/день | в течение 5 дней |
| Болезнь Кавасаки | 2 г/кг | в виде однократной дозы в сочетании с ацетилсалициловой кислотой |
| Хроническая воспалительная демиелинизирующая полинейропатия (CIDP) | начальная доза: 2 г/кг, поддерживающая доза: 1 г/кг | в разделенных дозах в течение 2-5 дней, каждые 3 недели в течение 1-2 дней |
| Мультифокальная мотонейропатия (MMN) | поддерживающая доза: 1 г/кг или 2 г/кг | каждые 2-4 недели или каждые 4-8 недель в течение 2-5 дней |
Применение у детей и подростков
Дозирование у детей и подростков (0-18 лет) не отличается от того, которое используется у взрослых, поскольку дозирование в отдельных показаниях определяется на основе массы тела и клинического состояния пациента соответственно.
Пациенты с нарушением функции печени
Отсутствуют данные о необходимости корректировки дозирования.
Пациенты с нарушением функции почек
Не существует необходимости корректировки дозы, если только это не обосновано клинически.
Пожилые пациенты
Не существует необходимости корректировки дозы, если только это не обосновано клинически.
CIDP
Учитывая редкость хронической воспалительной демиелинизирующей полинейропатии и, как следствие, небольшое количество пациентов, данные о применении внутривенных иммуноглобулинов у детей с CIDP ограничены; однако, опубликованные данные согласованы и все показывают, что лечение IVIg у взрослых и детей одинаково эффективно, как и в случае ранее одобренных показаний.
- Страна регистрации
- Активное вещество
- Требуется рецептНет
- Производитель
- ИмпортерKedrion S.p.A.
- Информация носит справочный характер и не является медицинской рекомендацией. Перед приемом любых препаратов проконсультируйтесь с врачом. Oladoctor не несет ответственности за медицинские решения, принятые на основе этого контента.
- Аналоги Иг ВенаАктивное вещество: immunoglobulins, normal human, for intravascular adm.Производитель: Baxalta Belgium Manufacturing S.A.Требуется рецептФорма выпуска: Раствор, 100 мг/млАктивное вещество: immunoglobulins, normal human, for intravascular adm.Производитель: Instituto Grifols S.A.Требуется рецептФорма выпуска: Раствор, 50 г/л (50 мг/мл)Активное вещество: immunoglobulins, normal human, for intravascular adm.Производитель: Biotest Pharma GmbHТребуется рецепт
Аналоги Иг Вена в других странах
Лучшие аналоги с тем же действующим веществом и терапевтическим эффектом.
Аналог Иг Вена в Spain
Аналог Иг Вена в Ukraine
Врачи онлайн по Иг Вена
Консультация по дозировке, побочным эффектам, взаимодействиям, противопоказаниям и продлению рецепта на Иг Вена – по решению врача и с учетом местных правил.














