
IG VENA 50 G/L SOLUTION FOR INFUSION

How to use IG VENA 50 G/L SOLUTION FOR INFUSION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the User
Ig Vena 50 g/l, Solution for Infusion
Human Normal Immunoglobulin (IgIV)
Read all of this leaflet carefully before you start using this medicine because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor or nurse.
- If you get any side effects, talk to your doctor or nurse. This includes any possible side effects not listed in this leaflet. See section 4.
Contents of the Package Leaflet
- What is Ig Vena and what is it used for
- What you need to know before you use Ig Vena
- How to use Ig Vena
- Possible side effects
- Storage of Ig Vena
- Contents of the pack and other information
1. What is Ig Vena and what is it used for
Ig Vena is a solution of human normal immunoglobulin for intravenous administration. Immunoglobulins are human antibodies that are also present in the blood.
Ig Vena is used for:
Treatment in adults, children and adolescents (0-18 years) who lack sufficient antibodies (replacement therapy) in the following cases:
- Patients with congenital deficiency in antibody production (primary immunodeficiency syndromes).
- Patients with acquired deficiency of antibody production (secondary immunodeficiencies) who suffer from severe or recurrent infections due to different medical conditions (e.g. oncological or autoimmune diseases or due to the consequent treatment of these diseases). These patients have been subjected to antibiotic treatment that has been ineffective and have not had a sufficiently significant increase in IgG antibody titre after vaccination (anti-pneumococcal vaccines with polysaccharide and polypeptide antigens) or have an IgG level in the blood of <4 g l.< li>
Treatment in adults, children and adolescents (0-18 years) with certain inflammatory conditions (immunomodulation) in the following cases:
- Patients who do not have enough platelets (Primary Immune Thrombocytopenia, PIT), with a high risk of bleeding or before undergoing surgery to correct platelet count.
- Patients with Guillain-Barré syndrome. This is an acute disease characterized by inflammation of the peripheral nerves that causes severe muscle weakness, mainly in the legs and upper limbs.
- Patients with Kawasaki disease (in combination with acetylsalicylic acid). This is an acute disease that mainly affects young children and is characterized by inflammation of blood vessels throughout the body.
- Patients with Chronic Inflammatory Demyelinating Polyneuropathy (CIDP). This chronic disease is a rare disorder of the peripheral nerves that is characterized by a gradual increase in weakness in the legs and, to a lesser extent, in the arms.
- Patients with Multifocal Motor Neuropathy (MMN). This is a rare disease that affects motor nerves and is characterized by asymmetric and slowly progressive weakness of the limbs without loss of sensitivity.
2. What you need to know before you use Ig Vena
Do not use Ig Vena
- If you are allergic (hypersensitive) to human immunoglobulins or to any of the other components of this medicine (listed in section 6).
- If you have antibodies against immunoglobulins of type IgA in the blood, as the administration of a medicine containing IgA may cause a severe allergic reaction.
Warnings and precautions
Consult your doctor or nurse before using Ig Vena.
Your doctor or healthcare professional will closely monitor you and observe you carefully during the Ig Vena infusion period to ensure that you do not suffer from adverse reactions.
Certain adverse reactions may occur more frequently:
- in case of high infusion rate;
- if you have uncontrolled signs of untreated infections (e.g. fever) or signs of chronic inflammation;
- if you receive human normal immunoglobulin for the first time;
- in rare cases, when switching from one human normal immunoglobulin product to another, or when a long period of time has elapsed since the previous infusion.
- In certain cases, immunoglobulins may increase the risk of myocardial infarction, stroke, pulmonary embolism or deep vein thrombosis, as they increase blood viscosity.
Therefore, your doctor will take special precautions in the following cases:
- if you are overweight,
- if you are elderly,
- if you have diabetes,
- if you have high blood pressure (hypertension),
- if your blood volume is very low (hypovolemia),
- if you have or have had problems with blood vessels (vascular diseases),
- if you have a greater tendency to form clots (hereditary or acquired thrombotic disorders),
- if you have thrombotic episodes,
- if you have a disease that makes your blood thicker (viscosity),
- if you have been bedridden for a long period of time,
- if you have or have had kidney problems or if you are taking medications that can damage your kidneys (nephrotoxic medications), as cases of acute renal failure have been reported. In case of renal disorder, your doctor will consider interrupting treatment.
- You may be allergic (hypersensitive) to immunoglobulins (antibodies) without knowing it.
This can occur even if you have previously taken human normal immunoglobulins and tolerated them well. It can happen especially if you do not have immunoglobulins of type IgA (IgA deficiency with anti-IgA antibodies). In these rare cases, allergic reactions (hypersensitivity) such as a sudden drop in blood pressure or shock may occur.
In case of an adverse reaction, your doctor may decide to reduce the administration rate or stop the infusion. Similarly, your doctor will decide on the treatment required depending on the nature and severity of the adverse effect.
In case of shock, standard medical treatment should be applied. Please inform your doctor if you have any of the above conditions, your doctor will take special care when prescribing and administering Ig Vena.
Viral Safety
Medicines derived from human blood or plasma are subject to a number of safety measures to prevent the transmission of infections to patients. These include careful selection of blood or plasma donors to ensure that those at risk of being carriers of infections are excluded, and testing of each donation and plasma pools for signs of viruses. Manufacturers of these medicines also include measures in the processing of blood or plasma to inactivate or eliminate pathogens. Despite these measures, when human blood or plasma-derived medicines are administered, the possibility of transmitting an infection cannot be totally excluded. This is also valid for any unknown or emerging virus or other types of infections.
The measures taken are considered effective for enveloped viruses such as human immunodeficiency virus (HIV), hepatitis B virus (HBV), hepatitis C virus (HCV), and for hepatitis A virus (HAV) without envelope.
The measures taken may have a limited effect on non-enveloped viruses such as parvovirus B19.
Immunoglobulins have not been associated with hepatitis A or parvovirus B19 infections, possibly because the antibodies against these infections, such as those contained in the medicine, are protective.
It is highly recommended that each time you receive a dose of Ig Vena, the name and batch number of the product be recorded to maintain a record of the batches used.
Children and Adolescents
Transient and mild glucosuria (presence of glucose in the urine) without clinical signs has been observed after administration of Ig Vena in pediatric patients. This event may be related to the maltose contained in Ig Vena, as maltose is hydrolyzed to glucose in the renal tubules, which is reabsorbed and generally excreted very little in the urine. Glucose reabsorption is determined by age. The transient increase in maltose in plasma may exceed the renal capacity for sugar reabsorption and result in positive glucose tests in urine.
Other Medicines and Ig Vena
Tell your doctor if you are taking, have recently taken or might take any other medicines.
Human normal immunoglobulin for intravenous administration must not be mixed with other medicines or with any other IgIV product.
Live attenuated virus vaccines
Administration of immunoglobulin may alter the efficacy of live attenuated virus vaccines such as measles, rubella, mumps and varicella for a period of at least 6 weeks and up to 3 months. After administration of this medicine, an interval of 3 months should be allowed before administering live attenuated virus vaccines. In the case of measles, the alteration may last up to 1 year. Therefore, antibody levels should be checked in patients who receive the measles vaccine.
Loop diuretics (a group of medicines that increase urine flow)
Avoid concomitant use of loop diuretics.
Blood Tests
Ig Vena may interfere with some blood tests due to the transient increase in various antibodies passively transferred to the blood after immunoglobulin injection; this increase in antibodies may generate misleading results in serological tests. The passive transfer of antibodies to erythrocyte antigens, for example, A, B, D (which determine blood group), may interfere with some serological tests to detect erythrocyte antibodies, for example, the direct antiglobulin test (direct Coombs test, DAT).
Blood Glucose Tests
Some blood glucose test systems (e.g. those based on glucose dehydrogenase pyrroloquinolinequinone (GDH-PQQ) or glucose-colorimetric-oxidoreductase methods) falsely interpret the maltose (100 mg/ml) contained in Ig Vena as glucose. This may result in falsely elevated glucose readings during infusion and for approximately 15 hours after completion of infusion, and consequently in inadequate administration of insulin, causing life-threatening hypoglycemia or even death. Similarly, real hypoglycemia cases may not be treated if the hypoglycemic state is masked by falsely elevated glucose readings. Therefore, when Ig Vena or other parenteral products containing maltose are administered, blood glucose measurement should be performed using a glucose-specific method. The product information of the blood glucose test system, including test strips, should be carefully reviewed to determine if the system is suitable for use with parenteral products containing maltose. If in doubt, contact the manufacturer of the test system to determine if the system is suitable for use with parenteral products containing maltose.
Children and Adolescents
Although specific interaction studies have not been conducted in the pediatric population, no differences between children and adults are expected.
Pregnancy, Breast-feeding and Fertility
- If you are pregnant or breast-feeding, think you may be pregnant or are planning to have a baby, ask your doctor for advice before taking this medicine. Your doctor will decide whether you can use Ig Vena during pregnancy or breast-feeding.
- No clinical studies have been conducted with Ig Vena in pregnant women. It has been demonstrated that IgIV products cross the placenta, mainly during the third trimester. However, medicines containing antibodies have been used in pregnant women for years, and it has been shown that no harmful effects are expected during pregnancy or in the fetus or newborn.
- If you are breast-feeding and receive Ig Vena, the antibodies in the medicine may pass into breast milk. Therefore, your baby may be protected against certain infections.
- Clinical experience with immunoglobulins indicates that no harmful effects on fertility are expected.
Driving and Using Machines
The ability to drive and use machines may be affected by some adverse reactions related to Ig Vena. Patients who experience adverse reactions during treatment should wait until they have resolved before driving or using machines.
Ig Vena contains Maltose and Sodium
This medicine contains 100 mg of maltose per ml.
This medicine contains 69 mg of sodium per liter. Patients on a low sodium diet should take this into consideration.
3. How to use Ig Vena
Ig Vena can only be administered in hospitals or health centers by doctors or healthcare professionals.
The dose and treatment schedule depend on the indication; your doctor will determine the appropriate dose and treatment for you.
At the start of the infusion, Ig Vena will be administered at a slow infusion rate. If you tolerate it well, your doctor may gradually increase the infusion rate.
Use in Children and Adolescents
The posology in children and adolescents (0 to 18 years) is not different from that of adults, as the posology for each indication is calculated according to body weight and adjusted to the patient's clinical results.
If you use more Ig Vena than you should
If you use more Ig Vena than you should, fluid overload and blood thickening (hyperviscosity) may occur; this can happen especially in patients at risk, particularly in elderly patients or patients with heart or kidney problems.
If you have any further questions on the use of this medicine, ask your doctor or nurse.
4. Possible Side Effects
Like all medicines, this medicine can cause side effects, although not everybody gets them.
The following side effects may occur generally after treatment with immunoglobulins:
- occasionally, chills, headache, dizziness, fever, vomiting, nausea, allergic reactions, arthralgia (joint pain), low blood pressure and moderate back pain have been reported;
- isolated cases of temporary reduction in the number of red blood cells in the blood (reversible hemolytic anemia/hemolysis);
- rarely, a sudden drop in blood pressure and, in isolated cases, hypersensitivity reactions (anaphylactic shock) have been reported, even when the patient has not shown hypersensitivity in previous administrations;
- rare cases of transient skin reactions have been observed.
- very rare cases of thromboembolic events (clot formation) that can cause myocardial infarction, stroke, pulmonary embolism and deep vein thrombosis have been reported.
- cases of non-infectious transient meningitis (reversible aseptic meningitis);
- an increase in serum creatinine levels in the blood and/or acute renal failure have been observed;
- cases of transfusion-related acute lung injury (TRALI).
The following list includes, in decreasing order of frequency, the adverse effects that have been reported after administration of Ig Vena in clinical trials and those reported after marketing of the medicine.
Frequent (may affect up to 1 in 10 people)
- Back pain
- Nausea
- Generalized weakness, fatigue, fever
- Muscle pain
- Headache, somnolence
Frequency not known (cannot be estimated from the available data)
- Non-infectious meningitis
- Destruction and consequent lack of red blood cells
- Allergic reactions and potentially fatal anaphylactic shock
- Confusional state
- Stroke, dizziness, tremor, numbness or tingling sensation in the skin or a limb
- Heart attack, bluish discoloration of the skin, tachycardia, bradycardia, irregular heartbeat
- Blood clots in major veins and blood vessels, low blood pressure, high blood pressure, paleness
- Blood clots in the main pulmonary artery, abnormal amount of fluid in the lungs, difficulty breathing with wheezing or coughing
- Vomiting, diarrhea, abdominal pain
- Rapid swelling of the skin, urticaria, redness and inflammation of the skin, rash, itching, eczema, excessive sweating
- Muscle and joint pain, back pain, neck pain, musculoskeletal stiffness
- Sudden renal failure
- Inflammation of the vein at the injection site, chills, pain or discomfort in the chest, swelling of the face, feeling of general discomfort
- High level of creatinine in the blood
Other Side Effects in Children and Adolescents
It is expected that the frequency, type and severity of adverse reactions in children will be the same as in adults.
Transient and mild glucosuria (presence of glucose in the urine) without clinical significance has been observed after administration of Ig Vena in children.
For information on viral safety, see section 2 “Before you start using Ig Vena”.
Reporting of Side Effects
If you experience any side effects, talk to your doctor or nurse, even if it is possible that they are not listed in this leaflet. You can also report side effects directly through the Spanish Medicines Agency's online platform: www.notificaRAM.es. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storage of IV Ig
Keep this medication out of sight and reach of children.
Do not use this medication after the expiration date stated on the label and on the outer carton after "EXP". The expiration date is the last day of the month indicated. Store in a refrigerator (between 2°C and 8°C).
Before use, and within the shelf life, the medication can be stored at room temperature, without exceeding 25°C, for a maximum period of 6 consecutive months.
After this period, the medication must be discarded. In any case, the medication can no longer be refrigerated if stored at room temperature.
Record the date of storage at room temperature on the outer packaging
Once the infusion container has been opened, the contents must be used immediately.
Keep the vial in the outer packaging. Do not freeze.
Do not use this medication if you notice that the solution is cloudy, contains sediment, or has changed color.
Medicines should not be disposed of via wastewater or household waste. Ask your pharmacist how to dispose of medicines that are no longer needed. This will help protect the environment.
6. Container Contents and Additional Information
Composition of Ig Vena
The active ingredient is normal human immunoglobulin.
1 ml of solution contains 50 mg of normal human immunoglobulin.
The solution contains 50 g/l of human proteins, of which at least 95% is immunoglobulin G (IgG).
The subclasses of IgG have the following distribution:
IgG1 62.1%
IgG2 34.8%
IgG3 2.5%
IgG4 0.6%
The maximum content of IgA is 50 micrograms/ml.
Produced from human donor plasma.
The other components are maltose and water for injections.
Appearance of Ig Vena and Container Contents
Ig Vena is an infusion solution, supplied in individual vials of 20, 50, 100, or 200 ml, with an integrated hanger (vial + hanger). The solution is transparent or slightly opalescent, colorless or pale yellow.
Container sizes:
Individual container presentations:
1 vial with 1 g/20 ml.
1 vial with 2.5 g/50 ml.
1 vial with 5 g/100 ml.
1 vial with 10 g/200 ml.
Multidose container presentations:
Multidose container with 2 individual containers of 1 vial with 10 g/200 ml
Multidose container with 3 individual containers of 1 vial with 10 g/200 ml
Not all container sizes may be marketed.
Marketing Authorization Holder and Manufacturer
Marketing Authorization Holder
Kedrion S.p.A. - Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca), ITALY.
Manufacturer
Kedrion S.p.A., 55027 Bolognana, Gallicano (Lucca), ITALY.
This medicinal product is authorized in the EEA Member States with the following names:
Austria | Ig Vena 50 g/l Infusion Solution |
Germany | Ig Vena 50 g/l Infusion Solution |
Greece | Ig VENA |
Italy | Ig VENA |
Poland | Ig VENA |
Portugal | Ig Vena |
Spain | Ig Vena |
Date of the last revision of this leaflet:
The following information is intended for healthcare professionals only:
Instructions for Correct Use
- Ig Vena should reach room or body temperature before administration.
- Before administration, the solution should be inspected visually for particulate matter and color changes. Do not use turbid or sediment-containing solutions.
- Normal human immunoglobulin should be administered intravenously at an initial rate of 0.46 - 0.92 ml/kg/h (10 - 20 drops per minute) for 20 - 30 minutes. In case of an adverse reaction, the administration rate should be reduced or the infusion stopped. If well tolerated, the administration rate can be gradually increased to a maximum of 1.85 ml/kg/h (40 drops/minute).
- In patients with IDP who tolerate the infusion rate of 0.92 ml/kg/h, the administration rate can be gradually increased to 2 ml/kg/h, 4 ml/kg/h, up to a maximum of 6 ml/kg/h, every 20-30 minutes and only if the patient tolerates the infusion well.
- In general, the dose and infusion rates should be established individually according to the patient's needs. Depending on body weight, dose, and the occurrence of adverse reactions, the patient may not reach the maximum infusion rate. In case of adverse reactions, the infusion should be interrupted immediately and resumed at the appropriate infusion rate for the patient.
Special Populations
In pediatric patients (0 to 18 years) and elderly patients (> 64 years), the initial administration rate should be 0.46 - 0.92 ml/kg/h (10 - 20 drops per minute) for 20 - 30 minutes. If well tolerated and depending on the patient's clinical conditions, the rate can be gradually increased to a maximum of 1.85 ml/kg/h (40 drops/minute).
Instructions for Using the Hanger
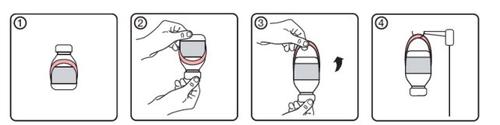
- Initial state of the vial with hanger label
- Place the vial upside down
- Activate the hanger by unfolding it from the label
- Hang the vial on the infusion support
Special Precautions
Some serious adverse reactions to the product may be due to the infusion rate.
Often, possible complications can be avoided by ensuring that:
- patients are not sensitive to normal human immunoglobulin, by slowly injecting the product at the start (administration rate 0.46 - 0.92 ml/kg/h);
- patients are closely monitored to detect any symptoms during the infusion period. In particular, patients treated for the first time with normal human immunoglobulin, patients who have changed IgIV product, or when a long period has elapsed since the previous infusion, should be monitored during the first infusion and during the first hour after the first infusion to detect possible adverse reactions. The rest of the patients should be observed for at least 20 minutes after administration.
In all patients, IgIV administration requires:
- adequate hydration before starting IgIV infusion;
- monitoring of diuresis;
- monitoring of serum creatinine levels;
- avoiding concomitant use of loop diuretics.
In case of an adverse reaction, the administration rate should be reduced or the infusion stopped.
The necessary treatment depends on the nature and intensity of the adverse reaction.
In case of shock, standard medical treatment should be followed.
Infusion Reaction
Certain adverse reactions (e.g., headache, flushing, chills, myalgia, wheezing, tachycardia, back pain, nausea, and hypotension) may be related to the infusion rate.
The recommended infusion rate should be strictly respected.
Patients should be closely monitored and carefully observed for any symptoms during the infusion period.
Adverse reactions may be more frequent:
- in patients receiving normal human immunoglobulin for the first time or, in rare cases, when the normal human immunoglobulin product is changed or when a prolonged interval has elapsed since the previous infusion.
- in patients with an untreated infection or underlying chronic inflammation.
Children and Adolescents
No specific measures or monitoring are required for the pediatric population.
No differences are expected in the pediatric population (0 to 18 years).
Thromboembolism
There is clinical evidence associating IgIV administration with the occurrence of thromboembolic events such as myocardial infarction, stroke (including stroke), pulmonary embolism, and deep vein thrombosis, which are supposed to be related to the relative increase in blood viscosity due to the high flow of immunoglobulin in patients at risk. Caution should be exercised when prescribing and administering IgIV in obese patients and in patients with pre-existing risk factors for thrombotic events (such as advanced age, hypertension, diabetes mellitus, and history of vascular disease or thrombotic events, patients with congenital or acquired thrombophilia, patients with prolonged periods of immobilization, patients with severe hypovolemia, and patients with diseases that increase blood viscosity).
In patients at risk of suffering thromboembolic adverse reactions, IgIV products should be administered at the minimum infusion rate and dose practicable.
Acute Renal Failure
Cases of acute renal failure have been reported in patients who received IgIV treatment. In most cases, risk factors such as pre-existing renal insufficiency, diabetes mellitus, hypovolemia, overweight, concomitant treatment with nephrotoxic drugs, or age over 65 years have been identified.
Renal parameters should be assessed before IgIV administration, especially in patients with a possible high risk of suffering acute renal failure, and also at appropriate intervals. In patients at risk of suffering acute renal failure, IgIV products should be administered at the minimum infusion rate and dose practicable.
In case of renal failure, consideration should be given to discontinuing IgIV treatment.
While cases of renal dysfunction and acute renal failure have been associated with the use of many authorized IgIV products containing various excipients such as sucrose, glucose, and maltose, an accumulation of cases has been observed in those containing sucrose as a stabilizer. In patients at risk, consideration should be given to using IgIV products that do not contain such excipients.
Aseptic Meningitis Syndrome (AMS)
Aseptic meningitis syndrome has been reported in association with IgIV treatment.
The syndrome usually occurs from several hours to 2 days after IgIV treatment. Cerebrospinal fluid studies usually reveal pleocytosis with several thousand cells per mm3, mainly from the granulocytic series, and elevated protein levels with several hundred mg/dl.
AMS usually occurs more frequently in association with high-dose IgIV treatments (2 g/kg).
Patients showing these signs and symptoms should undergo thorough neurological examination, including cerebrospinal fluid studies, to rule out other causes of meningitis.
Discontinuation of IgIV treatment has led to remission of AMS in several days without sequelae.
Hemolytic Anemia
IgIV products may contain blood group antibodies that can act as hemolysins and induce the in vivo coating of red blood cells with immunoglobulin, causing a positive direct antiglobulin test (Coombs test) and, in rare cases, hemolysis. Hemolytic anemia may develop as a consequence of IgIV treatment due to increased red blood cell uptake. Clinical signs and symptoms of hemolysis should be monitored in patients receiving IgIV.
Neutropenia/Leukopenia
A transient decrease in neutrophil count and/or episodes of neutropenia have been reported after IgIV treatment, sometimes severe. This usually occurs in the hours or days following IgIV administration and resolves spontaneously within 7 to 14 days.
Transfusion-Related Acute Lung Injury (TRALI)
Non-cardiogenic acute pulmonary edema [Transfusion-Related Acute Lung Injury (TRALI)] has been reported in patients who have received IgIV. TRALI is characterized by severe hypoxia, dyspnea, tachypnea, cyanosis, fever, and hypotension. TRALI symptoms usually develop during or within 6 hours of transfusion, normally within 1-2 hours. Therefore, IgIV recipients should be monitored, and IgIV administration should be stopped immediately in case of pulmonary adverse reactions. TRALI is a potentially fatal condition that requires immediate treatment in an intensive care unit.
This medicinal product contains 100 mg of maltose per ml as an excipient. Maltose interference in blood glucose analysis may result in falsely elevated glucose readings and, consequently, in the inappropriate administration of insulin, causing life-threatening hypoglycemia. Similarly, actual hypoglycemia cases could go untreated if the hypoglycemic state is masked by the falsely elevated glucose values. For more details, see the section "Blood Glucose Analysis".
Recommended Dose
Replacement therapy should be initiated and monitored under the supervision of a physician experienced in the treatment of immunodeficiencies.
Posology
The dose and dosing regimen depend on the indication. It may be necessary to individualize the dose for each patient based on the clinical response.
The dose based on body weight may require adjustment in patients with low weight or overweight.
The following dosing regimen can be used as a guideline.
Replacement Therapy in Primary Immunodeficiency Syndromes
The dosing regimen should achieve a minimum IgG concentration (measured before the next infusion) of at least 6 g/l or within the normal reference range for the age population. It takes three to six months from the start of treatment to establish equilibrium (IgG steady state). The recommended initial dose is 0.4-0.8 g/kg in a single administration, followed by at least 0.2 g/kg every three or four weeks. The dose required to achieve a minimum IgG concentration of 6 g/l is approximately 0.2-0.8 g/kg/month. The dosing interval when steady state is reached varies from 3 to 4 weeks.
Minimum IgG concentrations should be measured and evaluated along with infection incidence. To reduce the rate of bacterial infections, it may be necessary to increase the dose to achieve higher minimum concentrations.
Secondary Immunodeficiencies
The recommended dose is 0.2-0.4 g/kg every three or four weeks.
Minimum IgG concentrations should be measured and evaluated along with infection incidence. The dose should be adjusted as necessary to achieve optimal protection against infections; an increase may be necessary in patients with persistent infection; a decrease in dose may be considered when the patient remains infection-free.
Chronic Immune Thrombocytopenic Purpura
There are two alternative treatment regimens:
- 0.8 - 1 g/kg on the first day; this dose may be repeated once within 3 days;
- 0.4 g/kg administered daily for 2 to 5 days.
Treatment may be repeated in case of relapse.
Guillain-Barré Syndrome
0.4 g/kg/day for 5 days (possible repetition of the dose in case of relapse).
Kawasaki Disease
2.0 g/kg should be administered as a single dose. Patients should receive concomitant treatment with acetylsalicylic acid.
Chronic Inflammatory Demyelinating Polyneuropathy (CIDP)
Initial dose: 2 g/kg in 2-5 consecutive days.
Maintenance dose:
1 g/kg during 1-2 consecutive days every 3 weeks.
The effect of treatment should be evaluated after each cycle. If no effect is observed after 6 months, treatment should be discontinued.
If treatment is effective, long-term treatment will be subject to the physician's judgment based on the patient's response and maintenance response. The dosing and intervals may need to be adapted according to the individual course of the disease.
Multifocal Motor Neuropathy (MMN)
Initial dose: 2 g/kg administered over 2-5 consecutive days.
Maintenance dose: 1 g/kg every 2 to 4 weeks or 2 g/kg every 4 to 8 weeks.
The effect of treatment should be evaluated after each cycle. If no effect is observed after 6 months, treatment should be discontinued.
If treatment is effective, long-term treatment will be subject to the physician's judgment based on the patient's response and maintenance response. The dosing and intervals may need to be adapted according to the individual course of the disease.
The recommended doses are summarized in the following table:
Indication | Dose | Infusion Frequency |
Replacement Therapy: | ||
Primary Immunodeficiency Syndromes | Initial dose: 0.4 - 0.8 g/kg Maintenance dose: 0.2 - 0.8 g/kg | every 3 - 4 weeks |
Secondary Immunodeficiencies | 0.2 - 0.4 g/kg | every 3 - 4 weeks |
Immunomodulation: | ||
Chronic Immune Thrombocytopenic Purpura | 0.8 - 1 g/kg or 0.4 g/kg/day | on day 1, with the possibility of repeating once within 3 days for 2 - 5 days |
Guillain-Barré Syndrome | 0.4 g/kg/day | for 5 days |
Kawasaki Disease | 2 g/kg | as a single dose, associated with acetylsalicylic acid |
Chronic Inflammatory Demyelinating Polyneuropathy (CIDP) | Initial dose: 2 g/kg Maintenance dose: 1 g/kg | in divided doses over 2-5 days every 3 weeks for 1-2 days |
Multifocal Motor Neuropathy (MMN) | Initial dose: 2 g/kg Maintenance dose: 1 g/kg or 2 g/kg | over 2-5 consecutive days every 2-4 weeks or every 4-8 weeks for 2-5 days |
Pediatric Population
The posology in children and adolescents (0 to 18 years) is not different from that of adults, as the posology for each indication is calculated based on body weight and adjusted according to the clinical outcomes of the mentioned diseases.
Hepatic Impairment
No data are available to necessitate a dose adjustment.
Renal Impairment
No dose adjustment is needed unless clinically justified.
Elderly Patients
No dose adjustment is needed unless clinically justified.
CIDP
Due to the rarity of the disease and the consequent low total number of patients, only limited experience is available on the use of intravenous immunoglobulins in children with CIDP; therefore, only literature data are available. However, published data are consistent in showing that IgIV treatment is equally effective in adults and children, as is the case for established IgIV indications.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to IG VENA 50 G/L SOLUTION FOR INFUSIONDosage form: INJECTABLE PERFUSION, 100 mg/mlActive substance: immunoglobulins, normal human, for intravascular adm.Manufacturer: Instituto Grifols S.A.Prescription requiredDosage form: INJECTABLE PERFUSION, 100 mg/mlActive substance: immunoglobulins, normal human, for intravascular adm.Manufacturer: Instituto Grifols S.A.Prescription requiredDosage form: INJECTABLE PERFUSION, 100 mg/mlActive substance: immunoglobulins, normal human, for intravascular adm.Manufacturer: Instituto Grifols S.A.Prescription required
Online doctors for IG VENA 50 G/L SOLUTION FOR INFUSION
Discuss questions about IG VENA 50 G/L SOLUTION FOR INFUSION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions















