
YESCARTA 0,4 - 2 x 10⁸ células para perfusão


Como usar YESCARTA 0,4 - 2 x 10⁸ células para perfusão
Introdução
Prospecto: informação para o paciente
Yescarta0,4 – 2x108célulasdispersão para perfusão
axicabtagén ciloleucel (células T CAR + viables)
Este medicamento está sujeito a acompanhamento adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da seção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- O seu médico entregará-lhe um cartão de informação para o paciente. Leia detenidamente e siga as instruções.
- Mostre sempre o cartão de informação para o paciente ao médico ou enfermeiro que o trate ou se for ao hospital.
- Se tiver alguma dúvida, consulte o seu médico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Yescarta e para que é utilizado
- O que precisa saber antes de que lhe administrem Yescarta
- Como é administrado Yescarta
- Efeitos adversos possíveis
- Conservação de Yescarta
- Conteúdo do envase e informação adicional
1. O que é Yescarta e para que é utilizado
Yescarta é um medicamento de terapia genética que é utilizado para o tratamento de pacientes adultos com linfoma B difuso de células grandes (LBDCG) agressivo e linfoma B primário mediastínico de células grandes (LBPM) que afetam o tecido linfático (parte do sistema imunológico), que por sua vez afeta um tipo de glóbulos brancos denominados células B e outros órgãos do corpo. A acumulação excessiva nos tecidos destes glóbulos brancos anómalos é a causa dos sintomas que possa ter. É utilizado para o tratamento destas doenças quando outros medicamentos disponíveis já não resultam eficazes para o seu tratamento.
O medicamento é preparado de forma específica para si, como uma administração única dos seus próprios glóbulos brancos modificados.
2. O que precisa saber antes de que lhe administrem Yescarta
Não use Yescarta:
- se é alérgico a axicabtagén ciloleucel ou a algum dos outros componentes deste medicamento (incluídos na seção 6).
- se não pode receber um tratamento, denominado quimioterapia de linfodepleção, que reduz o número de glóbulos brancos no sangue (consulte também a seção 3, Como é administrado Yescarta)
Advertências e precauções
Yescarta é preparado a partir dos seus próprios glóbulos brancos e só lhe deve ser administrado a si (uso autólogo).
Antes de que lhe administrem Yescarta deve consultar o seu médico se:
- tem problemas do sistema nervoso (como convulsões, acidente vascular cerebral ou perda de memória).
- tem problemas renais.
- tem um número baixo de células sanguíneas (recuentos sanguíneos).
- lhe foi realizado um transplante de progenitores hematopoyéticos nos últimos 4 meses.
- tem algum problema de pulmão, coração ou tensão arterial (baixa ou elevada).
- tem sinais ou sintomas de doença do enxerto contra o hospedeiro. Isto acontece quando as células transplantadas atacam o seu corpo, causando sintomas como erupção, náuseas, vómitos, diarreia e fezes com sangue.
- observa que os sintomas do seu cancro estão a piorar. Se tem linfoma, podem incluir febre, sensação de fraqueza, suores noturnos, perda de peso repentina.
- tem uma infecção. Será tratada a infecção antes de administrar a perfusão de Yescarta.
- teve hepatite B, hepatite C ou infecção pelo vírus da imunodeficiência humana (VIH).
Se algum dos anteriores se refere a si (ou não está seguro), consulte o seu médico antes de que lhe administrem Yescarta.
Análises e comprovações
Antes de que lhe administrem Yescarta o seu médico:
- Examinará os seus pulmões e o seu coração, e comprovará a sua pressão arterial.
- Procurará sinais de infecção; qualquer infecção será tratada antes de que lhe administrem Yescarta.
- Comprovará se o seu cancro está a piorar.
- Procurará sinais de doença do enxerto contra o hospedeiro que se possam apresentar após um transplante.
- Comprovará o ácido úrico e a quantidade de células cancerosas que há no seu sangue. Isto demonstrará se é provável que desenvolva uma complicação denominada síndrome de lise tumoral. É possível que lhe sejam administrados medicamentos para ajudar a prevenir a complicação.
- Comprovará se tem hepatite B, hepatite C ou infecção pelo VIH.
- Comprovará se foi vacinado nas últimas 6 semanas ou se está a planificar que lhe administrem uma vacina nos próximos meses.
Depois de que lhe administrem Yescarta
Se notar algum dos seguintes sintomas, informe o seu médico ou enfermeiro imediatamente:
- Calafrios, cansaço extremo, fraqueza, tonturas, dor de cabeça, tosse, dificuldade para respirar ou ritmo cardíaco acelerado; estes podem ser sintomas de uma complicação denominada síndrome de libertação de citocinas. Meça a temperatura duas vezes ao dia durante 3 a 4 semanas após o tratamento com Yescarta. Se a sua temperatura for alta, consulte o seu médico de imediato.
- Convulsões, tremores ou dificuldade para falar ou alteração do falar, perda de consciência ou níveis reduzidos de consciência, confusão e desorientação, perda do equilíbrio ou da coordenação.
- Febre, que pode ser sintoma de infecção.
- Cansaço extremo, fraqueza e dificuldade para respirar, que podem ser sintomas de níveis baixos de glóbulos vermelhos.
- Hemorragia ou aparecimento de hematomas com facilidade, que podem ser sintomas de níveis baixos de um tipo de células sanguíneas denominadas plaquetas.
- Visão borrosa, perda de visão ou visão dupla, dificuldade para falar, fraqueza ou torpeza de um braço ou uma perna, uma mudança na forma de caminhar ou problemas de equilíbrio, mudanças de personalidade, mudanças no pensamento, a memória e a orientação que conduzam a confusão. Todos estes podem ser sintomas de uma doença cerebral grave e potencialmente mortal conhecida como leucoencefalopatia multifocal progressiva (LMP). Estes sintomas podem começar vários meses após o fim do tratamento e geralmente desenvolvem-se de forma lenta e gradual durante semanas ou meses. É importante que os seus familiares ou cuidadores fiquem atentos a estes sintomas, pois o senhor pode não ter consciência deles.
O seu médico comprovará os recuentos sanguíneos com frequência, pois o número de células sanguíneas e de outros componentes do sangue pode diminuir.
Não dê sangue, órgãos, tecidos ou células para transplante.
Se se encontrar em alguma destas circunstâncias (ou se não estiver seguro), consulte o seu médico ou enfermeiro antes de que lhe administrem Yescarta. É possível que o médico tenha que proporcionar-lhe atenção médica especial durante o tratamento com Yescarta.
Por vezes, pode não ser possível administrar o tratamento com Yescarta. Por exemplo:
- se a administração da perfusão de Yescarta for adiada mais de 2 semanas após ter recebido quimioterapia preparatória, pode ser que tenha que receber quimioterapia preparatória adicional.
Crianças e adolescentes
Não se deve administrar Yescarta a crianças e adolescentes menores de 18 anos.
Outros medicamentos e Yescarta
Informa o seu médico ou enfermeiro se está a tomar, tomou recentemente ou possa ter que tomar qualquer outro medicamento.
Antes de que lhe administrem Yescarta, informe o seu médico ou enfermeiro se está a tomar qualquer medicamento que debilite o sistema imunológico, como os corticosteroides, pois estes medicamentos podem interferir com o efeito de Yescarta.
Não lhe devem administrar determinadas vacinas denominadas vacinas com vírus vivos, em particular:
- Durante as 6 semanas antes de que lhe administrem o ciclo curto de quimioterapia (denominada quimioterapia de linfodepleção) para preparar o seu corpo para as células de Yescarta.
- Durante o tratamento com Yescarta.
- Depois do tratamento enquanto se recupera o sistema imunológico.
Consulte o seu médico se precisa de alguma vacina.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de que lhe administrem este medicamento. Isto deve-se ao facto de se desconhecerem os efeitos de Yescarta em mulheres grávidas ou em período de amamentação, e pode danificar o feto ou o lactente.
- Se está grávida ou acredita que possa estar grávida após o tratamento com Yescarta, consulte o seu médico de imediato.
- Ser-lhe-á realizada uma prova de gravidez antes de que comece o tratamento. Yescarta só deve ser administrado se os resultados mostrarem que não está grávida.
Fale com o seu médico sobre a gravidez se recebeu Yescarta.
Condução e uso de máquinas
Algumas pessoas podem sentir-se cansadas, tontas ou experimentar tremores após a administração de Yescarta. Se isto lhe acontece, não conduza nem utilize maquinaria pesada até pelo menos 8 semanas após a perfusão ou até que o seu médico confirme que se recuperou completamente.
Yescarta contém sódio,dimetilsulfóxido (DMSO) e gentamicina residual
Este medicamento contém 300 mg de sódio (componente principal do sal de mesa/para cozinhar) em cada bolsa para perfusão. Isto equivale a 15 % da ingestão diária máxima de sódio recomendada para um adulto.
Este medicamento contém DMSO e gentamicina residual, que podem provocar reações de tipo alérgico graves.
3. Como é administrado Yescarta
Yescarta sempre lhe será administrado por um profissional de saúde. É administrado por goteo (perfusão) numa veia (via intravenosa).
- Como Yescarta é preparado a partir dos seus próprios glóbulos brancos, serão extraídas as suas células para preparar o seu medicamento. O seu médico extrairá um pouco de sangue com um catéter colocado na sua veia (procedimento denominado leucaférese). São separados alguns glóbulos brancos do sangue e o resto do sangue é devolvido à veia. Isto pode demorar de 3 a 6 horas e pode ser necessário repetir.
- Os seus glóbulos brancos são congelados e enviados para preparar Yescarta. Por norma, demora de 3 a 4 semanas a receber o tratamento com Yescarta, mas o tempo pode variar.
Outros medicamentos administrados antes do tratamento com Yescarta
Durante os 30 a 60 minutos antes de que lhe administrem Yescarta, é possível que lhe administrem outros medicamentos. Isto serve para ajudar a prevenir reações à perfusão e febre. Estes outros medicamentos podem incluir:
- Paracetamol.
- Um antihistamínico como difenidramina.
Antes de receber Yescarta, serão administrados outros medicamentos, como quimioterapia preparatória, para que os glóbulos brancos modificados em Yescarta possam multiplicar-se no seu corpo uma vez que lhe administrem o medicamento.
O seu médico ou enfermeiro comprovarão cuidadosamente que o medicamento que lhe vai ser administrado pertence a si.
Como lhe administram Yescarta
Yescarta sempre lhe será administrado por um médico num centro médico qualificado.
- Yescarta é administrado numa dose única.
- O seu médico ou enfermeiro administrar-lhe-á uma perfusão única de Yescarta através de um catéter colocado numa veia (perfusão intravenosa) durante cerca de 30 minutos.
Só deve receber a perfusão de Yescarta num centro médico qualificado e receber alta no momento em que o seu médico considerar que está em condições para voltar para casa.
O médico pode realizar análises de sangue para detectar possíveis efeitos adversos.
Depois de que lhe administrem Yescarta
- Planeie ficar num local próximo ao hospital onde foi tratado pelo menos durante as 4 semanas posteriores à administração de Yescarta. O seu médico recomendar-lhe-á que volte ao hospital diariamente durante pelo menos 10 dias e considerará se precisa ficar hospitalizado durante os primeiros 10 dias após a perfusão. Isto é para que o seu médico possa comprovar se o tratamento está a funcionar e ajudá-lo se apresentar algum efeito adverso.
Se não for a uma consulta
Entre em contacto com o seu médico ou com o centro médico qualificado o mais breve possível para concertar outra consulta.
4. Efeitos adversos possíveis
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Efeitos adversos graves
Yescarta pode provocar efeitos adversos relacionados com o sistema imunológico ou o sistema nervoso. Yescarta também pode aumentar o risco de contrair uma infecção. Estes efeitos adversos podem ser graves ou potencialmente mortais, e até podem causar a morte.
Informa imediatamente o seu médico se tiver algum dos seguintes efeitos adversos após a administração de Yescarta, pois pode necessitar de tratamento médico urgente:
Muito frequentes (podem afetar mais de 1 em cada 10 pessoas)
- Febre, calafrios, pressão arterial baixa que pode dar lugar a sintomas como tonturas ou vahído, batimentos cardíacos rápidos, batimentos cardíacos irregulares (arritmia), nível baixo de oxigénio no sangue que pode provocar falta de ar ou dificuldade para respirar. Estes podem ser sinais de uma doença grave denominada síndrome de libertação de citocinas.
- Perda de consciência ou diminuição do nível de consciência, confusão ou pensamento desorganizado, perda de memória, dificuldade para falar ou falar arrastado, dificuldade para compreender o falar devido a alterações da função cerebral (encefalopatia). Outros sinais de tremorina involuntária (tremor), confusão súbita com agitação, desorientação, alucinações ou irritabilidade (delirio), falta de energia ou força, fraqueza muscular, dificuldade para se mover (disfunção motora).
- Sensação de calor, febre, calafrios ou tiritona, que podem ser sinais de infecção (incluindo infecção bacteriana ou viral). As infecções podem dever-se a um número anormalmente baixo de leucócitos ou a um nível baixo de anticorpos denominados “imunoglobulinas” no sangue, que ajudam a combater as infecções.
Outros efeitos secundários graves que requerem assistência médica imediata são:
Frequentes (podem afetar até 1 em cada 10 pessoas)
- Ataques (crises, incluindo crises que podem ser prolongadas e potencialmente mortais).
- Parada súbita e inesperada do coração (parada cardíaca) ou falha cardíaca
- Coágulos de sangue: os sintomas podem incluir dor no peito ou na parte superior das costas, dificuldade para respirar, tosse com sangue ou dor tipo cólica, inchaço numa só perna, pele quente e escurecida à volta da zona dolorida
- Incapacidade para respirar por si mesmo (insuficiência respiratória)
- Insuficiência renal que faz com que o seu corpo retenha líquidos
- Acumulação de líquidos nos pulmões (edema pulmonar) que pode provocar dificuldade para respirar
Pouco frequentes (podem afetar até 1 em cada 100pessoas)
- Inflamação e inchaço da medula espinal que pode causar paralisia parcial ou total das extremidades e do tronco.
Se notar algum dos efeitos adversos acima mencionados, informe o seu médico imediatamente. Não tente tratar os seus sintomas com outros medicamentos sem consultar o seu médico.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informação sobre a segurança deste medicamento.
5. Conservação de Yescarta
Esta informação está destinada apenas a médicos.
Não utilize este medicamento após a data de validade que aparece na etiqueta do conteúdo e da bolsa para perfusão.
Deve ser conservado congelado na fase vaporosa do nitrogénio líquido ≤ -150 ºC até ao momento da descongelação para uso.
Não volte a congelar.
6. Conteúdo do envase e informação adicional
Composição de Yescarta
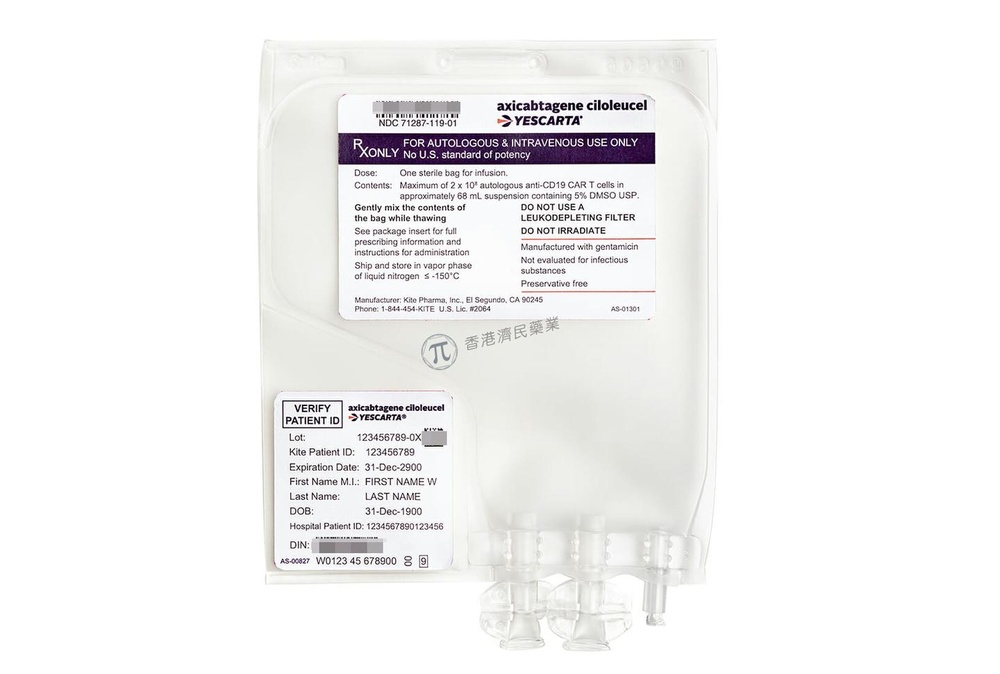
- O princípio ativo é axicabtagén ciloleucel. Cada bolsa para perfusão individual específica de cada paciente contém uma dispersão de células T CAR anti-CD19 em 68 ml, aproximadamente, para uma dose objetivo de 2 x 10^6 células T CAR positivas anti-CD19 viáveis/kg.
- Os demais componentes (excipientes) são: Cryostor CS10 (contém DMSO), cloreto de sódio, albumina humana. Ver seção 2 “Yescarta contém sódio, dimetilsulfóxido (DMSO) e gentamicina residual”
Este medicamento contém células sanguíneas humanas modificadas geneticamente.
Aspecto do produto e conteúdo do envase
Yescarta é uma dispersão para perfusão de transparente a opaca, de cor branca a vermelha, que se fornece em uma bolsa para perfusão envasada de forma individual em um contenedor metálico. Uma bolsa para uma perfusão contém 68 ml de dispersão celular, aproximadamente.
Título da autorização de comercialização e responsável pela fabricação
Kite Pharma EU B.V.
Tufsteen 1
2132 NT Hoofddorp
Países Baixos
Podem solicitar mais informações respeito a este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica Gilead Sciences Belgium SRL-BV Tel: + 32 (0) 24 01 35 50 | Lituânia Gilead Sciences Poland Sp. z o.o. Tel: + 48 22 262 8702 |
Gilead Sciences Ireland UC Teπ.: + 353 (0) 1 686 1888 | Luxemburgo Gilead Sciences Belgium SRL-BV Tél/Tel: + 32 (0) 24 01 35 50 |
República Checa Gilead Sciences s.r.o. Tel: + 420 910 871 986 | Hungria Gilead Sciences Ireland UC Tel: + 353 (0) 1 686 1888 |
Dinamarca Gilead Sciences Sweden AB Tlf: + 46 (0) 8 5057 1849 | Malta Gilead Sciences Ireland UC Tel: + 353 (0) 1 686 1888 |
Alemanha Gilead Sciences GmbH Tel: + 49 (0) 89 899890-0 | Países Baixos Gilead Sciences Netherlands B.V. Tel: + 31 (0) 20 718 36 98 |
Estônia Gilead Sciences Poland Sp. z o.o. Tel: + 48 22 262 8702 | Noruega Gilead Sciences Sweden AB Tlf: + 46 (0) 8 5057 1849 |
Grécia Gilead Sciences Ελλάς Μ.ΕΠΕ. Τηλ: + 30 210 8930 100 | Áustria Gilead Sciences GesmbH Tel: + 43 1 260 830 |
Espanha Gilead Sciences, S.L. Tel: + 34 91 378 98 30 | Polônia Gilead Sciences Poland Sp. z o.o. Tel: + 48 22 262 8702 |
França Gilead Sciences Tél: + 33 (0) 1 46 09 41 00 | Portugal Gilead Sciences, Lda. Tel: + 351 21 7928790 |
Croácia Gilead Sciences Ireland UC Tel: + 353 (0) 1 686 1888 | Romênia Gilead Sciences Ireland UC Tel: + 353 (0) 1 686 1888 |
Irlanda Gilead Sciences Ireland UC Tel: + 353 (0) 214 825 999 | Eslovênia Gilead Sciences Ireland UC Tel: + 353 (0) 1 686 1888 |
Islândia Gilead Sciences Sweden AB Sími: + 46 (0) 8 5057 1849 | República Eslovaca Gilead Sciences Slovakia s.r.o. Tel: + 421 232 121 210 |
Itália Gilead Sciences S.r.l. Tel: + 39 02 439201 | Finlândia Gilead Sciences Sweden AB Puh/Tel: + 46 (0) 8 5057 1849 |
Chipre Gilead Sciences Ελλάς Μ.ΕΠΕ. Τηλ: + 30 210 8930 100 | Suécia Gilead Sciences Sweden AB Tel: + 46 (0) 8 5057 1849 |
Letônia Gilead Sciences Poland Sp. z o.o. Tel: + 48 22 262 8702 | Reino Unido (Irlanda do Norte) Gilead Sciences Ireland UC Tel: + 44 (0) 8000 113700 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: http://www.ema.europa.eu. Também existem links para outras páginas web sobre doenças raras e tratamentos.
-----------------------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a profissionais de saúde:
É importante que leia todo o conteúdo relativo a este procedimento antes de administrar Yescarta.
Precauções que se devem tomar antes de manipular ou administrar o medicamento
No centro de administração, Yescarta deve ser transportado em envases fechados, à prova de rotura e fugas.
Este medicamento contém células sanguíneas humanas. Os profissionais de saúde que manipularem Yescarta devem tomar as precauções necessárias (usar luvas e óculos de proteção) para evitar uma possível transmissão de doenças infecciosas.
Devem ser descontaminados com um desinfetante adequado as superfícies de trabalho e os materiais que possam ter estado em contato com Yescarta.
Preparação antes da administração
- Verifique que a identificação (ID) do paciente coincide com os identificadores do paciente do contenedor de Yescarta.
- Não se deve retirar a bolsa de Yescarta do contenedor metálico se a informação da etiqueta específica do paciente não corresponde ao paciente que se vai tratar.
- Uma vez confirmada a ID do paciente, retire a bolsa de Yescarta do contenedor metálico.
- Verifique que a informação do paciente na etiqueta do contenedor metálico coincide com a da etiqueta da bolsa.
- Inspeccione a bolsa do produto para verificar a integridade do envase antes de sua descongelação. Se a bolsa estiver danificada, siga as diretrizes locais para o tratamento de resíduos de material de origem humana (ou entre em contato com Kite de forma imediata).
Descongelação
- Coloque a bolsa para perfusão em uma segunda bolsa.
- Descongele Yescarta a uma temperatura aproximada de 37 ºC, aquecendo-a ao banho-maria ou mediante descongelação a seco, até que não haja gelo visível na bolsa de perfusão. Misture suavemente o conteúdo da bolsa para eliminar os agregados celulares. No caso de continuar havendo agregados celulares visíveis, continue misturando suavemente o conteúdo da bolsa. Os agregados celulares pequenos devem ser eliminados com uma mistura manual suave. Yescarta não deve ser lavado, centrifugado e/ou re-suspensionado em um meio novo antes da perfusão. A descongelação leva entre 3 e 5 minutos, aproximadamente.
- Uma vez descongelado, Yescarta é estável a temperatura ambiente (entre 20 ºC e 25 ºC) até 3 horas. No entanto, se deve começar a perfusão de Yescarta nos 30 minutos seguintes à descongelação total.
Administração
- NÃO use um filtro de leucodepleção.
- O medicamento deve ser administrado em um centro médico qualificado, por um ou vários médicos com experiência no tratamento de neoplasias malignas hematológicas e que tenha recebido formação sobre a administração e o tratamento de pacientes tratados com Yescarta.
- Certifique-se de que pelo menos 1 dose de tocilizumab por paciente e um equipamento para emergências estejam disponíveis antes da perfusão e durante o período de recuperação. Os hospitais devem ter acesso a uma dose adicional de tocilizumab em um prazo de 8 horas após cada dose prévia. No caso excepcional de que tocilizumab não esteja disponível devido a um desabastecimento que figure no catálogo de desabastecimentos da Agência Europeia de Medicamentos, certifique-se de que estão disponíveis no centro outras medidas alternativas adequadas para tratar o SLC em lugar de tocilizumab.
- Verifique que a identidade do paciente coincida com os identificadores de paciente da bolsa para perfusão.
- Yescarta está destinado apenas para uso autólogo.
- Yescarta deve ser administrado como uma perfusão intravenosa utilizando vias intravenosas sem látex e sem um filtro de leucodepleção em um período de 30 minutos, seja por gravidade ou mediante uma bomba peristáltica.
- Durante a perfusão de Yescarta, agite suavemente a bolsa para prevenir os agregados celulares. Se deve administrar todo o conteúdo da bolsa para perfusão.
- Antes da perfusão, se deve utilizar uma solução de cloreto de sódio 9 mg/ml (0,9 %) (0,154 mmol de sódio por ml) para alimentar as vias, assim como para esvaziá-las após a perfusão.
- Uma vez que se tenha perfundido o volume total de Yescarta, se deve esvaziar a bolsa para perfusão com entre 10 e 30 ml de uma solução de cloreto de sódio 9 mg/ml (0,9%) para injeção mediante alimentação inversa com o fim de garantir a perfusão do maior número de células possível ao paciente.
Medidas a tomar em caso de exposição acidental
Em caso de exposição acidental, se devem seguir as diretrizes locais para o tratamento de material de origem humana. Se devem descontaminar com um desinfetante adequado as superfícies de trabalho e os materiais que possam ter estado em contato com Yescarta.
Precauções que se devem tomar para eliminar o medicamento
O medicamento não utilizado e todos os materiais que tenham estado em contato com Yescarta (resíduos sólidos e líquidos) devem ser tratados e eliminados como resíduos potencialmente infecciosos de acordo com as diretrizes locais para o tratamento de resíduos de material de origem humana.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a YESCARTA 0,4 - 2 x 10⁸ células para perfusãoForma farmacêutica: PERFURAÇÃO INJETÁVEL, 260 - 500 × 10^6 célulasSubstância ativa: idecabtagene vicleucelFabricante: Bristol-Myers Squibb Pharma EeigRequer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 1,1-70x10^6/1,1-70x10^6 células/mlSubstância ativa: lisocabtagene maraleucelFabricante: Bristol-Myers Squibb Pharma EeigRequer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 3,2 x 10^6 - 1 x 10^8 célulasSubstância ativa: ciltacabtagene autoleucelFabricante: Janssen-Cilag International N.VRequer receita médica
Médicos online para YESCARTA 0,4 - 2 x 10⁸ células para perfusão
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de YESCARTA 0,4 - 2 x 10⁸ células para perfusão – sujeita a avaliação médica e regras locais.





