
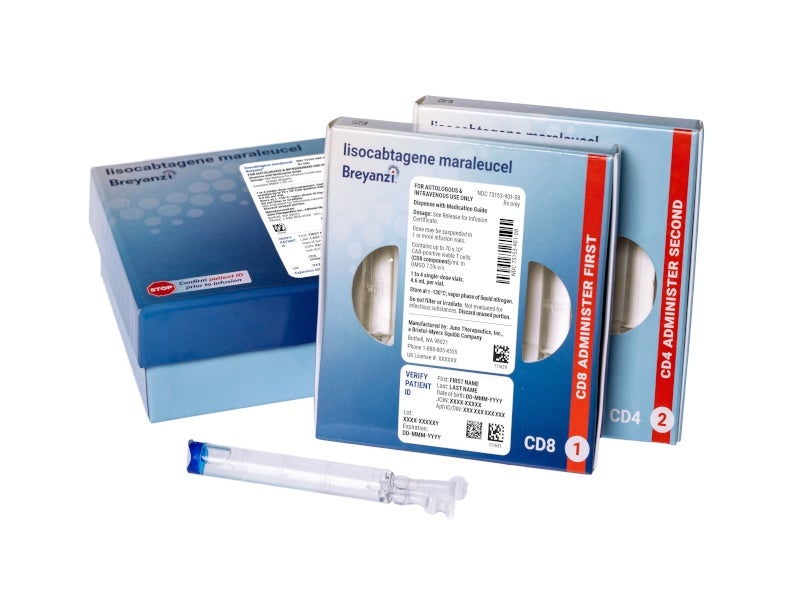
BREYANZI 1,1-70 × 10⁶ células/mL / 1,1-70 × 10⁶ células/mL Dispersão para Perfusão


Como usar BREYANZI 1,1-70 × 10⁶ células/mL / 1,1-70 × 10⁶ células/mL Dispersão para Perfusão
Introdução
Prospecto: informação para o paciente
Breyanzi 1,1-70 × 106células/ml / 1,1-70 × 106células/ml dispersão para perfusão
lisocabtagén maraleucel (linfócitos T com receptor quimérico para o antígeno [CAR] positivos
viáveis)
Este medicamento está sujeito a acompanhamento adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da seção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de que lhe administrem este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Seu médico lhe entregará uma carta para o paciente. Leia a carta atentamente e siga as instruções que contém.
- Mostre sempre a carta para o paciente ao médico ou enfermeiro quando os vir ou se for a um hospital.
- Se tiver alguma dúvida, consulte seu médico ou enfermeiro.
- Se experimentar qualquer tipo de efeito adverso, consulte seu médico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Breyanzi e para que se utiliza
- O que precisa saber antes de que lhe administrem Breyanzi
- Como se administra Breyanzi
- Efeitos adversos possíveis
- Conservação de Breyanzi
- Conteúdo do envase e informação adicional
1. O que é Breyanzi e para que se utiliza
O que é Breyanzi
Breyanzi contém o princípio ativo lisocabtagén maraleucel, um tipo de tratamento chamado “terapia celular geneticamente modificada”.
Breyanzi é elaborado a partir dos seus próprios glóbulos brancos. Isso implica extrair-lhe um pouco de sangue, separar os glóbulos brancos e enviá-los para um laboratório de modo que possam ser modificados para fabricar Breyanzi.
Para que se utiliza Breyanzi
Breyanzi é utilizado para tratar adultos com um tipo de cancro do sangue chamado linfoma que afeta o seu tecido linfático e faz com que os glóbulos brancos cresçam sem controlo. Breyanzi é utilizado para:
- o linfoma B difuso de células grandes;
- o linfoma B de alto grau;
- o linfoma B primário mediastínico de células grandes;
- o linfoma folicular.
Como funciona Breyanzi
- As células que contém Breyanzi foram modificadas geneticamente para que reconheçam as células de linfoma presentes no seu organismo.
- Quando se introduzem de novo estas células no seu sangue, reconhecerão e atacarão as células de linfoma.
2. O que precisa saber antes de que lhe administrem Breyanzi
Não deve receber Breyanzi
- se é alérgico a algum dos componentes deste medicamento (incluídos na seção 6). Se acredita que pode ser alérgico, consulte seu médico
- se não pode receber o tratamento chamado quimioterapia reductora do número de linfócitos, que reduz o número de glóbulos brancos no seu sangue (ver também a seção 3 “Como se administra Breyanzi”).
Advertências e precauções
Antes de receber Breyanzi, deve informar seu médico se
- tem problemas de pulmão ou de coração
- tem a pressão arterial baixa
- tem uma infecção ou outras afecções inflamatórias. A infecção será tratada antes de que lhe administrem Breyanzi
- recebeu um transplante de progenitores hematopoyéticos de outra pessoa nos últimos 4 meses. As células transplantadas podem atacar o próprio organismo (enfermidade injerto contra huésped), o que provoca sintomas como erupção cutânea, náuseas, vómitos, diarreia e sangue nas fezes
- nota que os sintomas do cancro estão piorando. Estes sintomas são febre, sensação de debilidade, suores noturnos ou perda de peso repentina
- sofreu de hepatite B ou C, ou infecção pelo vírus da imunodeficiência humana (VIH)
- foi vacinado nas últimas 6 semanas ou tem previsto receber uma vacina nos próximos meses. Consultar Vacinas vivasa seguir para mais informação.
Se se encontra em alguma das circunstâncias anteriores (ou não está seguro), consulte seu médico antes de que lhe administrem Breyanzi.
Os pacientes tratados com Breyanzi podem desenvolver novos tipos de cancro. Foram notificados casos de pacientes que desenvolvem cancro, que começa por um tipo de glóbulos brancos denominados linfócitos T, após o tratamento com Breyanzi e medicamentos semelhantes. Consulte seu médico se experimenta qualquer nova inflamação das glândulas (ganglios linfáticos) ou alterações na pele, como novas erupções ou bolhas.
Exames e investigações
Antes de receber Breyanzi, seu médico
- examinará seus pulmões, coração e pressão arterial
- procurará sinais de infecção (qualquer infecção será tratada antes de lhe administrar Breyanzi)
- procurará sinais da “enfermidade injerto contra huésped”, que pode ocorrer após um transplante de progenitores hematopoyéticos de outra pessoa
- far-lhe-á um exame de sangue para verificar o ácido úrico e determinar o número de células cancerosas presentes no seu sangue. Isso indicará se é propenso a apresentar uma afecção chamada síndrome de lise tumoral. Pode-lhe ser administrado medicamentos para prevenir esta afecção
- verificará se o seu cancro está piorando
- far-lhe-á um exame para detectar hepatite B e C e infecção pelo VIH.
- Após receber Breyanzi
- Se apresentar certos efeitos adversos graves, deve informar seu médico ou enfermeiro imediatamente porque pode precisar de tratamento para eles. Ver “efeitos adversos graves” na seção 4
- Seu médico far-lhe-á exames periódicos para controlar os valores do hemograma, porque o número de células sanguíneas pode diminuir
- Deve permanecer perto do centro de tratamento onde recebeu Breyanzi durante pelo menos 4 semanas. Ver seções 3 e 4
- Não deve doar sangue, órgãos, tecidos nem células para transplante.
Ser-lhe-á pedido que se inscreva num registo durante pelo menos 15 anos para compreender melhor os efeitos de Breyanzi a longo prazo.
Crianças e adolescentes
Breyanzi não deve ser administrado a crianças e adolescentes menores de 18 anos de idade.
Outros medicamentos e Breyanzi
Informar seu médico ou farmacêutico se está tomando, tomou recentemente ou pode ter que tomar qualquer outro medicamento, mesmo que se trate de medicamentos adquiridos sem receita.
Para obter informação sobre os medicamentos que lhe serão administrados antes de Breyanzi, ver seção 3.
Medicamentos que afetam o sistema imunitário
Antes de receber Breyanzi, informe seu médico ou enfermeiro se está tomando medicamentos que debilitam o sistema imunitário, por exemplo:
- corticoesteroides.
Deve fazer isso porque estes medicamentos podem reduzir o efeito de Breyanzi.
Outros medicamentos para tratar o cancro
Alguns medicamentos para o cancro podem reduzir o efeito de Breyanzi. Seu médico avaliará se precisa de outros tratamentos para o cancro.
Vacinas vivas
Não deve receber certas vacinas, nomeadamente, as chamadas vacinas vivas:
- nas 6 semanas antes de receber o ciclo breve de quimioterapia (denominada quimioterapia reductora do número de linfócitos) que é administrada com o fim de preparar o organismo para Breyanzi;
- durante o tratamento com Breyanzi;
- após o tratamento, enquanto o sistema imunitário se está recuperando.
Consulte seu médico se precisa receber alguma vacina.
Gravidez e lactação
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte seu médico antes de receber este medicamento ou a quimioterapia reductora do número de linfócitos. Os efeitos de Breyanzi nas mulheres grávidas ou em período de lactação são desconhecidos e podem ser nocivos para o bebê em gestação ou o lactente.
- Se está grávida ou acredita que possa estar grávida após o tratamento com Breyanzi, consulte seu médico imediatamente.
- Ser-lhe-á realizada uma prova de gravidez antes do início do tratamento. Breyanzi só deve ser administrado se os resultados indicam que não está grávida.
Consulte seu médico a necessidade de anticoncepcionais.
Se recebeu Breyanzi, consulte seu médico sobre a gravidez.
Condução e uso de máquinas
Não conduza, use máquinas nem participe em atividades em que deva estar alerta durante pelo menos 8 semanas após o tratamento. Breyanzi pode causar sonolência, reduzir o nível de alerta e causar confusão e convulsões (ataques epilépticos).
Breyanzi contém sódio, potássio e dimetilsulfóxido (DMSO)
Este medicamento contém até 12,5 mg de sódio (componente principal do sal de mesa/para cozinhar) em cada frasco. Isso equivale a 0,6 % da ingestão diária máxima de sódio recomendada para um adulto. Podem ser administrados até 8 frascos deste medicamento por dose, o que supõe um total de 100 mg de sódio ou um 5 % da ingestão diária máxima de sódio recomendada para um adulto.
Este medicamento contém até 0,2 mmol (ou 6,5 mg) de potássio por dose. Seu médico terá em conta este conteúdo de potássio se os seus rins não funcionam corretamente ou se segue uma dieta pobre em potássio.
Este medicamento também contém DMSO que pode provocar reações de hipersensibilidade graves.
3. Como se administra Breyanzi
Carta para o paciente
- Seu médico lhe entregará uma carta para o paciente. Leia a carta atentamente e siga as instruções que contém.
- Mostre sempre a carta para o paciente ao médico ou enfermeiro quando os vir ou se for a um hospital.
Doação de sangue para fabricar Breyanzi a partir dos seus glóbulos brancos
Breyanzi é fabricado a partir dos seus glóbulos brancos.
- Seu médico lhe extrairá sangue através de uma via (catéter) que é introduzida na veia. Alguns dos seus glóbulos brancos serão separados do seu sangue. O resto do sangue será devolvido ao organismo. Este procedimento é denominado “leucaférese” e pode durar de 3 a 6 horas. Pode ser necessário repetir o processo.
- Em seguida, os seus glóbulos brancos serão enviados para a fabricação de Breyanzi.
Outros medicamentos que receberá antes de Breyanzi
- Alguns dias antes de receber Breyanzi, será administrado um ciclo breve de quimioterapia. O objetivo desta é eliminar os seus glóbulos brancos.
- Pouco antes de receber Breyanzi, será administrado paracetamol e um medicamento antihistamínico. O objetivo destes é reduzir o risco de reações à perfusão e febre.
Como se administra Breyanzi
- Seu médico verificará que Breyanzi foi preparado a partir do seu próprio sangue, verificando que a informação relativa à identidade do paciente que aparece nas etiquetas do medicamento coincide com os seus dados.
- Breyanzi é administrado mediante perfusão (gotejamento) em uma veia através de uma via.
- Receberá perfusões das células CD8 positivas, seguidas imediatamente de perfusões das células CD4 positivas. O tempo de perfusão variará, mas normalmente será inferior a 15 minutos para cada um dos 2 tipos de células.
Após a administração de Breyanzi
- Deve permanecer perto do centro de tratamento onde recebeu Breyanzi (durante pelo menos 4 semanas).
- Durante a primeira semana após o tratamento, terá que voltar ao centro de tratamento de 2 a 3 vezes para que seu médico possa verificar se o tratamento está funcionando e ajudá-lo com qualquer possível efeito adverso. Ver seções 2 e 4.
Se faltar a uma consulta
Ligue para seu médico ou para o centro de tratamento o mais rápido possível para marcar outra consulta.
4. Efeitos adversos possíveis
Assim como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Efeitos adversos graves
Informar seu médico imediatamente se experimentar algum dos seguintes efeitos adversos após o tratamento com Breyanzi:
- febre, calafrios ou tremores, sensação de cansaço, batimentos cardíacos rápidos ou irregulares, tontura e falta de ar, que podem ser sinais de um problema grave chamado “síndrome de liberação de citocinas”
- confusão, diminuição do estado de alerta (diminuição da consciência), dificuldade para falar ou falar arrastando as palavras, tremores, sensação de ansiedade, sensação de tontura e dor de cabeça, que podem ser sintomas de uma afecção chamada síndrome de neurotoxicidade associada a células imunoefetoras (ICANS, por suas siglas em inglês) ou sinais de problemas no sistema nervoso
- sensação de calor, febre, calafrios ou tremores, que podem ser sinais de infecção.
As infecções podem ser devidas a:
- níveis baixos de glóbulos brancos, que ajudam a combater as infecções, ou
- níveis baixos de anticorpos chamados “imunoglobulinas”.
- visão borrada, perda da visão ou visão dupla, dificuldade para falar, fraqueza ou torpeza em um braço ou uma perna, uma mudança na forma de andar ou problemas de equilíbrio, mudanças de personalidade, alterações no pensamento, memória e orientação que podem provocar confusão. Todos estes podem ser sintomas de uma afecção do cérebro grave e potencialmente mortal conhecida como leucoencefalopatia multifocal progressiva (LMP). Estes sintomas podem começar vários meses após o tratamento e geralmente se desenvolvem de forma lenta e gradual ao longo de semanas ou meses. É importante que seus familiares ou cuidadores também conheçam estes sintomas, pois podem notar sintomas dos quais você não é consciente.
- sensação de muito cansaço, fraqueza ou falta de ar, que podem ser sinais de níveis baixos de glóbulos vermelhos (anemia)
- sangramento ou aparecimento de hematomas com mais facilidade, que podem ser sinais de níveis baixos de células sanguíneas chamadas plaquetas.
Informar seu médico imediatamente se experimentar algum dos efeitos adversos anteriores após ter recebido Breyanzi, pois pode precisar de tratamento médico urgente.
Outros efeitos adversos possíveis
Muito frequentes: podem afetar mais de 1 de cada 10 pessoas
- dificuldade para dormir
- pressão arterial baixa, incluindo sinais como tontura, desmaio ou alteração visual
- tosse
- náuseas ou vômitos
- diarreia ou constipação
- dor de estômago
- inchaço dos tornozelos, braços, pernas e face
- erupção cutânea
Frequentes: podem afetar até 1 de cada 10 pessoas
- problemas de equilíbrio ou para caminhar
- pressão arterial alta que pode incluir sinais como dor de cabeça muito forte, suor ou problemas para dormir
- mudanças na visão
- mudanças no sabor das coisas
- formigamento e entorpecimento nos pés ou mãos
- coágulos de sangue ou problemas de coagulação do sangue
- sangramento no intestino
- menos quantidade de urina
- reações à perfusão, como sensação de tontura, febre e falta de ar
- níveis baixos de fosfatos no sangue
- níveis baixos de oxigênio no sangue
Pouco frequentes: podem afetar até 1 de cada 100 pessoas
- um novo tipo de cancro que começa em um tipo de glóbulos brancos chamados linfócitos T (neoplasia secundária de células T)
- descomposição rápida das células cancerosas, o que produz a liberação de produtos de desintoxicação tóxicos no torrente sanguíneo: um sinal pode ser urina de cor escura com sintomas de náuseas ou dor em um lado do estômago
- afecção inflamatória grave: os sintomas podem incluir febre, erupção cutânea, aumento do fígado, do baço e dos ganglios linfáticos
- fraqueza do coração, que produz falta de ar e inchaço dos tornozelos
- líquido ao redor dos pulmões
- acidente vascular cerebral ou mini-acidente vascular cerebral
- convulsões ou crises (ataques epilépticos)
- fraqueza dos músculos da face, das cordas vocais, ou fraqueza do corpo
- inchaço do cérebro.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte seu médico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informação sobre a segurança deste medicamento.
5. Conservação de Breyanzi
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece nas caixas e na etiqueta do frasco após “CAD/EXP”.
Conservar congelado na fase de vapor do nitrogênio líquido (≤–130 °C).
6. Conteúdo do envase e informação adicional
Composição de Breyanzi
- O princípio ativo é lisocabtagén maraleucel. Cada frasco de 4,6 ml contém uma dispersão de linfócitos T-CAR positivos viáveis (componente celular CD8 positivo ou componente celular CD4 positivo) com uma concentração de 1,1 × 10^6 a 70 × 10^6 linfócitos T-CAR positivos viáveis/ml de cada componente celular. Pode haver até 4 frascos de cada um dos componentes celulares CD8 positivo ou CD4 positivo, dependendo da concentração do medicamento criopreservado.
- Os demais componentes (excipientes) são Cryostor CS10 (contém dimetilsulfóxido ou DMSO), cloreto de sódio, gluconato de sódio, acetato de sódio trihidrato, cloreto potássico, cloreto de magnésio, albumina humana, N-acetil-DL-triptófano, ácido caprílico e água para preparações injetáveis. Ver seção 2, “Breyanzi contém sódio, potássio e dimetilsulfóxido (DMSO)”.
Este medicamento contém células sanguíneas humanas modificadas geneticamente.
Aspecto do produto e conteúdo do envase
Breyanzi é uma dispersão celular para perfusão. É fornecido em frascos com uma dispersão ligeiramente opaca a opaca, de incolora a amarelada ou amarelo-parda. Cada frasco contém 4,6 ml de dispersão celular do componente celular CD8 positivo ou do componente celular CD4 positivo.
Título da autorização de comercialização
Bristol-Myers Squibb Pharma EEIG
Praça 254
Parque Empresarial Blanchardstown 2
Dublin 15, D15 T867
Irlanda
Responsável pela fabricação
Celgene Distribution B.V.
Orteliuslaan 1000
3528 BD Utrecht
Países Baixos
BMS Netherlands Operations B.V.
Francois Aragostraat 2
2342 DK Oegstgeest
Países Baixos
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica N.V. Bristol-Myers Squibb Belgium S.A. Tel: + 32 2 352 76 11 | Lituânia Swixx Biopharma UAB Tel: + 370 52 369140 |
| Luxemburgo N.V. Bristol-Myers Squibb Belgium S.A. Tel: + 32 2 352 76 11 |
República Checa Bristol-Myers Squibb spol. s r.o. Tel: + 420 221 016 111 | Hungria Bristol-Myers Squibb Kft. Tel.: + 36 1 301 9797 |
Dinamarca Bristol-Myers Squibb Dinamarca Tlf: + 45 45 93 05 06 | Malta A.M. Mangion Ltd Tel: + 356 23976333 |
Alemanha Bristol-Myers Squibb GmbH & Co. KGaA Tel: 0800 0752002 (+ 49 89 121 42 350) | Países Baixos Bristol-Myers Squibb B.V. Tel: + 31 (0)30 300 2222 |
Estônia Swixx Biopharma OÜ Tel: + 372 640 1030 | Noruega Bristol-Myers Squibb Noruega AS Tlf: + 47 67 55 53 50 |
Grécia Bristol-Myers Squibb A.E. Tel: + 30 210 6074300 | Áustria Bristol-Myers Squibb GesmbH Tel: + 43 1 60 14 30 |
Espanha Bristol-Myers Squibb, S.A. Tel: + 34 91 456 53 00 | Polônia Bristol-Myers Squibb Polska Sp. z o.o. Tel.: + 48 22 2606400 |
França Bristol-Myers Squibb SAS Tel: + 33 (0)1 58 83 84 96 | Portugal Bristol-Myers Squibb Farmacêutica Portuguesa, S.A. Tel: + 351 21 440 70 00 |
Croácia Swixx Biopharma d.o.o. Tel: + 385 1 2078 500 | Romênia Bristol-Myers Squibb Marketing Services S.R.L. Tel: + 40 (0)21 272 16 19 |
Irlanda Bristol-Myers Squibb Pharmaceuticals uc Tel: 1 800 749 749 (+ 353 (0)1 483 3625) | Eslovênia Swixx Biopharma d.o.o. Tel: + 386 1 2355 100 |
Islândia Vistor hf. Sími: + 354 535 7000 | República Eslovaca Swixx Biopharma s.r.o. Tel: + 421 2 20833 600 |
Itália Bristol-Myers Squibb S.r.l. Tel: + 39 06 50 39 61 | Finlândia Oy Bristol-Myers Squibb (Finlândia) Ab Puh/Tel: + 358 9 251 21 230 |
Chipre Bristol-Myers Squibb A.E. Tel: 800 92666 (+ 30 210 6074300) | Suécia Bristol-Myers Squibb Aktiebolag Tel: + 46 8 704 71 00 |
Letônia Swixx Biopharma SIA Tel: + 371 66164750 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu.
-------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais de saúde:
Precauções que devem ser tomadas antes de manipular ou administrar o medicamento
Breyanzi deve ser transportado dentro da instalação em recipientes fechados, à prova de ruptura e à prova de vazamento.
Este medicamento contém células sanguíneas humanas. Os profissionais de saúde que manipularem Breyanzi devem tomar as precauções adequadas (usar luvas, roupa de proteção e proteção ocular) para evitar a possível transmissão de doenças infecciosas.
Preparação prévia à administração
Antes dedescongelar os frascos
- Confirme os dados identificativos do paciente com os identificadores do paciente que figuram na caixa de envio.
- Breyanzi é composto por linfócitos T-CAR positivos viáveis formulados como componentes celulares CD8+ e CD4+ por separado; há um certificado de liberação para perfusão (RfIC) distinto para cada componente celular. Leia o RfIC (colado no interior da caixa de envio) para obter informações sobre o número de seringas que precisará e o volume a administrar dos componentes celulares CD8+ e CD4+ (as etiquetas das seringas são fornecidas com o RfIC).
- Confirme a hora de perfusão com antecedência e ajuste a hora de início da descongelação de Breyanzi de modo que esteja disponível para a perfusão quando o paciente estiver preparado.
Nota:uma vez que os frascos de linfócitos T-CAR positivos viáveis (componentes celulares CD8+ e CD4+) sejam retirados do contêiner de armazenamento de criopreservação, a descongelação deve ser realizada até o seu final e as células devem ser administradas em um prazo de 2 horas.
Descongelação dos frascos
- Confirme os dados identificativos do paciente com os identificadores do paciente que figuram na caixa exterior e no certificado de liberação para perfusão (RfIC).
- Retire a caixa do componente celular CD8+ e a caixa do componente celular CD4+ da caixa exterior.
- Abrir cada caixa interior e inspecione visualmente os frascos em busca de danos. Se os frascos estiverem danificados, entre em contato com a empresa.
- Retire com cuidado os frascos das caixas, coloque os frascos sobre um protetor ou papel absorvente e descongele a temperatura ambiente. Descongele todos os frascos ao mesmo tempo.
Cuidado para manter separados os componentes celulares CD8+ e CD4+.
Preparação da dose
- Dependendo da concentração de linfócitos T-CAR positivos viáveis de cada componente, pode ser necessário mais de um frasco de cada um dos componentes celulares CD8+ e CD4+ para completar uma dose. Deve ser preparada uma seringa distinta para cada frasco de componente celular CD8+ ou CD4+ recebido.
Nota: o volume a extrair e perfundir pode ser diferente para cada componente.
- Cada frasco de 5 ml contém um volume total extrair de 4,6 ml de linfócitos T do componente celular CD8+ ou CD4+. O RfIC para cada componente indica o volume (ml) de células que deve ser extraído em cada seringa. Use a seringa com cone Luer Lock mais pequena (1 ml a 5 ml) necessária para extrair o volume especificado de cada frasco. Não use uma seringa de 5 ml para volumes inferiores a 3 ml.
- Prepare primeiro a(s) seringa(s) do componente celular CD8+.Confirme que os identificadores do paciente que figuram na etiqueta da seringa do componente celular CD8+ coincidem com os identificadores do paciente que figuram na etiqueta do frasco do componente celular CD8+. Cole as etiquetas da seringa do componente celular CD8+ nas seringas antes de extrair o volume necessário nas seringas.
- Repita o processo para o componente celular CD4+.
Nota:é importante confirmar que o volume extraído de cada componente celular coincide com o volume especificado no certificado de liberação para perfusão (RfIC) correspondente.
A extração do volume necessário de células de cada frasco em uma seringa distinta deve ser realizada seguindo as seguintes instruções:
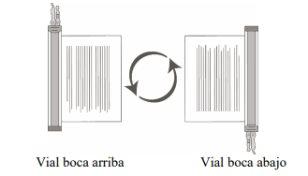
- Segure o(s) frasco(s) descongelado(s) com a boca para cima e gire-os boca para baixo/boca para cima com cuidado para misturar o produto celular. Se houver grumos, continue girando-os boca para baixo/boca para cima até que os grumos se dispersem e as células pareçam estar uniformemente ressuspendidas.
- Inspecione visualmente o(s) frasco(s) descongelado(s) em busca de danos ou vazamentos. Não use o frasco se estiver danificado ou se os grumos não se dispersarem; entre em contato com a empresa. O líquido dos frascos deve ser ligeiramente opaco a opaco, de incolor a amarelado ou amarelo-pardo.
- Retire a tampa de polialumínio (se houver) da parte inferior do frasco e limpe o septo com uma toalha com álcool. Deixe secar ao ar antes de prosseguir.
NOTA:a falta da tampa de polialumínio não afeta a esterilidade do frasco.
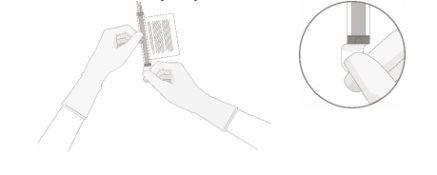
- Com o(s) frasco(s) boca para cima, corte o selo pela linha do tubo na parte superior do frasco imediatamente acima do filtro para abrir o respiradouro do frasco.
NOTA:tenha cuidado para selecionar a linha do tubo correta com o filtro. Corte SOMENTE o tubo com filtro.

- Pegue uma agulha de calibre 20, de 1-1½ polegadas, com a abertura da ponta da agulha afastada do septo do orifício de extração.
- Insira a agulha no septo em um ângulo de 45°-60° para perfurar o septo do orifício de extração.
- Aumente o ângulo da agulha gradualmente à medida que a agulha entra no frasco.
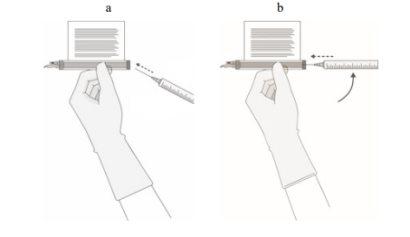
- SEM aspirar ar na seringa, extraia lentamente o volume objetivo (como especificado no certificado de liberação para perfusão [RfIC]).
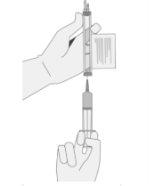
- Inspecione cuidadosamente a seringa para ver se há sinais de partículas estranhas antes de prosseguir. Se houver partículas estranhas, entre em contato com a empresa.
- Verifique se o volume do componente celular CD8+/CD4+ coincide com o volume especificado para o componente correspondente no certificado de liberação para perfusão (RfIC).
Uma vez verificado o volume, gire o frasco e a seringa para uma posição horizontal e retire a seringa/aguja do frasco.
Separe cuidadosamente a agulha da seringa e coloque o plugue na seringa.

- Continue segurando o frasco horizontalmente e volte a colocá-lo na caixa para evitar que ocorram vazamentos do frasco.
- Elimine qualquer porção não utilizada de Breyanzi.
Administração
- NÃOuse um filtro reductor do número de leucócitos.
- Certifique-se de que tocilizumab e o equipamento de emergência estejam disponíveis antes da perfusão e durante o período de recuperação. No caso excepcional de que não haja tocilizumab devido a um desabastecimento que figure no catálogo de desabastecimentos da Agência Europeia de Medicamentos, certifique-se de que se dispõe de medidas alternativas adequadas no centro, em vez de tocilizumab, para tratar o SLC.
- Antes da perfusão, confirme que a identidade do paciente coincide com os identificadores do paciente que figuram na etiqueta da seringa fornecida no RfIC correspondente.
- Uma vez que Breyanzi tenha sido introduzido nas seringas, proceda à sua administração o mais rápido possível. O tempo total desde a extração de Breyanzi do contêiner de armazenamento de criopreservação até a administração ao paciente não deve superar as 2 horas.
- Use uma solução injetável de cloreto de sódio de 9 mg/ml (0,9%) intravenoso para enxaguar todas as vias de perfusão antes e após a administração de cada componente celular CD8+ ou CD4+.
- Administre primeiro o componente celular CD8+. Todo o volume do componente celular CD8+ é administrado por via intravenosa a uma velocidade de perfusão de aproximadamente 0,5 ml/minuto, utilizando o puerto mais próximo ou o braço em Y (piggyback).
- Se for necessário mais de uma seringa para uma dose completa do componente celular CD8+, administre o volume em cada seringa consecutivamente sem deixar tempo entre a administração do conteúdo das seringas (a menos que haja uma razão clínica para reter a dose, p. ex., reação à perfusão). Uma vez administrado o componente celular CD8+, enxague a via com solução injetável de cloreto de sódio de 9 mg/ml (0,9%).
- Administre o componente celular CD4+ imediatamente após a administração do componente celular CD8+, seguindo os mesmos passos e velocidade de perfusão descritos para o componente celular CD8+. Após a administração do componente celular CD4+, enxague a via com solução injetável de cloreto de sódio de 9 mg/ml (0,9%), utilizando uma quantidade suficiente para enxaguar a via e a longitude do catéter intravenoso. O tempo de perfusão variará e normalmente será inferior a 15 minutos para cada componente.
Medidas que devem ser adotadas em caso de exposição acidental
Em caso de exposição acidental, devem ser seguidas as diretrizes locais sobre a manipulação de materiais de origem humana. As superfícies de trabalho e os materiais que possam ter estado em contato com Breyanzi devem ser descontaminados com um desinfetante adequado.
Precauções que devem ser tomadas na eliminação do medicamento
O medicamento não utilizado e todo o material que tenha estado em contato com Breyanzi (resíduos sólidos e líquidos) devem ser manipulados e eliminados como resíduos potencialmente infecciosos de conformidade com as orientações locais sobre a manipulação de material de origem humana.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a BREYANZI 1,1-70 × 10⁶ células/mL / 1,1-70 × 10⁶ células/mL Dispersão para PerfusãoForma farmacêutica: PERFURAÇÃO INJETÁVEL, 260 - 500 × 10^6 célulasSubstância ativa: idecabtagene vicleucelFabricante: Bristol-Myers Squibb Pharma EeigRequer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 3,2 x 10^6 - 1 x 10^8 célulasSubstância ativa: ciltacabtagene autoleucelFabricante: Janssen-Cilag International N.VRequer receita médicaForma farmacêutica: INJETÁVEL, 2,8×10^7 - 7,3×10^7 células/mlSubstância ativa: tabelecleucelFabricante: Pierre Fabre MedicamentRequer receita médica
Médicos online para BREYANZI 1,1-70 × 10⁶ células/mL / 1,1-70 × 10⁶ células/mL Dispersão para Perfusão
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de BREYANZI 1,1-70 × 10⁶ células/mL / 1,1-70 × 10⁶ células/mL Dispersão para Perfusão – sujeita a avaliação médica e regras locais.






