

XEOMIN 50 Unidades Pó para Solução Injectável

Pergunte a um médico sobre a prescrição de XEOMIN 50 Unidades Pó para Solução Injectável

Como usar XEOMIN 50 Unidades Pó para Solução Injectável
Introdução
Prospecto: informação para o utilizador
XEOMIN 50 unidades pó para solução injectável
XEOMIN 100 unidades pó para solução injectável
XEOMIN 200 unidades pó para solução injectável
Neurotoxina de Clostridium botulinumtipo A (150 kD), sem proteínas complexantes
Leia todo o prospecto atentamente antes de receber este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é XEOMIN e para que é utilizado
- O que precisa saber antes de começar a usar XEOMIN
- Como usar XEOMIN
- Posíveis efeitos adversos
- Conservação de XEOMIN
- Conteúdo do envase e informações adicionais
1. O que é XEOMIN e para que é utilizado
XEOMIN é um medicamento que contém a substância ativa toxina botulínica tipo A que relaxa os músculos em que é injectado ou diminui o fluxo de saliva no local de administração correspondente.
XEOMIN está indicado no tratamento dos seguintes distúrbios em adultos:
- espasmo das pálpebras (blefarospasmo) e espasmo que afeta um lado da face (espasmo hemifacial)
- torção do pescoço (tortícolis espasmódica)
- aumento da tensão muscular/rigidez muscular incontrolável em ombros, braços e/ou mãos (espasticidade do membro superior)
- salivação crónica (sialorrea) devida a distúrbios neurológicos
XEOMIN está indicado para o tratamento em crianças e adolescentes de 2 a 17 anos de idade e com um peso maior ou igual a 12 kg de:
- salivação crónica (sialorrea) devida a distúrbios neurológicos / distúrbios do desenvolvimento neurológico.
2. O que precisa saber antes de começar a usar XEOMIN
Não use XEOMIN
?? Se é alérgico à neurotoxina botulínica tipo A ou a algum dos outros componentes deste medicamento (incluídos na secção 6)
?? Se padece um distúrbio generalizado da atividade muscular (por exemplo, miastenia grave, síndrome de Lambert-Eaton)
?? Se apresenta infecção ou inflamação no local proposto para a injeção
Advertências e precauções
Os efeitos adversos podem ocorrer por injeções mal colocadas de neurotoxina botulínica tipo A que paralisam temporariamente grupos de músculos próximos. Foram produzidos relatórios muito raros de efeitos adversos que podem estar relacionados com a disseminação da toxina botulínica fora do local de injeção para produzir sintomas consistentes com os efeitos da toxina botulínica tipo A (por exemplo, fraqueza muscular excessiva, dificuldades para engolir ou ingestão acidental de alimento ou bebida nas vias respiratórias). Os pacientes que recebem as doses recomendadas podem experimentar fraqueza muscular excessiva.
Se a dose for demasiado alta ou as injeções forem demasiado frequentes, o risco de formação de anticorpos pode aumentar. A formação de anticorpos pode fazer com que falhe o tratamento com a toxina botulínica tipo A, independentemente da indicação para a qual se pretenda utilizar.
Diga ao seu médico ou farmacêutico antes de utilizar XEOMIN:
?? se padece algum tipo de distúrbio hemorrágico
?? se recebe substâncias que impedem a coagulação do sangue (por exemplo, cumarina, heparina, ácido acetilsalicílico, clopidogrel)
?? se os músculos que vão receber a injeção mostram uma fraqueza pronunciada ou diminuição do volume muscular
?? se padece esclerose lateral amiotrófica (ELA), que pode conduzir a uma perda do tecido muscular
?? se padece qualquer doença que altere a interação entre nervos e músculos esqueléticos (distúrbio neuromuscular periférico)
?? se tem ou teve dificuldades para engolir
?? se sofre ou sofreu convulsões
?? se teve problemas com injeções de toxina botulínica tipo A no passado
?? se vai sofrer alguma intervenção cirúrgica
Em caso de que experimente algum dos seguintes sintomas, entre em contacto com o seu médico e procure atenção médica imediatamente:
- dificuldade para respirar, engolir ou falar
- urticária, inchaço incluíndo inchaço da face ou da garganta, respiração sibilante,
sensação de desmaio e dificuldade para respirar (possíveis sintomas de reações alérgicas graves)
Injeções repetidas com XEOMIN
Se receber injeções repetidas com XEOMIN, o efeito pode aumentar ou diminuir. As possíveis razões são:
?? o seu facultativo pode seguir um procedimento diferente quando prepare a solução para injeção
?? diferentes intervalos de tratamento
?? injeções em outro músculo
?? variação marginal da eficácia do princípio ativo de XEOMIN
?? ausência de resposta/fracasso da terapia durante o tratamento.
Espasmo das pálpebras (blefarospasmo) e espasmo que afeta um lado da face (espasmo hemifacial)
Diga ao seu médico antes de utilizar XEOMIN se:
?? foi submetido previamente a cirurgia ocular. O seu médico tomará as devidas precauções
?? apresenta risco de desenvolver uma doença chamada glaucoma de ângulo estreito. Esta doença pode causar uma elevação da pressão interna do olho e pode conduzir a uma lesão no nervo óptico. O seu médico saberá se está em risco.
Durante o tratamento podem produzir-se pequenas manchas hemorrágicas nos tecidos moles da pálpebra. O seu médico pode limitar este risco mediante a aplicação imediata de uma compressão suave no ponto de injeção.
Depois de receber uma injeção de XEOMIN no músculo do olho pode produzir-se uma diminuição do pestanejar, que pode levar a uma exposição prolongada da parte frontal transparente do olho (córnea). Esta exposição pode produzir uma lesão da superfície e uma inflamação (ulceração da córnea).
Torsão do pescoço (tortícolis espasmódica)
Depois da injeção pode desenvolver dificuldades para engolir de grau leve a intenso, o que pode levar a problemas com a respiração e pode apresentar um risco maior de inalar líquidos ou substâncias estranhas. As substâncias estranhas nos pulmões podem produzir uma inflamação ou infecção (pneumonia). O seu médico lhe dará um tratamento especial se necessário (por exemplo, nutrição artificial).
A dificuldade para engolir pode durar de dois a três semanas após a injeção, mas foi descrito um caso em que durou até cinco meses.
Se esteve inativo durante um longo período de tempo, deverá reatar gradualmente a atividade após a injeção de XEOMIN.
Aumento da tensão muscular e/ou rigidez muscular incontrolável
XEOMIN pode ser utilizado para tratar a tensão muscular e a rigidez em diferentes partes do membro superior, por exemplo, o seu braço ou mão. XEOMIN é eficaz em combinação com os métodos de tratamento habituais. XEOMIN deveria ser utilizado juntamente com estes outros métodos.
Não é provável que este medicamento possa aumentar o arco de movimento das articulações onde o músculo que o rodeia perdeu a sua capacidade de estiramento.
Se esteve inativo durante um longo período de tempo, deverá reatar gradualmente a atividade após a injeção de XEOMIN.
Salivação crónica (sialorrea)
Alguns medicamentos (p. ex., clozapina, aripiprazol, piridostigmina) podem causar uma produção excessiva de saliva. Em primeiro lugar, deve ser considerada a possibilidade de substituição, redução ou mesmo interrupção deste medicamento antes de usar XEOMIN como tratamento para a salivação. Não foi investigado o uso de XEOMIN para reduzir a salivação induzida por medicamentos.
O seu facultativo considerará uma redução da dose se se desenvolverem casos de “boca seca” em associação com a administração de XEOMIN.
Quando se reduz o fluxo de saliva por XEOMIN, podem aparecer problemas de saúde bucal, como cáries dentárias ou podem evoluir problemas existentes. Entre em contacto com um dentista quando começar a usar XEOMIN para o tratamento da salivação crónica. Se necessário, o seu dentista pode decidir tomar medidas para a prevenção de cáries.
Crianças e adolescentes
Não utilize este medicamento em crianças menores de 2 anos, com um peso inferior a 12 kg ou em crianças e adolescentes para outros tratamentos diferentes da salivação crónica, porque o uso de XEOMIN não foi estabelecido nesta população e não é recomendado.
Outros medicamentos e XEOMIN
Informa ao seu médico ou farmacêutico se está tomando, tomou recentemente ou pudesse ter que tomar qualquer outro medicamento.
O efeito de XEOMIN pode ser potenciado:
??? por medicamentos utilizados para tratar certas doenças infecciosas (espectinomicina ou antibióticos aminoglicosídios [p. ex., neomicina, kanamicina, tobramicina])
?? por outros medicamentos que relaxam os músculos (por exemplo, os relaxantes musculares de tipo tubocurarina) Estes medicamentos são utilizados, por exemplo, para anestesia geral. Antes de se submeter a uma operação, comente ao seu anestesista se recebeu XEOMIN.
? quando se usa para o tratamento da salivação crónica: com outros medicamentos que reduzem o fluxo salival por si mesmos (p. ex., anticolinérgicos como atropina, glicopirronio ou escopolamina) ou por irradiação terapêutica na cabeça e no pescoço, incluídas as glândulas salivais. Informe ao seu médico se está a receber radioterapia ou se está planeada.
Nestes casos, XEOMIN deve ser utilizado com cuidado.
O efeito de XEOMIN pode ser reduzido pelo uso de determinados medicamentos para a malária e o reumatismo (conhecidos como aminoquinolinas).
Gravidez, lactação e fertilidade
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de que lhe administrem este medicamento.
Não deve utilizar XEOMIN durante a gravidez, a não ser que o seu médico decida que a necessidade e que o potencial benefício justificam o possível risco no feto.
Não se recomenda XEOMIN em período de lactação.
Condução e uso de máquinas
Não deve conduzir nem realizar outras atividades potencialmente perigosas se apresenta queda de pálpebras, fraqueza (astenia), fraqueza muscular, tontura ou distúrbio da visão.
Se tiver alguma dúvida, consulte o seu médico.
3. Como usar XEOMIN
XEOMIN só pode ser administrado por facultativos com o conhecimento adequado e experiência na aplicação da toxina botulínica tipo A.
O facultativo escolherá a melhor dosagem para si, frequência e número óptimo de pontos de injeção. O resultado do tratamento inicial com XEOMIN deverá ser avaliado, podendo dar lugar a um ajuste da dose até alcançar-se o efeito terapêutico desejado. Os intervalos de tratamento serão determinados pelo seu facultativo em função da sua necessidade clínica real.
Se você tem a impressão de que o efeito de XEOMIN é demasiado intenso ou demasiado débil, diga-o ao seu facultativo. Nos casos em que não se observe efeito terapêutico, deverão ser considerados outros tratamentos alternativos.
Espasmo das pálpebras (blefarospasmo) e espasmo que afeta um lado da face (espasmo hemifacial)
A dose inicial recomendada é de até 25 unidades por olho, e a dose total recomendada nas seguintes sessões de tratamento é de até 50 unidades por olho. Geralmente, o efeito inicial costuma manifestar-se a os quatro dias da injeção. O efeito de cada tratamento dura aproximadamente de 3 a 5 meses; no entanto, a duração pode ser significativamente mais longa ou mais curta. Não se recomendam tratamentos em intervalos menores de 12 semanas.
Normalmente, o tratamento usado com uma frequência superior a cada três meses não confere nenhum efeito benéfico adicional.
Se você padece espasmo que afeta um lado da sua face (espasmo hemifacial), o seu médico seguirá as recomendações do tratamento para o espasmo das pálpebras (blefarospasmo) restringido a um lado da face. O espasmo que afeta um lado da sua face (espasmo hemifacial) será tratado só na parte superior da face, já que as injeções de XEOMIN na parte inferior da face podem provocar um aumento do risco de efeitos adversos como o risco acentuado de fraqueza local.
Torsão do pescoço (tortícolis espasmódica)
A dose recomendada por cada local de injeção é de até 50 unidades, e a dose máxima para a primeira sessão de tratamento é de 200 unidades. O seu médico lhe pode administrar doses de até 300 unidades nas seguintes sessões dependendo da resposta. Geralmente, o efeito inicial costuma manifestar-se a os sete dias da injeção. O efeito de cada tratamento dura aproximadamente de 3 a 4 meses; no entanto, a duração pode ser significativamente mais longa ou mais curta. O período entre cada sessão de tratamento deverá ser por lo menos de 10 semanas.
Aumento da tensão muscular e/ou rigidez muscular incontrolável em ombros, braços ou mãos (espasticidade do membro superior)
A dose recomendada é de até 500 unidades por sessão de tratamento e não se devem administrar mais de 250 unidades nos músculos do ombro. Os pacientes informaram do início do efeito a os 4 dias do início do tratamento. Foi observada uma melhoria do tom muscular a as 4 semanas. Em geral, o efeito do tratamento durou 12 semanas. No entanto, a duração pode ser significativamente mais longa ou mais curta. O período entre cada sessão de tratamento deve ser de ao menos 12 semanas.
Salivação crónica (sialorrea, adultos)
A dose recomendada é de 100 unidades por sessão de tratamento. Não deve ser ultrapassada esta dose máxima. O período entre cada sessão de tratamento deve ser de ao menos 16 semanas.
Salivação crónica (sialorrea, crianças/adolescentes)
A dose recomendada por sessão de tratamento depende do peso corporal. A dose máxima não deve ser superior a 75 unidades. O período entre cada sessão de tratamento deve ser de ao menos 16 semanas.
Forma de administração
XEOMIN dissolvido está indicado para ser injectado no músculo (uso intramuscular) e nas glândulas salivais (uso intraglandular) (ver a informação para profissionais de saúde no final deste prospecto). Relativamente à localização das glândulas salivais em adultos, tanto os pontos de referência anatómicos como o guiado por ecografia são possíveis, no entanto, o método guiado por ecografia deveria ser o preferido por razões de eficácia. Para crianças e adolescentes deve ser empregue o método guiado por ecografia. Antes da injeção, podem ser utilizados anestésicos locais (como cremes anestésicos), sedação ou anestesia combinada com sedação.
Se lhe injectam mais XEOMIN do que precisa
Sintomas de sobredose
Os sintomas de sobredose não se observam imediatamente após a injeção e podem consistir em fraqueza geral, queda do párpado, visão dupla, dificuldades para respirar, engolir ou para falar, e paralisia dos músculos respiratórios ou dificuldades para engolir que poderiam causar pneumonia.
Medidas a seguir em casos de sobredose
No caso de que apresente sintomas de sobredose, procure atenção médica de urgência imediatamente ou peça aos seus familiares que o façam, e procure que o ingressem no hospital. Pode ser necessária a supervisão médica durante vários dias e o uso de ventilação assistida.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Efeitos adversos possíveis
Tal como todos os medicamentos, este medicamento pode causar efeitos adversos, embora nem todas as pessoas os sofram.
Por regra, os efeitos adversos são observados na primeira semana após o tratamento e são transitórios. Estes efeitos podem estar relacionados com o medicamento, técnica de injeção ou ambos. Os efeitos adversos podem restringir-se à zona circundante ao ponto de injeção (por exemplo, fraqueza muscular localizada, dor local, inflamação, formigamento (parestesia), sensação reduzida ao toque (hipoestesia), dor à palpação, inflamação (geral), inflamação do tecido mole (edema), rubor (eritema), coceira, infecção localizada, hematoma, hemorragia e/ou equimoses).
A injeção da agulha pode causar dor. Esta dor ou a ansiedade produzida pelas agulhas podem dar origem a desmaios, náuseas, tinnitus (zumbido nos ouvidos) ou uma queda da pressão arterial.
Os efeitos adversos tais como fraqueza muscular excessiva ou dificuldades para engolir podem ser causados pela relaxação dos músculos distantes ao ponto de injeção de XEOMIN. As dificuldades para engolir podem causar a inalação de corpos estranhos que dão origem a inflamação pulmonar e, em alguns casos, à morte.
Pode produzir-se uma reação alérgica com XEOMIN. Foram notificadas raramente reações alérgicas imediatas e/ou graves (anafilaxia) ou reações alérgicas ao soro do produto (doença do soro), que causam, por exemplo, dificuldade para respirar (dispnéia), urticárias ou inflamação do tecido mole (edema). Algumas dessas reações foram observadas após o uso do complexo convencional de toxina botulínica tipo A. Produziram-se quando a toxina foi administrada sozinha ou em combinação com outros medicamentos que se sabe que causam reações semelhantes. Uma reação alérgica pode causar qualquer um dos sintomas seguintes:
- dificuldade para respirar, engolir ou falar devido à inflamação da face, lábios, boca ou garganta
- inflamação das mãos, pés ou tornozelos
Se observar qualquer um desses efeitos adversos, por favor, informe ao seu médico imediatamente ou peça aos seus familiares que o façam e acuda ao serviço de urgências do seu hospital mais próximo.
Foram notificados os seguintes efeitos adversos com XEOMIN:
Espasmo das pálpebras (blefarospasmo)
Muito frequentes (podem afetar mais de 1 de cada 10 pessoas):
Queda da pálpebra (ptose)
Frequentes (podem afetar até 1 de cada 10 pessoas):
Olhos secos, visão borrada, dificuldade de visão, secura da boca, dor no local de injeção
Pouco frequentes (podem afetar até 1 de cada 100 pessoas)
Dor de cabeça, fraqueza do músculo facial (paralisia facial), visão dupla (diplopia), aumento das lágrimas, dificuldades para engolir (disfagia), fadiga, fraqueza muscular, urticárias
Espasmo que afeta um lado da face (espasmo hemifacial)
Esperam-se efeitos adversos semelhantes quando se trata o espasmo que afeta um lado da face que para o espasmo das pálpebras.
Torsão do pescoço (tortícolis espasmódica)
Muito frequentes (podem afetar mais de 1 de cada 10 pessoas):
Dificuldade para engolir (disfagia)
Frequentes (podem afetar até 1 de cada 10 pessoas):
Dor de pescoço, fraqueza muscular, dor musculoesquelética (mialgia), rigidez musculoesquelética, espasmos musculares, dor de cabeça, tontura, dor no local de injeção, fraqueza (astenia), secura da boca, náuseas, aumento de sudorese (hiperhidrose), infecção do trato respiratório superior, sensação de desmaio (presíncope)
Pouco frequentes (podem afetar até 1 de cada 100 pessoas):
Distúrbios da fala (disfonía), dificuldades para respirar (dispnéia), urticárias
O tratamento da torsão do pescoço pode causar dificuldade para engolir, com distintos graus de intensidade. Isso pode levar à inalação de materiais estranhos, que podem requerer a intervenção médica. A dificuldade para engolir pode persistir de dois a três semanas após a injeção, mas em um caso foi notificado que durou cinco meses. A dificuldade para engolir parece depender da dose.
Aumento da tensão muscular e/ou rigidez muscular incontrolável em ombros, braços ou mãos (espasticidade do membro superior)
Frequentes (podem afetar até 1 de cada 10 pessoas):
Secura da boca
Pouco frequentes (podem afetar até 1 de cada 100 pessoas):
Dor de cabeça, sensação reduzida ao toque (hipoestesia), fraqueza muscular, dor nas extremidades, fraqueza (astenia), dor musculoesquelética (mialgia), dificuldades para engolir (disfagia), náuseas
Frequência não conhecida (não pode ser estimada a partir dos dados disponíveis)
Dor no local de injeção
Salivação crônica (sialorrea) em adultos
Frequentes (podem afetar até 1 de cada 10 pessoas):
Secura da boca, dificuldades para engolir (disfagia), sensação de formigamento (parestesia)
Pouco frequentes (podem afetar até 1 de cada 100 pessoas):
Saliva densa, distúrbio da fala, distúrbio do gosto (disgeusia)
Foram notificados casos de secura da boca persistente (> 110 dias) de intensidade grave que poderiam causar complicações adicionais como inflamação das gengivas (gengivite), dificuldades para engolir e cáries.
Salivação crônica (sialorrea) em crianças/adolescentes
Pouco frequentes (podem afetar até 1 de cada 100 pessoas):
Dificuldades para engolir (disfagia)
Frequência não conhecida (não pode ser estimada a partir dos dados disponíveis):
Secura da boca, saliva densa, dor oral, cáries dentárias
Experiência após a comercialização
Foram notificadas as seguintes reações adversas sem frequência conhecida para o uso de XEOMIN desde o seu lançamento, independentemente da área de tratamento:
Sintomas semelhantes aos da gripe, contração do músculo injetado e reações de hipersensibilidade como inchaço, inflamação dos tecidos moles (edema, também distante do local de injeção), rubor, coceira, erupção cutânea (local e generalizada) e dificuldade para respirar.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de XEOMIN
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa e na etiqueta do frasco após “CAD”. A data de validade é o último dia do mês que se indica.
Frasco não aberto: Não conserve a uma temperatura superior a 25 ºC.
Solução reconstituída: Foi demonstrada a estabilidade química e física em uso durante 24 horas, a uma temperatura de 2ºC a 8 ºC.
Desde um ponto de vista microbiológico, o produto deve ser utilizado imediatamente. Se não for utilizado imediatamente, os tempos de conservação em uso e as condições prévias ao uso são responsabilidade do usuário e normalmente não devem ser superiores a 24 horas a 2ºC a 8ºC, a menos que a reconstituição tenha sido realizada em condições assépticas controladas e validadas.
Seu facultativo não deve utilizar XEOMIN se a solução tiver um aspecto turvo ou se contiver material floculado ou em partículas.
Para consultar instruções sobre eliminação, ver informações para profissionais de saúde ao final deste prospecto.
6. Conteúdo do envase e informações adicionais
Composição de XEOMIN
- O princípio ativo é neurotoxina de Clostridium botulinumtipo A (150 kD),
sem proteínas complexantes.
XEOMIN 50 unidades pó para solução injetável
Um frasco contém 50 unidades de neurotoxina de Clostridium botulinumtipo A (150 kD), sem proteínas complexantes*.
XEOMIN 100 unidades pó para solução injetável
Um frasco contém 100 unidades de neurotoxina de Clostridium botulinumtipo A (150 kD), sem proteínas complexantes*.
XEOMIN 200 unidades pó para solução injetável
Um frasco contém 200 unidades de neurotoxina de Clostridium botulinumtipo A (150 kD), sem proteínas complexantes*.
- Neurotoxina botulínica tipo A, purificada a partir de culturas de Clostridium botulinum (cepa Hall)
- Os demais componentes são: albumina humana, sacarose.
Aspecto do produto e conteúdo do envase
XEOMIN é apresentado em forma de pó para solução injetável. O pó é branco.
Quando está reconstituído, produz-se uma solução transparente e incolor.
XEOMIN 50 unidades pó para solução injetável: envases de 1, 2, 3 ou 6 frascos
XEOMIN 100 unidades pó para solução injetável: envases de 1, 2, 3, 4 ou 6 frascos
XEOMIN 200 unidades pó para solução injetável: envases de 1, 2, 3, 4 ou 6 frascos
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização
Merz Pharmaceuticals GmbH
Eckenheimer Landstr. 100
D-60318 Frankfurt/Main
Alemanha
Responsável pela fabricação
Merz Pharma GmbH & Co. KgaA
Endereço legal:
Eckenheimer Landstraße 100
60318 Frankfurt/Main
P.O. Box 11 13 53
60048 Frankfurt/Main
Alemanha
Telefone: +49-69/15 03-1
Fax: +49-69/15 03-200
Endereço de fabricação:
Ludwigstraße 22
64354 Reinheim
Alemanha
Representante local
Merz Therapeutics Iberia, S.L.U.
Avenida de Bruxelas 6
28108 Alcobendas - Madrid
Este medicamento está autorizado nos Estados-Membros do Espaço Económico Europeu com os seguintes nomes:
XEOMIN: Áustria, Bulgária, Chipre, Croácia, República Checa, Dinamarca, Estônia,
Alemanha, Grécia, Finlândia, França, Hungria, Irlanda, Islândia, Itália, Letônia,
Liechtenstein, Lituânia, Luxemburgo, Malta, Holanda, Noruega, Polônia,
Portugal, Romênia, Eslováquia, Eslovênia, Espanha, Suécia,
XEOMEEN: Bélgica
Data da última revisão deste prospecto:fevereiro 2022
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es)
__________________________________________________________________________
A seguinte informação está destinada apenas a profissionais do setor sanitário:
Instruções para a reconstituição da solução injetável:
XEOMIN é reconstituído antes de usar com solução injetável de cloreto de sódio, a uma concentração de 9 mg/ml (0,9%).
XEOMIN apenas pode ser aplicado para o seu uso pretendido de tratar um paciente em uma sessão.
Recomenda-se realizar a reconstituição do frasco e a preparação da seringa sobre toalhas de papel com revestimento plástico, para recolher qualquer material vertido. Com uma seringa, retira-se uma quantidade adequada de solução de cloreto sódio (ver o quadro de diluição). Recomenda-se para a reconstituição uma agulha de 20-27 G. Após a inserção vertical da agulha através do tampão de borracha, o solvente deve ser injetado com cuidado no frasco para evitar a formação de espuma. Descarte o frasco se o vácuo não aspirar o solvente para o interior do frasco. Separe a seringa do frasco e misture XEOMIN com o solvente removendo cuidadosamente e invertendo/girando o frasco, não agitando vigorosamente. Se for preciso, a agulha para reconstituição deve permanecer no frasco e a quantidade necessária de solução deve ser extraída com uma nova agulha estéril adequada para a injeção.
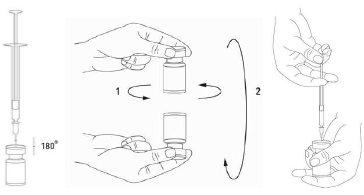
XEOMIN reconstituído é uma solução transparente e incolor.
XEOMIN não deve ser utilizado se a solução reconstituída (preparada como mencionado anteriormente) tiver um aspecto turvo ou contiver partículas.
Deve-se ter cuidado para utilizar o volume de solvente correto para a apresentação escolhida para prevenir uma sobredose acidental. Se forem utilizadas diferentes apresentações de XEOMIN como parte de um procedimento de injeção, deve-se extremar o cuidado para utilizar a quantidade correta de solvente quando se reconstitui um número determinado de unidades por 0,1 ml. A quantidade de solvente varia entre XEOMIN 50 unidades, XEOMIN 100 unidades e XEOMIN 200 unidades. Cada seringa deve ser etiquetada como corresponde.
As concentrações possíveis de XEOMIN 50, 100 e 200 unidades são indicadas no seguinte quadro:
Dose resultante (em unidades por 0,1 ml) | Solvente adicionado (cloreto de sódio 9 mg/ml (0,9%) solução injetável) | ||
Frasco com 50 unidades | Frasco com 100 unidades | Frasco com 200 unidades | |
20 unidades | 0,25 ml | 0,5 ml | 1 ml |
10 unidades | 0,5 ml | 1 ml | 2 ml |
8 unidades | 0,625 ml | 1,25 ml | 2,5 ml |
5 unidades | 1 ml | 2 ml | 4 ml |
4 unidades | 1,25 ml | 2,5 ml | 5 ml |
2,5 unidades | 2 ml | 4 ml | Não procede |
2 unidades | 2,5 ml | 5 ml | Não procede |
1,25 unidades | 4 ml | Não procede | Não procede |
Instruções para a eliminação
Deve-se descartar qualquer solução injetável que tenha sido conservada por mais de 24 horas e qualquer solução injetável não utilizada.
Procedimento a seguir para uma eliminação segura de frascos, seringas e materiais utilizados
Qualquer frasco não utilizado ou remanescente, solução no frasco e/ou seringas deve ser submetido a um processo de esterilização em autoclave. Alternativamente, o XEOMIN restante pode ser inativado adicionando uma das seguintes soluções: etanol 70%, isopropanol 50%, SDS (detergente aniônico) 0,1%, solução de hidróxido de sódio diluída (NaOH 0,1 N) ou solução de hipoclorito de sódio diluída (NaOCl pelo menos 0,1%).
Após a inativação, os frascos, seringas e materiais utilizados não devem ser esvaziados, mas devem ser descartados em contêineres apropriados e eliminados de acordo com os procedimentos locais.
Recomendações ante qualquer incidente que possa ocorrer durante a manipulação com toxina botulínica tipo A
?? Deve-se limpar qualquer resto do produto, seja usando material absorvente impregnado com qualquer uma das soluções mencionadas anteriormente no caso do pó, ou com material absorvente seco, se se tratar do produto reconstituído.
?? As superfícies contaminadas devem ser limpas com material absorvente embebido em qualquer uma das soluções anteriores e secas posteriormente.
?? Se um frasco for quebrado, proceda como mencionado anteriormente, recolhendo com cuidado os pedaços de vidro quebrados e limpando o produto derramado, evitando cortes na pele.
?? Se o produto entrar em contato com a pele, enxágue a área afetada com água abundante.
?? Se o produto entrar em contato com os olhos, enxágue com água abundante ou com uma solução oftálmica de lavagem.
?? Se o produto entrar em contato com uma ferida, corte ou pele não intacta, enxágue com água abundante e tome as medidas médicas apropriadas de acordo com a dose injetada.
Estas instruções de uso, manipulação e eliminação devem ser seguidas estritamente.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a XEOMIN 50 Unidades Pó para Solução InjectávelForma farmacêutica: INJETÁVEL, 200 U/mlSubstância ativa: botulinum toxinFabricante: Ipsen PharmaRequer receita médicaForma farmacêutica: INJETÁVEL, 125 Unidades SpeywoodSubstância ativa: botulinum toxinFabricante: Ipsen Pharma S.A.U.Requer receita médicaForma farmacêutica: INJETÁVEL, 100 unidadesSubstância ativa: botulinum toxinFabricante: Merz Pharmaceuticals GmbhRequer receita médica
Alternativas a XEOMIN 50 Unidades Pó para Solução Injectável noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a XEOMIN 50 Unidades Pó para Solução Injectável em Polónia
Alternativa a XEOMIN 50 Unidades Pó para Solução Injectável em Ukraine
Médicos online para XEOMIN 50 Unidades Pó para Solução Injectável
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de XEOMIN 50 Unidades Pó para Solução Injectável – sujeita a avaliação médica e regras locais.














