TRIAXIS SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA

Pergunte a um médico sobre a prescrição de TRIAXIS SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA

Como usar TRIAXIS SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA
Introdução
Prospecto: informação para o utilizador
TRIAXIS suspensão injetável em seringa pré-carregada
Vacina de difteria, tétano, tosse ferina (componente acelular)
(adsorvida, teor de antígenos reduzido)
Leia todo o prospecto atentamente antes de si ou seu filho serem vacinados porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas a si ou a seu filho e não deve dá-lo a outras pessoas, embora tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se si ou seu filho experimentarem efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Triaxis e para que é utilizado
- O que precisa saber antes de si ou seu filho receberem Triaxis
- Como usar Triaxis
- Possíveis efeitos adversos
- Conservação de Triaxis
- Conteúdo do envase e informação adicional
1. O que é Triaxis e para que é utilizado
Triaxis (Tdap) é uma vacina. As vacinas são utilizadas para proteger contra doenças infecciosas. As vacinas fazem com que o corpo gere a sua própria proteção contra as bactérias que provocam estas doenças infecciosas.
Esta vacina é utilizada como proteção de recorde contra a difteria, tétano e pertussis (tosse ferina) em crianças a partir de quatro anos, adolescentes e adultos após completar a pauta primária de vacinação.
O uso de Triaxis durante a gravidez permite transmitir a proteção ao/a filho/a no seio materno contra a tosse ferina durante os primeiros meses de vida.
Limitações da proteção proporcionada
Triaxis apenas prevenirá estas doenças se forem causadas pela bactéria utilizada para produzir a vacina. É possível que si ou seu filho sofram doenças semelhantes que são provocadas por outras bactérias ou vírus.
Triaxis não contém nenhuma bactéria ou vírus vivo e não pode provocar nenhuma das doenças infecciosas contra as quais protege.
Lembre-se de que nenhuma vacina pode oferecer uma proteção completa e de longa duração a todas as pessoas que se vacinam.
2. O que precisa saber antes de si ou seu filho receberem Triaxis
Para garantir que Triaxis é adequada para si ou seu filho, é importante que indique ao seu médico ou enfermeiro se algum dos pontos seguintes é aplicável a si ou seu filho. Se houver algo que não entenda, consulte com o seu médico ou enfermeiro.
Não use Triaxis se si ou seu filho
- teve uma reação alérgica:
- a vacinas de difteria, tétano ou pertussis (tosse ferina)
- a qualquer outro componente (enumerado na secção 6)
- a qualquer componente residual transferido durante a fabricação (formaldeído, glutaraldeído) que possa estar presente em pequenas quantidades.
- teve uma reação grave que afetasse o cérebro no prazo de uma semana após uma dose prévia de uma vacina contra a tosse ferina.
- tem uma doença aguda grave. A vacinação deve ser adiada até que si ou seu filho se tenham recuperado. Uma doença menor sem febre não costuma ser motivo para adiar a vacinação. O médico determinará se si ou seu filho devem receber Triaxis.
Advertências e precauções
Consulte o seu médico ou enfermeiro antes de se vacinar se si ou seu filho
- recebeu uma dose de recorde de uma vacina contra a difteria e o tétano nas últimas 4 semanas. Neste caso, si ou seu filho não devem receber Triaxis e o médico decidirá de acordo com as recomendações oficiais em que momento si ou seu filho podem receber uma injeção adicional.
- teve o síndrome de Guillain-Barré (perda temporária de mobilidade e sensibilidade em todo o corpo ou em parte dele) durante as 6 semanas após receber uma dose prévia de uma vacina com antígeno de tétano. O médico decidirá se si ou seu filho devem receber Triaxis.
- tem uma doença progressiva que afeta o cérebro/nervos ou ataques incontrolados. O médico iniciará o tratamento e realizará a vacinação quando a condição se tiver estabilizado.
- tem um sistema imunológico reduzido ou deficiente, devido a
- medicamentos (p. ex., esteroides, quimioterapia ou radioterapia).
- infecção por VIH ou SIDA.
- qualquer outra doença.
É possível que a vacina não proteja essas pessoas da mesma forma que protege todas as pessoas com um sistema imunológico saudável. Se for possível, a vacinação deve ser adiada até o final da doença ou tratamento.
- tem problemas sanguíneos que provoquem hematomas facilmente ou hemorragia durante um período prolongado após cortes menores (por exemplo, devido a um distúrbio sanguíneo como a hemofilia, a trombocitopenia ou o tratamento com medicamentos anticoagulantes).
Após qualquer injeção com agulha, ou mesmo antes, pode ocorrer desfalecimento. Por isso, informe o seu médico ou enfermeiro se si ou seu filho sofreram desfalecimento com alguma injeção prévia.
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar Triaxis, se si ou seu filho tiveram alguma reação alérgica ao látex. As seringas pré-carregadas (1,5 ml) com tampão macio contêm um derivado de látex de borracha natural (látex) que pode causar uma reação alérgica.
Outros medicamentos ou vacinas e Triaxis
Informe o seu médico, enfermeiro ou farmacêutico se si ou seu filho estão utilizando ou utilizaram recentemente ou possam ter que utilizar qualquer outro medicamento.
Devido a que Triaxis não contém nenhuma bactéria viva, é possível administrá-la ao mesmo tempo que outras vacinas ou imunoglobulinas, embora em um local de injeção diferente. Existem estudos que demonstraram que Triaxis pode ser utilizado ao mesmo tempo que alguma das seguintes vacinas: vacina contra a hepatite B, vacina contra o vírus da polio (oral ou injetável), vacina inativada contra a gripe e vacina recombinante do vírus do Papiloma Humano, respectivamente. As injeções de mais de uma vacina ao mesmo tempo serão realizadas em diferentes extremidades.
Se si ou seu filho está recebendo um tratamento médico que afeta a sangue ou sistema imunológico (como os anticoagulantes, esteroides ou quimioterapia), consulte a secção anterior "Advertências e precauções".
Gravidez, lactação e fertilidade
Consulte o seu médico ou enfermeiro se está grávida, acredita que possa estar grávida ou tem intenção de ficar grávida ou está em período de amamentação. O seu médico o ajudará a decidir se deve receber Triaxis durante a gravidez.
Condução e uso de máquinas
Não foram realizados estudos sobre os efeitos na capacidade de conduzir e utilizar máquinas. A vacina tem um efeito nulo ou insignificante sobre a capacidade para conduzir e utilizar máquinas.
3. Como usar Triaxis
Quando receberá a vacina si ou seu filho
O médico determinará se Triaxis deve ser administrada a si ou a seu filho, com base em:
- quais vacinas foram administradas a si ou a seu filho no passado.
- quantas doses de vacinas semelhantes foram administradas a si ou a seu filho no passado.
- quando foi administrada a última dose de uma vacina semelhante a si ou a seu filho.
O médico decidirá que período deve esperar entre vacinações.
Se está grávida, o médico o ajudará a decidir se deve receber Triaxis durante a gravidez.
Posologia e forma de administração
Quem administrará Triaxis?
Triaxis deve ser administrada por profissionais de saúde treinados no uso de vacinas e em uma clínica ou ambulatório com o equipamento necessário para tratar qualquer reação alérgica grave rara à vacina.
Posologia
Todos os grupos de idade para os quais está indicado receberão uma injeção (meio mililitro).
Em caso de si ou seu filho experimentarem uma lesão que requeira uma ação preventiva para a doença do tétano, o médico pode decidir dar Triaxis com ou sem imunoglobulina antitetânica.
Triaxis pode ser utilizado para vacinação de recorde. O médico o recomendará repetir a vacinação.
Forma de administração
O médico ou a enfermeira administrarão a vacina em um músculo da parte superior externa do braço (músculo deltóide).
O médico ou a enfermeira não administrarão a vacina em um vaso sanguíneo, nas nádegas ou sob a pele. Em caso de distúrbios de coagulação sanguínea, pode decidir injetar sob a pele, embora isso possa provocar mais efeitos secundários locais, incluindo um pequeno caroço sob a pele.
Se tiver dúvidas sobre o uso deste medicamento, consulte o seu médico ou farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Assim como todos os medicamentos, Triaxis pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Reações alérgicas graves
Se algum destes sintomas aparecer após abandonar o local onde si ou seu filho receberam a injeção, deve consultar um médico IMEDIATAMENTE.
- dificuldade na respiração
- coloração azul da língua ou dos lábios
- uma erupção
- inchaço do rosto ou da garganta
- tensão arterial baixa causando tonturas ou desmaio (colapso)
Quando estes sinais ou sintomas se produzem, normalmente se desenvolvem muito rapidamente após a injeção e enquanto si ou seu filho estão ainda na consulta do médico. As reações alérgicas graves são uma possibilidade muito rara (podem afetar 1 de cada 10.000 pessoas) após receber qualquer vacina.
Outros efeitos adversos
Os seguintes efeitos adversos foram observados durante os estudos clínicos realizados em grupos de idade específicos.
Em crianças de entre 4 e 6 anos
Muito frequentes (podem ocorrer em mais de 1 de cada 10 pessoas):
- perda de apetite
- dor de cabeça
- diarreia
- fadiga
- dor
- vermelhidão
- inchaço no local de injeção
Frequentes (podem ocorrer até em 1 de cada 10 pessoas):
- náuseas
- vômitos
- erupção
- dor (em todo o corpo) ou fraqueza muscular
- articulações doloridas ou inchadas
- febre
- calafrios
- distúrbio dos gânglios linfáticos na axila
Em adolescentes de entre 11 e 17 anos
Muito frequentes (podem ocorrer em mais de 1 de cada 10 pessoas):
- dor de cabeça
- diarreia
- náuseas
- dor (em todo o corpo) ou fraqueza muscular
- articulações doloridas ou inchadas
- fadiga/debilidade
- mal-estar
- calafrios
- dor
- vermelhidão e inchaço na zona em que se injetou a vacina
Frequentes (podem ocorrer até em 1 de cada 10 pessoas):
- vômitos
- erupção cutânea
- febre
- distúrbio dos gânglios linfáticos na axila
Em adultos de entre 18 e 64 anos
Muito frequentes (podem ocorrer em mais de 1 de cada 10 pessoas):
- dor de cabeça
- diarreia
- dor (em todo o corpo) ou fraqueza muscular
- fadiga/debilidade
- mal-estar
- dor
- vermelhidão e inchaço no local de injeção
Frequentes (podem ocorrer até em 1 de cada 10 pessoas):
- náuseas
- vômitos
- erupção cutânea
- dor ou articulações inchadas
- febre
- calafrios
- distúrbio dos gânglios linfáticos na axila
Foram relatados os seguintes eventos adversos adicionais nos diferentes grupos de idade recomendados durante o uso comercial de Triaxis. Não é possível calcular com precisão a frequência desses eventos adversos, pois se baseia em relatos voluntários de notificação em relação ao número estimado de pessoas vacinadas.
- Reações alérgicas/alérgicas graves (para obter informações sobre como reconhecer uma reação deste tipo, consulte o início da secção 4), cãibras ou entorpecimento, paralisia de parte ou de todo o corpo (síndrome de Guillain-Barré), inflamação dos nervos do braço (neurite braquial), perda de função no nervo que transmite o impulso aos músculos faciais (paralisia facial), ataques (convulsões), desmaios, inflamação da medula espinhal (mielite), inflamação da parte muscular do coração (miocardite), coceira (prurido), urticária, inflamação de um músculo (miosite), inchaço extenso dos membros associado a vermelhidão, calor, dor ao toque ou dor no local de injeção, hematoma, inchaço ou um caroço pequeno na zona em que se injetou a vacina.
Comunicação de efeitos adversos
Se si ou seu filho experimentarem qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode relatá-los diretamente através do Sistema Espanhol de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, si pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Triaxis
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize Triaxis após a data de validade que aparece no envase e na etiqueta após CAD/EXP. A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2°C e 8°C). Não congelar. Descartar a vacina se congelar.
Conservar a seringa no embalagem exterior para protegê-la da luz.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Dessa forma, si ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Triaxis
Os princípios ativos de cada dose (0,5 ml) da vacina são:
Toxoide diftérico não menos de 2 unidades internacionais (2 Lf)Toxoide tetânico não menos de 20 unidades internacionais (5 Lf)Antígenos de pertussis: Toxoide pertussis 2,5 microgramas Hemaglutinina filamentosa 5 microgramas Pertactina 3 microgramas Fímbrias tipos 2 e 3 5 microgramasSe adsorve em fosfato de alumínio 1,5 mg (0,33 mg de Al3+)
O fosfato de alumínio é incluído na vacina como adjuvante. Os adjuvantes são substâncias incluídas em certas vacinas para acelerar, melhorar e/ou prolongar os efeitos protectores das vacinas.
Os demais componentes são: fenoxietanol, água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Triaxis é apresentado como uma suspensão injetável em uma seringa pré-carregada (0,5 ml):
- sem agulha - embalagem de 1 ou 10
- com 1 ou 2 agulhas separadas - embalagem de 1 ou 10
- com agulha de segurança separada – embalagem de 1 ou 10
Contém um derivado de látex de borracha natural (goma de látex) no tampão no extremo da seringa pré-carregada.
Pode ser que apenas alguns tamanhos de embalagens sejam comercializados.
O aspecto normal da vacina é uma suspensão branca e turva, que pode sedimentar-se durante a conservação e formar agregados grumosos ou escamosos. Depois de uma correta agitação, o líquido tem um aspecto branco uniforme. Se houver agregados, o produto pode ser agitado novamente até obter uma suspensão uniforme.
Título da autorização de comercialização e responsável pela fabricação
O título da autorização de comercialização é:
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly
França
O responsável pela fabricação é:
Sanofi Winthrop Industrie
1541 avenue Marcel Mérieux
Marcy l´Etoile - 69280 - França
ou
Sanofi Winthrop Industrie
Voie de l’Institut – Parc Industriel d’Incarville
B.P 101
27100 Val de Reuil
França
ou
SANOFI-AVENTIS ZRT
Campona U.1 (Harbor Park ) - Budapest - 1225 - Hungria
Representante local
sanofi-aventis, S.A.
C/ Rosselló i Porcel, 21
08016 Barcelona
Espanha
Tel: +34 93 485 94 00
Este medicamento foi autorizado nos Estados-Membros do EEA sob os seguintes nomes:
Áustria, Alemanha: | Covaxis |
Bélgica, Dinamarca, Finlândia, França, Grécia, Irlanda, Itália, Luxemburgo, Noruega, Portugal, Espanha, Suécia, Países Baixos: | Triaxis |
Bulgária, Croácia, Chipre, República Checa, Estônia, Hungria, Letônia, Lituânia, Malta, Polônia, Romênia, Eslováquia, Eslovênia, Reino Unido (Irlanda do Norte): | Adacel |
Data da última revisão deste prospecto:Março 2023
A informação detalhada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
Esta informação está destinada unicamente a profissionais do setor sanitário:
Na ausência de estudos de compatibilidade, Triaxis não deve ser misturado com outros medicamentos.
Preparação para a administração
A seringa pré-carregada pode ser fornecida com um fecho Luer Lock com tampão de ponta macia (Imagem A) ou com tampão de ponta rígida (Imagem B). A seringa com a suspensão injetável deve ser inspecionada visualmente antes da administração. Em caso de partículas estranhas, fugas, ativação prematura do êmbolo ou vedação defeituosa da ponta, descarte a seringa pré-carregada. A seringa é de uso único e não deve ser reutilizada.
Instruções de uso da seringa pré-carregada Luer Lock:
Imagem A: Serinha Luer Lock com tampão de ponta macia
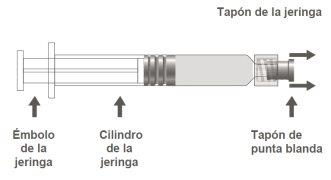
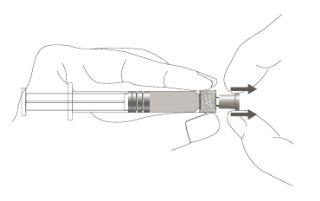
Paso 1:Segurando o tampão da seringa com uma mão (evite segurar o êmbolo ou o cilindro da seringa), retire o tampão da ponta. |
|
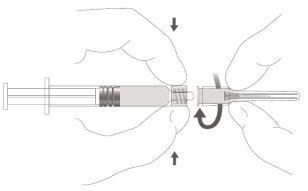
Paso 2:Paso 2:Para acoplar a agulha à seringa, gire suavemente no sentido dos ponteiros do relógio até que note uma ligeira resistência. |
|
Imagem B: Serinha Luer Lock com tampão de ponta rígida
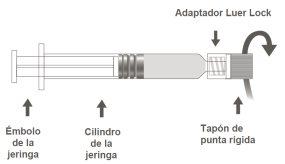
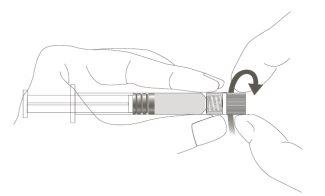
Paso 1:Segurando o adaptador Luer Lock com uma mão (evite segurar o êmbolo ou o cilindro da seringa), desrosqueie o tampão da ponta girando. |
|
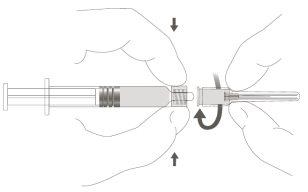
Paso 2:Para acoplar a agulha à seringa, gire suavemente a agulha no adaptador Luer Lock da seringa até sentir uma ligeira resistência. |
|
Instruções de uso da agulha de segurança com a seringa pré-carregada Luer Lock:
Siga os passos 1 e 2 anteriores para preparar a seringa Luer Lock e a agulha para sua colocação.
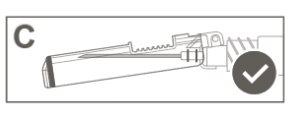
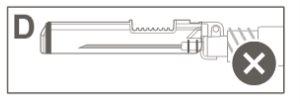
Imagem C: Agulha de segurança (Dentro do estuche) | Imagem D: Componentes da agulha de segurança (preparados para uso) |
|
|
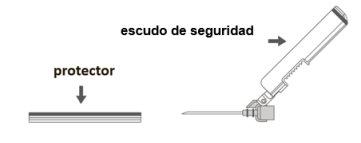
Paso 3:Extraia a funda da agulha de segurança. A agulha está coberta pelo escudo de segurança e o protetor. | |
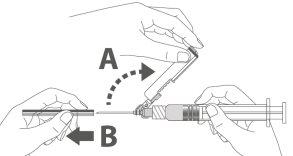
Paso 4: A:Mova o escudo de segurança afastando-o da agulha e aproximando-o da seringa no ângulo indicado. B:Retire o protetor em linha reta. |
|
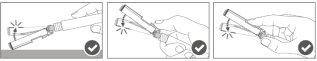
Paso 5:Uma vez finalizada a injeção, bloquee (ative) o escudo de segurança utilizando umadas três técnicas de ativação com uma única mão que se ilustram: ativação superficial, com o polegar ou com o dedo. Nota: A ativação é verificada por um «clic» audível e/ou táctil. |
|
Paso 6:Inspeccione visualmente a ativação do escudo de segurança. O escudo de segurança deve estar completamente bloqueado (ativado)como se mostra na Figura C. A figura D mostra que o escudo de segurança NÃO está completamente bloqueado (não ativado). |
|
Precaução: Não tente desbloquear (desativar) o dispositivo de segurança forçando a agulha fora do escudo de segurança. |
Qualquer medicamento não utilizado ou material de descarte deve ser eliminado de acordo com os requisitos locais.
Não se deve voltar a colocar o tampão nas agulhas.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a TRIAXIS SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDAForma farmacêutica: INJETÁVEL, -Substância ativa: pertussis, purified antigen, combinations with toxoidsFabricante: Glaxosmithkline S.A.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,5 ml dose únicaSubstância ativa: meningococcus B, multicomponent vaccineFabricante: Glaxosmithkline Vaccines S.R.L.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,5 ml dose únicaSubstância ativa: meningococcus B, multicomponent vaccineFabricante: Glaxosmithkline Vaccines S.R.L.Requer receita médica
Alternativas a TRIAXIS SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a TRIAXIS SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA em Polska
Alternativa a TRIAXIS SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA em Ukraina
Médicos online para TRIAXIS SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de TRIAXIS SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA – sujeita a avaliação médica e regras locais.