
TEVAGRASTIM 48 MU/0,8 ml SOLUÇÃO PARA INJEÇÃO OU PERFUSÃO


Como usar TEVAGRASTIM 48 MU/0,8 ml SOLUÇÃO PARA INJEÇÃO OU PERFUSÃO
Introdução
Prospecto: informação para o utilizador
Tevagrastim 30 MUI/0,5 ml solução injetável e para perfusão
Tevagrastim 48 MUI/0,8 ml solução injetável e para perfusão
filgrastim
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito somente a si, e não deve dá-lo a outras pessoas, ainda que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Tevagrastim e para que é utilizado
- O que necessita de saber antes de começar a usar Tevagrastim
- Como usar Tevagrastim
- Posíveis efeitos adversos
- Conservação de Tevagrastim
- Conteúdo do envase e informações adicionais
- Informações para auto-injeção
- Esta informação está destinada apenas a profissionais do sector sanitário
1. O que é Tevagrastim e para que é utilizado
O que é Tevagrastim
Tevagrastim é um fator de crescimento de glóbulos brancos (fator estimulante das colónias de granulócitos) e pertence a um grupo de medicamentos chamados citocinas. Os factores de crescimento são proteínas que se produzem de forma natural no corpo, mas também podem ser produzidos usando engenharia genética para uso como medicamento. Tevagrastim funciona fazendo com que a medula óssea produza mais glóbulos brancos.
Para que é utilizado Tevagrastim
Uma redução no número de glóbulos brancos (neutropenia) pode ocorrer por várias razões e torna o seu corpo menos eficaz na luta contra infecções. Tevagrastim estimula a medula óssea para produzir novos glóbulos brancos rapidamente.
Tevagrastim pode ser utilizado:
- para aumentar o número de glóbulos brancos após o tratamento com quimioterapia para ajudar a prevenir infecções;
- para aumentar o número de glóbulos brancos após um transplante de medula óssea para ajudar a prevenir infecções;
- antes da quimioterapia a doses altas para fazer com que a medula óssea produza mais células-mãe, que podem ser recolhidas e devolvidas ao seu organismo após o tratamento. Estas células podem ser recolhidas de si ou de um doador. As células-mãe voltarão então à medula óssea e produzirão células sanguíneas;
- para aumentar o número de glóbulos brancos se apresenta neutropenia crónica grave para ajudar a prevenir infecções;
- para ajudar a reduzir o risco de infecções em pacientes com infecção avançada por VIH.
2. O que necessita de saber antes de começar a usar Tevagrastim
Não use Tevagrastim
- se é alérgico ao filgrastim ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar Tevagrastim.
Informa ao seu médico antes de começar o tratamento se:
- tem anemia de células falciformes, pois este medicamento pode causar crises de células falciformes;
- tem osteoporose (doença óssea).
Informa ao seu médico imediatamente durante o tratamento com Tevagrastim se:
- tem sinais repentinos de alergia, tais como erupção, picazón ou urticária na pele, inchaço do rosto, lábios, língua ou outras partes do corpo, falta de ar, sibilância ou problemas ao respirar, pois podem ser sinais de uma reação alérgica grave (hipersensibilidade);\li>
- apresenta inchaço no rosto ou nos tornozelos, sangue na urina ou urina de cor marrom ou se nota que urina com menor frequência do que o habitual (glomerulonefrite);\li>
- apresenta dor na parte superior esquerda do abdómen (dor abdominal), dor abaixo da caixa torácica esquerda ou no extremo esquerdo do ombro (estes podem ser sintomas de um baço aumentado [esplenomegalia] ou uma possível rotura do baço);\li>
- nota sangramentos ou cardenales incomuns (estes podem ser sintomas de uma diminuição das plaquetas no sangue [trombocitopenia], com uma capacidade reduzida do sangue para coagular-se);\li>
- tem sintomas de inflamação da aorta (o vaso sanguíneo grande que transporta sangue desde o coração até o resto do corpo), isto raramente foi notificado em pacientes com cancro e em doadores sãos. Os sintomas podem incluir febre, dor abdominal, mal-estar geral, dor de costas e marcadores inflamatórios aumentados. Informe ao seu médico se apresenta estes sintomas.
Perda de resposta ao filgrastim
Se experimenta uma perda de resposta ou se não se consegue manter a resposta ao tratamento com filgrastim, o seu médico investigará as causas, incluindo se desenvolveu anticorpos que possam neutralizar a atividade do filgrastim.
Pode ser que o seu médico queira supervisioná-lo estreitamente, ver secção 4 do prospecto.
Se é um paciente com neutropenia crónica grave, pode estar em risco de desenvolver cancro do sangue (leucemia, síndrome mielodisplásico [SMD]). Fale com o seu médico sobre os riscos de desenvolver cancro do sangue e das provas que devem ser realizadas. Se desenvolve ou é provável que desenvolva cancro do sangue, não deve utilizar Tevagrastim, a menos que o seu médico o indique.
Se é um doador de células-mãe, deve ter entre 16 e 60 anos de idade.
Tenha especial cuidado com outros produtos que estimulam os glóbulos brancos
Tevagrastim pertence a um grupo de medicamentos que estimula a produção de glóbulos brancos. O seu médico deve registar sempre o produto exato que está a utilizar.
Outros medicamentos e Tevagrastim
Informa ao seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Gravidez e amamentação
Tevagrastim não foi estudado em mulheres grávidas ou em período de amamentação.
Não se recomenda Tevagrastim durante a gravidez.
É importante que informe ao seu médico se:
- está grávida ou em período de amamentação;
- acredita que possa estar grávida; ou
- tem intenção de ficar grávida
Se fica grávida durante o tratamento com Tevagrastim, informe ao seu médico. A menos que o seu médico lhe indique o contrário, deve deixar de amamentar se utiliza Tevagrastim.
Condução e uso de máquinas
A influência de Tevagrastim sobre a sua capacidade para conduzir e usar máquinas é pequena. Este medicamento pode produzir tonturas. É aconselhável esperar e ver como se sente após a administração do medicamento antes de conduzir ou manejar maquinaria.
Tevagrastim contém sorbitol
Este medicamento contém 50 mg de sorbitol em cada ml.
Para administração por via intravenosa
O sorbitol é uma fonte de frutose. Se si (ou o seu filho) padece de intolerância hereditária à frutose (IHF), uma doença genética rara, si (ou o seu filho) não devem receber este medicamento. Os pacientes com IHF não podem descompor a frutose, o que pode causar efeitos adversos graves. Consulte com o seu médico antes de receber este medicamento se si (ou o seu filho) padece de IHF ou se o seu filho não pode tomar alimentos ou bebidas doces porque lhe causam tonturas, vómitos ou efeitos desagradáveis como inchaço, cãibras no estômago ou diarreia.
Tevagrastim contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por seringa pré-carregada; isto é, é essencialmente “isento de sódio”.
3. Como usar Tevagrastim
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
Como é administrado Tevagrastim e quanto devo tomar?
Tevagrastim é administrado por via subcutânea (no tecido justo abaixo da pele) ou por via intravenosa (na veia). A dose habitual varia em função da sua doença e peso. O seu médico lhe indicará a quantidade de Tevagrastim que deve tomar.
Pacientes com transplante de medula óssea após a quimioterapia:
Normalmente receberá a primeira dose de Tevagrastim pelo menos 24 horas após a quimioterapia e pelo menos 24 horas após receber o transplante de medula óssea.
A si ou às pessoas que o atendem pode ser ensinado a administrar injeções subcutâneas para que possa continuar o tratamento em casa. No entanto, não deve tentar fazê-lo a menos que o seu profissional de saúde o tenha treinado de forma adequada.
Quanto tempo tenho que tomar Tevagrastim?
Terá que tomar Tevagrastim até que o seu recuento de glóbulos brancos seja normal. Ser-lhe-ão realizadas análises de sangue periódicas para supervisionar o número de glóbulos brancos no seu corpo. O seu médico lhe indicará quanto tempo precisa tomar Tevagrastim.
Uso em crianças
Tevagrastim é utilizado para tratar crianças que estão a receber quimioterapia ou que apresentam um recuento de glóbulos brancos baixo (neutropenia) grave. A dose administrada às crianças que estão a receber quimioterapia é a mesma que para os adultos.
Se usar mais Tevagrastim do que deve
Não aumente a dose que lhe foi prescrita pelo seu médico. Se utilizou mais Tevagrastim do que deve, contacte o seu médico ou farmacêutico o mais breve possível.
Se esquecer de usar Tevagrastim
Se esqueceu de uma injeção, ou se se injetou menos doses, contacte o seu médico o mais breve possível. Não tome uma dose dupla para compensar as doses esquecidas.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Efeitos adversos importantes
É importante que contacte o seu médico imediatamente:
- se experimenta uma reação alérgica, incluindo fraqueza, queda da pressão arterial, dificuldade em respirar, inchaço do rosto (anafilaxia), erupção cutânea, erupção cutânea com picazón (urticária), inchaço do rosto, lábios, boca, língua ou garganta (angioedema) e falta de ar (dispnéia);
- se experimenta tosse, febre e dificuldade em respirar (dispnéia), pois pode ser um sinal do síndrome de dificuldade respiratória aguda (SDRA);
- se experimenta dano renal (glomerulonefrite). Foi observado dano renal em pacientes que recebiam filgrastim. Contacte o seu médico imediatamente se observa inchaço no rosto ou nos tornozelos, sangue na urina ou urina de cor marrom, ou nota que urina com menor frequência do que o habitual;
- se experimenta algum ou uma combinação dos seguintes efeitos adversos:
- inchaço que pode estar associado com urinar com uma menor frequência, dificuldade em respirar, inchaço e sensação de plenitude abdominal e uma sensação geral de cansaço. Estes sintomas geralmente se desenvolvem rapidamente.
Estes podem ser sintomas de uma doença chamada “síndrome de fuga capilar” e que pode causar que o sangue se escape de um pequeno vaso sanguíneo para outros lugares do seu corpo e necessite de atenção médica urgente.
- se experimenta uma combinação dos seguintes sintomas:
- febre, arrepios ou sensação de muito frio, frequência cardíaca alta, confusão ou desorientação, dificuldade em respirar, dor extrema ou mal-estar e pele húmida ou suada.
Estes poderiam ser sintomas de uma afecção chamada “sepsis” (também chamada “intoxicação sanguínea”), uma infecção grave com resposta inflamatória de todo o corpo que pode ser potencialmente mortal e requer atenção médica urgente;
- se experimenta dor na parte superior esquerda do abdómen (dor abdominal), dor abaixo da caixa torácica esquerda ou dor no extremo esquerdo do ombro, pois se poderia tratar de algum problema com o seu baço (aumento do baço [esplenomegalia] ou rotura do baço);
- se está a ser tratado por neutropenia crónica grave e tem sangue na urina (hematúria). O seu médico lhe realizará análises de urina periódicas se experimenta este efeito adverso ou se se encontram proteínas na sua urina (proteinúria).
Um efeito adverso frequente do uso de Tevagrastim é dor nos músculos ou ossos (dor musculoesquelética), que se pode remediar tomando medicamentos habituais para aliviar a dor (analgésicos). Nos pacientes submetidos a um transplante de células-mãe ou de medula óssea, pode aparecer doença do enxerto contra o hospedeiro (EICH). Esta é uma reação das células do doador contra o paciente que recebe o transplante; os sinais e sintomas incluem erupções nas palmas das mãos ou nas plantas dos pés, e úlceras e feridas na boca, intestino, fígado, pele, olhos, pulmões, vagina e articulações.
Nos doadores sãos de células-mãe pode ser observado um aumento dos glóbulos brancos (leucocitose) e uma diminuição das plaquetas que pode reduzir a capacidade do sangue para coagular-se (trombocitopenia). Estes efeitos serão vigilados pelo seu médico.
Pode experimentar os seguintes efeitos adversos:
Muito frequentes(podem afetar mais de 1 de cada 10 pessoas):
- Diminuição das plaquetas, o que reduz a capacidade do sangue para coagular-se (trombocitopenia)
- Recuento baixo de glóbulos vermelhos (anemia)
- Dor de cabeça
- Diarreia
- Vómitos
- Náuseas
- Perda ou enfraquecimento do cabelo incomum (alopecia)
- Cansaço (fadiga)
- Irritação e inchaço do revestimento do tubo digestivo que vai da boca ao ânus (inflamação da mucosa)
- Febre (pirexia)
Frequentes(podem afetar até 1 de cada 10 pessoas):
- Inflamação dos pulmões (bronquite)
- Infecção do tracto respiratório superior
- Infecção do tracto urinário
- Apetite diminuído
- Problemas para dormir (insónia)
- Tonturas
- Diminuição da sensibilidade, especialmente na pele (hipestesia)
- Formigueiro ou entorpecimento das mãos ou dos pés (parestesia)
- Tensão arterial baixa (hipotensão)
- Tensão arterial alta (hipertensão)
- Tosse
- Tosse com sangue (hemoptise)
- Dor na boca e garganta (dor orofaríngea)
- Hemorragia nasal (epistaxe)
- Prisão de ventre
- Dor oral
- Aumento do tamanho do fígado (hepatomegalia)
- Erupção
- Vermelhidão da pele (eritema)
- Cãibra muscular
- Dor ao urinar (disúria)
- Dor no peito
- Dor
- Debilidade geral (astenia)
- Sensação de mal-estar (mal-estar geral)
- Inchaço nas mãos e pés (edema periférico)
- Aumento de certas enzimas no sangue
- Alterações na análise bioquímica do sangue
- Reação à transfusão
Pouco frequentes(podem afetar até 1 de cada 100 pessoas):
- Aumento dos glóbulos brancos do sangue (leucocitose)
- Reação alérgica (hipersensibilidade)
- Rejeição do transplante de medula óssea (doença do enxerto contra o hospedeiro)
- Níveis altos de ácido úrico no sangue, que podem causar gota (hiperuricemia) (ácido úrico elevado no sangue)
- Dano hepático causado pelo bloqueio das pequenas veias do fígado (doença veno-oclusiva)
- Os pulmões não funcionam como devem, causando falta de ar (insuficiência respiratória)
- Inchaço ou fluido nos pulmões (edema pulmonar)
- Inflamação dos pulmões (doença pulmonar intersticial)
- Radiografias anormais dos pulmões (infiltração pulmonar)
- Sangramento dos pulmões (hemorragia pulmonar)
- Falta de absorção de oxigénio nos pulmões (hipóxia)
- Erupção cutânea irregular (erupção maculopapular)
- Doença que faz com que os ossos percam densidade, tornando-os mais frágeis e propensos a fracturas (osteoporose)
- Reação no local de injeção
Raros(podem afetar até 1 de cada 1.000 pessoas):
- Dor intensa nos ossos, peito, intestinos ou articulações (anemia de células falciformes com crise)
- Reações alérgicas repentinas e que podem pôr em perigo a vida (reação anafiláctica)
- Inchaço e dor nas articulações, semelhante à gota (pseudogota)
- Uma alteração na forma como o seu corpo regula os fluidos corporais que pode resultar em inchaço (alterações do volume de fluidos)
- Inflamação dos vasos sanguíneos da pele (vasculite cutânea)
- Úlceras dolorosas, inflamadas e de cor vermelha escura nas extremidades e, por vezes, no rosto e no pescoço que cursam com febre (síndrome de Sweet)
- Piora da artrite reumatoide
- Alterações incomuns na urina
- Diminuição da densidade óssea
- Inflamação da aorta (o vaso sanguíneo grande que transporta sangue desde o coração até o resto do corpo), ver secção 2
Comunicação de efeitos adversos
Se experimenta qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Tevagrastim
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa e na seringa pré-carregada após EXP. A data de validade é o último dia do mês que se indica.
Conservar na geladeira (entre 2 ºC e 8 ºC).
Dentro do seu período de validade e para uso ambulatorial, o medicamento pode ser retirado da geladeira (2 ºC – 8 ºC) e armazenado a uma temperatura de até 25 ºC durante um período único de até 4 dias. Se o medicamento não foi utilizado nestes 4 dias, deve ser devolvido à geladeira (2 ºC – 8 ºC) até à data de validade. Devem ser eliminadas as seringas armazenadas a mais de 8 ºC durante mais de 4 dias.
Não utilize este medicamento se observar turbidez ou partículas no interior.
Os medicamentos não devem ser jogados fora pelos esgotos. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Tevagrastim
- O princípio ativo é filgrastim. Cada ml de solução injetável e para perfusão contém 60 milhões de unidades internacionais (MUI) (600 microgramas) de filgrastim.
Tevagrastim 30 MUI/0,5 ml: cada seringa pré-carregada contém 30 milhões de unidades internacionais [MUI] (300 microgramas) de filgrastim em 0,5 ml de solução.
Tevagrastim 48 MUI/0,8 ml: cada seringa pré-carregada contém 48 milhões de unidades internacionais [MUI] (480 microgramas) de filgrastim em 0,8 ml de solução.
- Os demais componentes são: hidróxido de sódio, ácido acético glacial, sorbitol, polissorbato 80, água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Tevagrastim é uma solução injetável e para perfusão em uma seringa pré-carregada com ou sem dispositivo de segurança. Tevagrastim é uma solução transparente e incolor. Cada seringa pré-carregada contém 0,5 ml ou 0,8 ml de solução.
Tevagrastim é fornecido em envases de 1, 5 ou 10 seringas pré-carregadas ou em envases múltiplos que contêm 10 seringas pré-carregadas (2 envases de 5) com agulha de injeção e com ou sem protetor de segurança para a agulha. Pode que nem todos os formatos sejam comercializados.
Título da autorização de comercialização
TEVA GmbH
Graf-Arco-Strasse 3
89079 Ulm
Alemanha
Responsável pela fabricação
Teva Pharma B.V.
Swensweg 5
2031 GA Haarlem
Países Baixos
Merckle GmbH
Graf-Arco-Straße 3
89079 Ulm
Alemanha
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica/Bélgica/Bélgica Teva Pharma Belgium N.V./S.A./AG Tel: +32 38207373 | Lituânia UAB Teva Baltics Tel: +370 52660203 |
| Luxemburgo/Luxemburgo Teva Pharma Belgium N.V./S.A./AG Bélgica/Bélgica Tel: +32 38207373 |
República Tcheca Teva Pharmaceuticals CR, s.r.o. Tel: +420 251007111 | Hungria Teva Gyógyszergyár Zrt. Tel: +36 12886400 |
Dinamarca Teva Denmark A/S Tlf: +45 44985511 | Malta Teva Pharmaceuticals Ireland Irlanda Tel: +44 2075407117 |
Alemanha TEVA GmbH Tel: +49 73140208 | Países Baixos Teva Nederland B.V. Tel: +31 8000228400 |
Estônia UAB Teva Baltics Eesti filial Tel: +372 6610801 | Noruega Teva Norway AS Tlf: +47 66775590 |
Grécia TEVA HELLAS Α.Ε. Τηλ: +30 2118805000 | Áustria ratiopharm Arzneimittel Vertriebs-GmbH Tel: +43 1970070 |
Espanha Teva Pharma, S.L.U. Tel: +34 913873280 | Polônia Teva Pharmaceuticals Polska Sp. z o.o. Tel: +48 223459300 |
França Teva Santé Tél: +33 155917800 | Portugal Teva Pharma - Produtos Farmacêuticos, Lda. Tel: +351 214767550 |
Croácia Pliva Hrvatska d.o.o. Tel: +385 13720000 | Romênia Teva Pharmaceuticals S.R.L. Tel: +40 212306524 |
Irlanda Teva Pharmaceuticals Ireland Tel: +44 2075407117 | Eslovênia Pliva Ljubljana d.o.o. Tel: +386 15890390 |
Islândia Teva Pharma Iceland ehf. Sími: +354 5503300 | República Eslovaca TEVA Pharmaceuticals Slovakia s.r.o. Tel: +421 257267911 |
Itália Teva Italia S.r.l. Tel: +39 028917981 | Finlândia Teva Finland Oy Puh/Tel: +358 201805900 |
Chipre TEVA HELLAS Α.Ε. Ελλáδα Τηλ: +30 2118805000 | Suécia Teva Sweden AB Tel: +46 42121100 |
Letônia UAB Teva Baltics filiale Latvija Tel: +371 67323666 | Reino Unido (Irlanda do Norte) Teva Pharmaceuticals Ireland Irlanda Tel: +44 2075407117 |
Data da última revisão deste prospecto:
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
- Informação para auto-injeção
Esta seção contém informações sobre como administrar a si mesmo uma injeção de Tevagrastim. É importante que não tente administrar uma injeção sem ter recebido o curso necessário pelo seu médico ou enfermeiro. Se não tiver certeza de poder se injetar ou se tiver alguma dúvida, consulte seu médico ou enfermeiro.
Como auto-injetar Tevagrastim
Deverá injetar no tecido justo abaixo da pele. Isso é conhecido como injeção subcutânea. A injeção deverá ser administrada todos os dias aproximadamente à mesma hora.
Equipamento necessário para a administração
Para a administração da injeção subcutânea, é necessário o seguinte:
- uma seringa pré-carregada de Tevagrastim,
- algodão ou similar com álcool.
O que devo fazer antes de me administrar uma injeção subcutânea de Tevagrastim
- Procure administrar a injeção aproximadamente à mesma hora todos os dias.
- Retire a seringa pré-carregada de Tevagrastim da geladeira.
- Verifique a data de validade que indica a seringa pré-carregada (EXP). Não a use se a data for superior ao último dia do mês que aparece.
- Verifique a aparência de Tevagrastim. Deve ser um líquido transparente e incolor. Se houver partículas no interior, não deve usá-lo.
- Para uma injeção mais confortável, deixe a seringa pré-carregada descansar durante 30 minutos à temperatura ambiente ou segure a seringa pré-carregada com suavidade em suas mãos durante alguns minutos. Não aqueça Tevagrastim de outra forma (por exemplo, não o aqueça em um micro-ondas ou em água quente)
- Nãoretire a tampa da seringa até que esteja pronto para a injeção
- Lave as mãos cuidadosamente.
- Encontre um local confortável e bem iluminado e coloque tudo o que é necessário ao alcance (a seringa pré-carregada de Tevagrastim e o algodão).
Como devo preparar minha injeção de Tevagrastim
Antes de injetar Tevagrastim, é necessário:
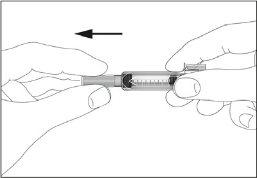
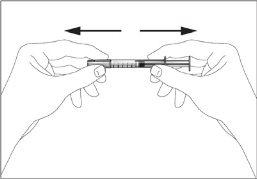
- Pegar a seringa e remover a cobertura protetora da agulha suavemente sem inclinar. Separe como indicado nas imagens 1 e 2. Não toque a agulha nem empurre o êmbolo.
|
|
- Pode aparecer uma pequena bolha de ar na seringa pré-carregada. Se houver bolhas, dê leves batidas com os dedos na seringa até que as bolhas vão para o final da seringa. Com a seringa apontando para cima, retire o ar da seringa empurrando o êmbolo.
- A seringa tem uma escala. Empurre o êmbolo até o número (ml) da seringa que corresponde à dose de Tevagrastim prescrita pelo seu médico.
- Verifique novamente se a dose de Tevagrastim é a correta.
- Agora pode usar a seringa pré-carregada.
Em que lugar devo colocar a injeção
Os locais mais adequados para a injeção são:
- a parte superior dos músculos da coxa; e
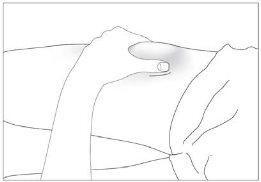
- a barriga, exceto a área ao redor do umbigo (ver imagem 3).
|
|
Se alguém lhe administrar a injeção, também pode usar a parte posterior dos antebraços (ver imagem 4)
Para evitar o risco de dor em um ponto dado, é melhor mudar todos os dias o local da injeção.
Como devo me injetar
- Desinfete o local da injeção usando um algodão com álcool e puxe a pele entre o polegar e o índice, sem apertar (ver imagem 5).
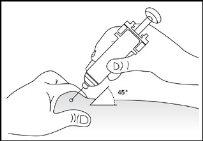
- Insira completamente a agulha na pele como indicou seu enfermeiro ou médico (ver imagem 6).
- Puxe levemente o êmbolo para ter certeza de que não se pinchou uma veia. Se vir sangue na seringa, retire a agulha e insira em outro local.
- Mantenha sempre a pele puxada, empurre o êmbolo lentamente e uniformemente até que tenha administrado a totalidade da dose e o êmbolo não possa mais avançar. Nãolibere a pressão sobre o êmbolo!
- Injete apenas a dose prescrita pelo seu médico.
- Depois de injetar o líquido, retire a agulha mantendo a pressão sobre o êmbolo e, em seguida, solte a pele.
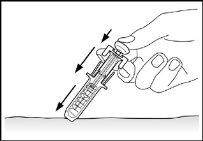
- Solte o êmbolo. O protetor de segurança para a agulha se moverá rapidamente para cobri-la (ver imagem 7).
 5
5
 6
6
 7
7
Lembre-se
Se tiver alguma dúvida, peça ajuda ou conselhos ao seu médico ou enfermeiro.
Como descartar as seringas usadas
- O protetor de segurança para a agulha previne lesões causadas por picadas de agulha após o uso, por isso não são necessárias precauções especiais de eliminação. Deposite a seringa de acordo com as instruções do médico, enfermeiro ou farmacêutico.
- Esta informação é destinada apenas a profissionais do setor de saúde
Tevagrastim não contém conservantes. Em vista de um possível risco de contaminação microbiana, as seringas pré-carregadas de Tevagrastim são para uso único.
A exposição acidental a temperaturas de congelamento não afeta negativamente a estabilidade de Tevagrastim.
Tevagrastim não deve ser diluído com cloreto de sódio. Este medicamento não deve ser misturado com outros medicamentos, exceto com os mencionados a seguir. A diluição de filgrastim pode ser adsorvida pelo vidro e materiais plásticos, exceto se for diluído como mencionado a seguir.
Tevagrastim pode ser diluído, se necessário, em uma solução para perfusão de glicose 50 mg/ml (a 5%). Não é recomendado diluir a concentrações finais inferiores a 0,2 MUI (2 μg) por ml. A solução deve ser inspecionada visualmente antes de usá-la. Somente devem ser usadas soluções transparentes sem partículas. Em pacientes tratados com filgrastim diluído a concentrações inferiores a 1,5 MUI (15 μg) por ml, deve ser adicionada albúmina sérica humana (ASH) a uma concentração final de 2 mg/ml. Exemplo: se o volume de injeção final for de 20 ml e a dose total de filgrastim for inferior a 30 MUI (300 μg), devem ser administrados 0,2 ml de uma solução de albúmina humana 200 mg/ml (a 20%). Quando Tevagrastim for diluído em uma solução para perfusão de glicose 50 mg/ml (a 5%), é compatível com o vidro e diversos plásticos, como PVC, poliolefina (copolímero de polipropileno e polietileno) e polipropileno.
Após a diluição: a estabilidade química e física da solução diluída para perfusão foi demonstrada durante 24 horas armazenada entre 2 e 8 ºC. Do ponto de vista microbiológico, o produto deve ser usado imediatamente. Se não for usado imediatamente, o tempo e as condições de armazenamento da solução diluída são responsabilidade do usuário e normalmente não devem ultrapassar 24 horas entre 2 e 8 ºC, a não ser que a diluição tenha sido realizada em condições de assepsia validadas e controladas.
Uso da seringa pré-carregada com protetor de segurança para a agulha
O protetor de segurança para a agulha cobre a agulha após a injeção para prevenir picadas acidentais. Isso não afeta a forma de usar a seringa. Empurre o êmbolo lentamente e uniformemente até que tenha administrado a totalidade da dose e o êmbolo não possa mais avançar. Retire a seringa mantendo a pressão sobre o êmbolo. O protetor de segurança para a agulha cobrirá a agulha uma vez que o êmbolo seja liberado.
Eliminação
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.
Prospecto: informação para o usuário
Tevagrastim 30 MUI/0,5 ml solução injetável e para perfusão
Tevagrastim 48 MUI/0,8 ml solução injetável e para perfusão
filgrastim
Leia todo o prospecto atentamente antes de começar a usar este medicamento, pois contém informações importantes para você.
- Conserve este prospecto, pois pode precisar lê-lo novamente.
- Se tiver alguma dúvida, consulte seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para você, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que você, pois pode prejudicá-las.
- Se experimentar efeitos adversos, consulte seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Tevagrastim e para que é utilizado
- O que precisa saber antes de começar a usar Tevagrastim
- Como usar Tevagrastim
- Possíveis efeitos adversos
- Conservação de Tevagrastim
- Conteúdo do envase e informação adicional
- Informação para auto-injeção
- Esta informação é destinada apenas a profissionais do setor de saúde
- O que é Tevagrastim e para que é utilizado
O que é Tevagrastim
Tevagrastim é um fator de crescimento de glóbulos brancos (fator estimulante das colônias de granulócitos) e pertence a um grupo de medicamentos chamados citocinas. Os fatores de crescimento são proteínas que são produzidas naturalmente no corpo, mas também podem ser produzidas usando engenharia genética para uso como medicamento. Tevagrastim funciona fazendo com que a medula óssea produza mais glóbulos brancos.
Para que é utilizado Tevagrastim
Uma redução no número de glóbulos brancos (neutropenia) pode ocorrer por várias razões e torna o corpo menos eficaz na luta contra infecções. Tevagrastim estimula a medula óssea para produzir novos glóbulos brancos rapidamente.
Tevagrastim pode ser utilizado:
- para aumentar o número de glóbulos brancos após o tratamento com quimioterapia para ajudar a prevenir infecções;
- para aumentar o número de glóbulos brancos após um transplante de medula óssea para ajudar a prevenir infecções;
- antes da quimioterapia a doses altas para fazer com que a medula óssea produza mais células-mãe, que podem ser coletadas e devolvidas ao organismo após o tratamento. Essas células-mãe podem ser coletadas de você ou de um doador. As células-mãe voltarão então à medula óssea e produzirão células sanguíneas;
- para aumentar o número de glóbulos brancos se apresentar neutropenia crônica grave para ajudar a prevenir infecções;
- para ajudar a reduzir o risco de infecções em pacientes com infecção avançada por HIV.
- O que precisa saber antes de começar a usar Tevagrastim
Não use Tevagrastim
- se é alérgico ao filgrastim ou a algum dos demais componentes deste medicamento (incluídos na seção 6).
Advertências e precauções
Consulte seu médico, farmacêutico ou enfermeiro antes de começar a usar Tevagrastim.
Informar seu médico antes de começar o tratamento se:
- tiver anemia de células falciformes, pois este medicamento pode causar crises de células falciformes;
- tiver osteoporose (doença óssea).
Informar seu médico imediatamente durante o tratamento com Tevagrastim se:
- tiver sinais repentinos de alergia, tais como erupção, coceira ou urticária na pele, inchaço do rosto, lábios, língua ou outras partes do corpo, falta de ar, sibilância ou problemas para respirar, pois podem ser sinais de uma reação alérgica grave (hipersensibilidade);
- apresentar inchaço no rosto ou tornozelos, sangue na urina ou urina de cor marrom ou se notar que urina com menor frequência do que o habitual (glomerulonefrite);
- apresentar dor na parte superior esquerda do abdômen (dor abdominal), dor abaixo da caixa torácica esquerda ou no extremo esquerdo do ombro (esses podem ser sintomas de um baço aumentado [esplenomegalia] ou uma possível ruptura do baço);
- notar sangramentos ou hematomas incomuns (esses podem ser sintomas de uma diminuição das plaquetas no sangue [trombocitopenia], com uma capacidade reduzida do sangue para coagular);
- tiver sintomas de inflamação da aorta (o vaso sanguíneo grande que transporta sangue desde o coração até o resto do corpo), isso raramente foi notado em pacientes com câncer e em doadores saudáveis. Os sintomas podem incluir febre, dor abdominal, mal-estar geral, dor de costas e marcadores inflamatórios aumentados. Informe seu médico se apresentar esses sintomas.
Perda de resposta a filgrastim
Se experimentar uma perda de resposta ou se não se consegue manter a resposta ao tratamento com filgrastim, seu médico investigará as causas, incluindo se desenvolveu anticorpos que possam neutralizar a atividade de filgrastim.
Pode que seu médico queira supervisioná-lo estreitamente, ver seção 4 do prospecto. Se você é um paciente com neutr
openia crónica grave pode estar em risco de desenvolver cancro do sangue (leucemia, síndrome mielodisplásico [SMD]). Fale com o seu médico sobre os riscos de desenvolver cancro do sangue e dos exames que devem ser realizados. Se desenvolver ou for provável que desenvolva cancro do sangue, não deve utilizar Tevagrastim a menos que o seu médico o indique.
Se é um doador de células madre, deve ter entre 16 e 60 anos de idade.
Tenha especial cuidado com outros produtos que estimulam os glóbulos brancos
Tevagrastim pertence a um grupo de medicamentos que estimula a produção de glóbulos brancos. O seu médico deve registar sempre o produto exacto que está a utilizar.
Outros medicamentos e Tevagrastim
Informa o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Gravidez e amamentação
Tevagrastim não foi estudado em mulheres grávidas ou em período de amamentação.
Não se recomenda Tevagrastim durante a gravidez.
É importante que informe o seu médico se:
- está grávida ou em período de amamentação;
- acredita que possa estar grávida; ou
- tem intenção de ficar grávida.
Se ficar grávida durante o tratamento com Tevagrastim, informe o seu médico. A menos que o seu médico lhe indique o contrário, deve deixar de amamentar se utilizar Tevagrastim.
Condução e uso de máquinas
A influência de Tevagrastim sobre a sua capacidade para conduzir e usar máquinas é pequena. Este medicamento pode produzir tonturas. É aconselhável esperar e ver como se sente após a administração do medicamento antes de conduzir ou manejar maquinaria.
Tevagrastim contém sorbitol
Este medicamento contém 50 mg de sorbitol em cada ml.
Para administração por via intravenosa
O sorbitol é uma fonte de frutose. Se você (ou seu filho) padece de intolerância hereditária à frutose (IHF), uma doença genética rara, você (ou seu filho) não devem receber este medicamento. Os pacientes com IHF não podem descompor a frutose, o que pode causar efeitos adversos graves. Consulte com o seu médico antes de receber este medicamento se você (ou seu filho) padece de IHF ou se seu filho não pode tomar alimentos ou bebidas doces porque lhes produz tonturas, vómitos ou efeitos desagradáveis como inchaço, cãibras no estômago ou diarreia.
Tevagrastim contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por seringa pré-carregada; isto é, é essencialmente “isento de sódio”.
- Como usar Tevagrastim
Siga exactamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
Como se administra Tevagrastim e quanto devo tomar?
Tevagrastim é administrado por via subcutânea, geralmente uma vez ao dia, ou por via intravenosa, uma vez ao dia. A dose habitual varia em função da sua doença e peso. O seu médico lhe indicará a quantidade de Tevagrastim que deve tomar.
Pacientes com transplante de medula óssea após quimioterapia:
Normalmente receberá a primeira dose de Tevagrastim pelo menos 24 horas após a quimioterapia e pelo menos 24 horas após receber o transplante de medula óssea.
A você ou às pessoas que o atendem pode ser ensinado a administrar injeções subcutâneas para que possa continuar o tratamento em casa. No entanto, não deve tentar a menos que o seu profissional de saúde o tenha treinado de forma adequada.
Quanto tempo tenho que tomar Tevagrastim?
Terá que tomar Tevagrastim até que o seu recuento de glóbulos brancos seja normal. Serão realizados exames de sangue periódicos para supervisionar o número de glóbulos brancos no seu corpo. O seu médico lhe indicará quanto tempo precisa tomar Tevagrastim.
Uso em crianças
Tevagrastim é utilizado para tratar crianças que estão a receber quimioterapia ou que apresentam um recuento de glóbulos brancos baixo (neutropenia) grave. A dose administrada às crianças que estão a receber quimioterapia é a mesma que para os adultos.
Se usa mais Tevagrastim do que deve
Não aumente a dose que o seu médico lhe prescreveu. Se utilizou mais Tevagrastim do que deve, contacte o seu médico ou farmacêutico o mais rápido possível.
Se esqueceu de usar Tevagrastim
Se esqueceu de uma injeção, ou se se injetou menos doses, contacte o seu médico o mais rápido possível. Não tome uma dose dupla para compensar as doses esquecidas.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
- Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Efeitos adversos importantes
É importante que contacte o seu médico imediatamente:
- se experimenta uma reação alérgica, incluindo fraqueza, queda da pressão arterial, dificuldade para respirar, inchaço da face (anafilaxia), erupção cutânea, erupção cutânea com picazón (urticária), inchaço da face, lábios, boca, língua ou garganta (angioedema) e falta de ar (dispneia);
- se experimenta tosse, febre e dificuldade para respirar (dispneia), pois pode ser um sinal do síndrome de dificuldade respiratória aguda (SDRA);
- se experimenta dano renal (glomerulonefrite). Foi observado dano renal em pacientes que recebiam filgrastim. Contacte o seu médico imediatamente se observa inchaço na face ou nos tornozelos, sangue na urina ou urina de cor marrom, ou nota que urina com menor frequência do que o habitual;
- se experimenta algum ou uma combinação dos seguintes efeitos adversos:
- inchaço que pode estar associado a urinar com uma menor frequência, dificuldade para respirar, inchaço e sensação de plenitude abdominal e uma sensação geral de cansaço. Estes sintomas geralmente se desenvolvem rapidamente.
Estes podem ser sintomas de uma doença chamada “síndrome de fuga capilar” e que pode causar que o sangue se escape de um pequeno vaso sanguíneo para outros lugares do seu corpo e necessite de atenção médica urgente.
- se experimenta uma combinação dos seguintes sintomas:
- febre, arrepios ou sensação de muito frio, frequência cardíaca alta, confusão ou desorientação, dificuldade para respirar, dor extrema ou malestar e pele húmida ou suada.
Estes poderiam ser sintomas de uma afeção chamada “sepsis” (também chamada “intoxicação sanguínea”), uma infecção grave com resposta inflamatória de todo o corpo que pode ser potencialmente mortal e requer atenção médica urgente;
- se experimenta dor na parte superior esquerda do ventre (dor abdominal), dor no lado inferior esquerdo da caixa torácica ou dor no extremo do ombro, pois se poderia tratar de algum problema com o seu baço (agrandamento do baço [esplenomegalia] ou rotura do baço);
- se está a ser tratado por neutropenia crónica grave e tem sangue na urina (hematuria). O seu médico lhe realizará exames de urina periódicos se experimenta este efeito adverso ou se se encontram proteínas na sua urina (proteinúria).
Um efeito adverso frequente do uso de Tevagrastim é dor nos músculos ou ossos (dor musculoesquelética), que se pode remediar tomando medicamentos habituais para aliviar a dor (analgésicos). Nos pacientes submetidos a um transplante de células madre ou de medula óssea, pode aparecer doença do enxerto contra o hospedeiro (EICH). Esta é uma reação das células do doador contra o paciente que recebe o transplante; os sinais e sintomas incluem erupções nas palmas das mãos ou nas plantas dos pés, e úlceras e feridas na boca, intestino, fígado, pele, olhos, pulmões, vagina e articulações.
Em doadores saudáveis de células madre pode ser observado um aumento dos glóbulos brancos (leucocitose) e uma diminuição das plaquetas que pode reduzir a capacidade do sangue para coagular-se (trombocitopenia). Estes efeitos serão vigilados pelo seu médico.
Pode experimentar os seguintes efeitos adversos:
Muito frequentes(podem afectar a mais de 1 de cada 10 pessoas):
- Diminuição das plaquetas, o que reduz a capacidade do sangue para coagular-se (trombocitopenia)
- Recuento baixo de glóbulos vermelhos (anemia)
- Dor de cabeça
- Diarréia
- Vómitos
- Náuseas
- Perda ou debilitamento do cabelo anormal (alopecia)
- Cansaço (fadiga)
- Irritação e inchaço do revestimento do tubo digestivo que vai da boca ao ânus (inflamação da mucosa)
- Febre (pirexia)
Frequentes(podem afectar até 1 de cada 10 pessoas):
- Inflamação dos pulmões (bronquite)
- Infecção do tracto respiratório superior
- Infecção do tracto urinário
- Apetite diminuído
- Problemas para dormir (insónia)
- Tonturas
- Diminuição da sensibilidade, especialmente na pele (hipoestesia)
- Formigueiro ou entorpecimento das mãos ou dos pés (parestesia)
- Tensão arterial baixa (hipotensão)
- Tensão arterial alta (hipertensão)
- Tosse
- Tosse com sangue (hemoptise)
- Dor na boca e garganta (dor orofaríngea)
- Hemorragia nasal (epistaxe)
- Prisão de ventre
- Dor oral
- Aumento do tamanho do fígado (hepatomegalia)
- Erupção
- Verdade da pele (eritema)
- Cãibra muscular
- Dor ao urinar (disúria)
- Dor no peito
- Dor
- Debilidade generalizada (astenia)
- Sensação de mal-estar (mal-estar geral)
- Inchaço nas mãos e pés (edema periférico)
- Aumento de certas enzimas no sangue
- Mudanças no exame bioquímico do sangue
- Reação à transfusão
Pouco frequentes(podem afectar até 1 de cada 100 pessoas):
- Aumento dos glóbulos brancos do sangue (leucocitose)
- Reação alérgica (hipersensibilidade)
- Rejeição do transplante de medula óssea (doença do enxerto contra o hospedeiro)
- Níveis altos de ácido úrico no sangue, que podem causar gota (hiperuricemia) (ácido úrico elevado no sangue)
- Dano hepático causado pelo bloqueio das pequenas veias do fígado (doença veno-oclusiva)
- Os pulmões não funcionam como devem, causando falta de ar (insuficiência respiratória)
- Inchaço ou fluido nos pulmões (edema pulmonar)
- Inflamação dos pulmões (doença pulmonar intersticial)
- Radiografias anormais dos pulmões (infiltração pulmonar)
- Sangramento dos pulmões (hemorragia pulmonar)
- Falta de absorção de oxigénio nos pulmões (hipóxia)
- Erupção cutânea irregular (erupção maculopapular)
- Doença que faz com que os ossos percam densidade, tornando-os mais fracos, mais frágeis e propensos a fracturas (osteoporose)
- Reação na zona de injeção
Raros(podem afectar até 1 de cada 1.000 pessoas):
- Dor intensa nos ossos, peito, intestinos ou articulações (anemia de células falciformes com crise)
- Reações alérgicas repentinas e que podem pôr em perigo a vida (reação anafiláctica)
- Inchaço e dor nas articulações, semelhante à gota (pseudogota)
- Uma mudança na forma como o seu corpo regula os fluidos corporais que pode resultar em inchaço (alterações do volume de fluidos)
- Inflamação dos vasos sanguíneos da pele (vasculite cutânea)
- Úlceras dolorosas, inflamadas e de cor vermelha escura nas extremidades e, por vezes, na face e no pescoço que cursam com febre (síndrome de Sweet)
- Piora da artrite reumatoide
- Mudanças incomuns na urina
- Diminuição da densidade óssea
- Inflamação da aorta (o vaso sanguíneo grande que transporta sangue desde o coração até o resto do corpo), ver secção 2
Comunicação de efeitos adversos
Se experimenta qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
- Conservação de Tevagrastim
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de caducidade que aparece na caixa e na seringa pré-carregada após EXP. A data de caducidade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2 ºC e 8 ºC).
Dentro do seu período de validade e para o seu uso ambulatorial, o medicamento pode ser retirado do frigorífico (2 ºC – 8 ºC) e armazenado a uma temperatura de até 25 ºC durante um período único de até 4 dias. Se o medicamento não foi utilizado nesses 4 dias, deve ser devolvido ao frigorífico (2 ºC – 8 ºC) até à data de caducidade. Devem ser eliminadas as seringas armazenadas a mais de 8 ºC durante mais de 4 dias.
Não utilize este medicamento se observar turbidez ou partículas no interior.
Os medicamentos não devem ser jogados pelos esgotos. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
- Conteúdo do envase e informação adicional
Composição de Tevagrastim
- O princípio activo é filgrastim. Cada ml de solução para injeção e perfusão contém 60 milhões de unidades internacionais (MUI) (600 microgramas) de filgrastim.
Tevagrastim 30 MUI/0,5 ml: cada seringa pré-carregada contém 30 milhões de unidades internacionais [MUI] (300 microgramas) de filgrastim em 0,5 ml de solução.
Tevagrastim 48 MUI/0,8 ml: cada seringa pré-carregada contém 48 milhões de unidades internacionais [MUI] (480 microgramas) de filgrastim em 0,8 ml de solução.
- Os demais componentes são: hidróxido de sódio, ácido acético glacial, sorbitol, polissorbato 80, água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Tevagrastim é uma solução para injeção e perfusão em uma seringa pré-carregada. Tevagrastim é uma solução transparente e incolor.
Cada seringa pré-carregada contém 0,5 ml ou 0,8 ml de solução.
Tevagrastim é fornecido em embalagens de 1, 5 ou 10 seringas pré-carregadas ou em embalagens múltiplas que contêm 10 seringas pré-carregadas (2 embalagens de 5) com agulha de injeção e com ou sem protetor de segurança para a agulha. Pode ser que nem todos os formatos sejam comercializados.
Titular da autorização de comercialização
TEVA GmbH
Graf-Arco-Straße 3
89079 Ulm
Alemanha
Responsável pela fabricação
Teva Pharma B.V.
Swensweg 5
2031 GA Haarlem
Países Baixos
Merckle GmbH
Graf-Arco-Straße 3
89079 Ulm
Alemanha
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica Teva Pharma Belgium N.V./S.A./AG Tel: +32 38207373 | Lituânia UAB Teva Baltics Tel: +370 52660203 |
| Luxemburgo Teva Pharma Belgium N.V./S.A./AG Bélgica Tel: +32 38207373 |
República Checa Teva Pharmaceuticals CR, s.r.o. Tel: +420 251007111 | Hungria Teva Gyógyszergyár Zrt. Tel: +36 12886400 |
Dinamarca Teva Denmark A/S Tlf: +45 44985511 | Malta Teva Pharmaceuticals Ireland Irlanda Tel: +44 2075407117 |
Alemanha TEVA GmbH Tel: +49 73140208 | Países Baixos Teva Nederland B.V. Tel: +31 8000228400 |
Estônia UAB Teva Baltics Eesti filial Tel: +372 6610801 | Noruega Teva Norway AS Tlf: +47 66775590 |
Grécia TEVA HELLAS Α.Ε. Tel: +30 2118805000 | Áustria ratiopharm Arzneimittel Vertriebs-GmbH Tel: +43 1970070 |
Espanha Teva Pharma, S.L.U. Tel: +34 913873280 | Polônia Teva Pharmaceuticals Polska Sp. z o.o. Tel: +48 223459300 |
França Teva Santé Tél: +33 155917800 | Portugal Teva Pharma - Produtos Farmacêuticos, Lda. Tel: +351 214767550 |
Croácia Pliva Hrvatska d.o.o. Tel: +385 13720000 | Romênia Teva Pharmaceuticals S.R.L. Tel: +40 212306524 |
Irlanda Teva Pharmaceuticals Ireland Tel: +44 2075407117 | Eslovênia Pliva Ljubljana d.o.o. Tel: +386 15890390 |
Islândia Teva Pharma Iceland ehf. Sími: +354 5503300 | Eslováquia TEVA Pharmaceuticals Slovakia s.r.o. Tel: +421 257267911 |
Itália Teva Italia S.r.l. Tel: +39 028917981 | Finlândia Teva Finland Oy Puh/Tel: +358 201805900 |
Chipre TEVA HELLAS Α.Ε. Grécia Tel: +30 2118805000 | Suécia Teva Sweden AB Tel: +46 42121100 |
Letônia UAB Teva Baltics filiale Letônia Tel: +371 67323666 | Reino Unido (Irlanda do Norte) Teva Pharmaceuticals Ireland Irlanda Tel: +44 2075407117 |
Data da última revisão deste prospecto:
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
- Informação para auto-injetar
Esta secção contém informação de como administrar a si mesmo uma injeção de Tevagrastim. É importante que siga as instruções do seu médico ou farmacêutico.
Não tente administrar-se uma injeção sem ter recebido o curso necessário do seu médico ou enfermeiro. Também é importante que disponha de uma seringa em um recipiente de segurança à prova de perfuração. Se não tiver certeza de poder se injetar ou se tiver alguma dúvida, consulte o seu médico ou enfermeiro.
É importante que elimine as seringas usadas em um recipiente à prova de perfuração.
Como auto-injetar Tevagrastim
Deve injetar-se no tecido justo abaixo da pele. Isso é conhecido como injeção subcutânea. A injeção deve ser administrada todos os dias, aproximadamente à mesma hora.
Equipamento necessário para a administração
Para a administração da injeção subcutânea, é necessário o seguinte:
- uma seringa pré-carregada de Tevagrastim,
- algodão ou similar com álcool,
- um recipiente, à prova de perfuração (recipiente de plástico fornecido por um hospital ou farmácia) para eliminar as seringas usadas de forma segura.
O que devo fazer antes de me administrar uma injeção subcutânea de Tevagrastim
- Tente administrar a injeção aproximadamente à mesma hora todos os dias.
- Retire a seringa pré-carregada de Tevagrastim da geladeira.
- Verifique a data de validade que indica a seringa pré-carregada (EXP). Não a use se a data for superior ao último dia do mês que aparece.
- Verifique a aparência de Tevagrastim. Deve ser um líquido transparente e incolor. Se houver partículas no interior, não deve usá-lo.
- Para uma injeção mais confortável, deixe a seringa pré-carregada repousar durante 30 minutos à temperatura ambiente ou segure a seringa pré-carregada com suavidade nas suas mãos durante alguns minutos. Não aqueça Tevagrastim de outra forma (por exemplo, não o aqueça no micro-ondas nem em água quente)
- Nãoretire a tampa da seringa até que esteja pronto para a injeção
- Lave as mãos cuidadosamente.
- Encontre um local confortável e bem iluminado e coloque tudo o que é necessário ao alcance (a seringa pré-carregada de Tevagrastim, algodão e o recipiente para resíduos).
Como devo preparar minha injeção de Tevagrastim
Antes de injetar Tevagrastim, é necessário:
- Pegue a seringa e retire a cobertura protetora da agulha suavemente, sem inclinar. Empurre o êmbolo. Separe, como indicado nas figuras 1 e 2. Não toque a agulha nem empurre o êmbolo.
|
|
- Pode aparecer uma pequena bolha de ar na seringa pré-carregada. Se houver bolhas, dê leves batidas com os dedos na seringa até que as bolhas vão para o final da seringa. Com a seringa apontando para cima, retire o ar da seringa empurrando o êmbolo.
- A seringa tem uma escala. Empurre o êmbolo até o número (ml) da seringa que corresponde à dose de Tevagrastim prescrita pelo seu médico.
- Verifique novamente se a dose de Tevagrastim é a correta.
- Agora pode usar a seringa pré-carregada.
Onde devo colocar a injeção
Os locais mais adequados para a injeção são:
- a parte superior dos quadris; e
- a barriga, exceto a área ao redor do umbigo (ver imagem 3).
|
|
Se alguém estiver administrando a injeção, também pode usar a parte posterior dos antebraços (ver imagem 4)
Para evitar o risco de dor em um ponto dado, é melhor mudar o local da injeção todos os dias.
Como devo me injetar
- Desinfete o local da injeção usando um algodão com álcool e puxe a pele entre o polegar e o índice, sem apertar (ver imagem 5).
- Insira completamente a agulha na pele, como indicado pelo seu enfermeiro ou médico (ver imagem 6).
- Puxe levemente o êmbolo para garantir que não tenha perfurado uma veia. Se vir sangue na seringa, retire a agulha e insira-a em outro local.
- Injete o líquido lentamente e regularmente, mantendo sempre a pele puxada.
- Injete apenas a dose prescrita pelo seu médico.
- Depois de injetar o líquido, retire a agulha e solte a pele.
- Use apenas uma seringa para uma única injeção. Não use qualquer resto de Tevagrastim sobrante da seringa.
|
|
Lembre-se
Se tiver alguma dúvida, peça ajuda ou conselhos ao seu médico ou enfermeiro.
Como eliminar as seringas usadas
- Não volte a colocar a cobertura protetora nas seringas já usadas.
- Coloque as seringas usadas em um recipiente de segurança à prova de perfuração e guarde este recipiente fora do alcance e da vista das crianças.
- Deposite o recipiente cheio de acordo com as instruções do médico, enfermeiro ou farmacêutico.
- Nunca jogue as seringas usadas no lixo comum.
- Esta informação é destinada apenas a profissionais do setor de saúde
Tevagrastim não contém conservantes. Em vista de um possível risco de contaminação microbiana, as seringas pré-carregadas de Tevagrastim são para uso único.
A exposição acidental a temperaturas de congelamento não afeta negativamente a estabilidade de Tevagrastim.
Tevagrastim não deve ser diluído com cloreto de sódio. Este medicamento não deve ser misturado com outros medicamentos, exceto com os mencionados a seguir. A diluição de filgrastim pode ser adsorvida pelo vidro e materiais plásticos, exceto se for diluído como mencionado a seguir.
Tevagrastim pode ser diluído, se necessário, em uma solução para perfusão de glicose 50 mg/ml (a 5%). Não é recomendado diluir a concentrações finais inferiores a 0,2 MUI (2 μg) por ml. A solução deve ser inspecionada visualmente antes de usá-la. Apenas devem ser usadas soluções transparentes sem partículas. Em pacientes tratados com filgrastim diluído a concentrações inferiores a 1,5 MUI (15 μg) por ml, deve ser adicionada albúmina sérica humana (ASH) a uma concentração final de 2 mg/ml. Exemplo: se o volume de injeção final for de 20 ml e a dose total de filgrastim for inferior a 30 MUI (300 μg), devem ser administrados 0,2 ml de uma solução de albúmina humana 200 mg/ml (a 20%). Quando Tevagrastim for diluído em uma solução para perfusão de glicose 50 mg/ml (a 5%), é compatível com o vidro e vários plásticos, como PVC, poliolefina (copolímero de polipropileno e polietileno) e polipropileno.
Após a diluição: a estabilidade química e física da solução diluída para perfusão foi demonstrada durante 24 horas armazenada entre 2 e 8 ºC. Do ponto de vista microbiológico, o produto deve ser usado imediatamente. Se não for usado imediatamente, o tempo e as condições de armazenamento da solução diluída são responsabilidade do usuário e normalmente não devem ultrapassar 24 horas entre 2 e 8 ºC, a não ser que a diluição tenha sido realizada em condições de assepsia validadas e controladas.
Uso da seringa pré-carregada sem protetor de segurança para a agulha
Administre a dose de acordo com o protocolo padrão.
Eliminação
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a TEVAGRASTIM 48 MU/0,8 ml SOLUÇÃO PARA INJEÇÃO OU PERFUSÃOForma farmacêutica: INJETÁVEL, 12 UI/0,2 mlSubstância ativa: filgrastimFabricante: Accord Healthcare S.L.U.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,3 mg / seringa pré-carregadaSubstância ativa: filgrastimFabricante: Accord Healthcare S.L.U.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,3 mg / seringa pré-carregadaSubstância ativa: filgrastimFabricante: Accord Healthcare S.L.U.Requer receita médica
Alternativas a TEVAGRASTIM 48 MU/0,8 ml SOLUÇÃO PARA INJEÇÃO OU PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a TEVAGRASTIM 48 MU/0,8 ml SOLUÇÃO PARA INJEÇÃO OU PERFUSÃO em Polónia
Alternativa a TEVAGRASTIM 48 MU/0,8 ml SOLUÇÃO PARA INJEÇÃO OU PERFUSÃO em Ukraine
Médicos online para TEVAGRASTIM 48 MU/0,8 ml SOLUÇÃO PARA INJEÇÃO OU PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de TEVAGRASTIM 48 MU/0,8 ml SOLUÇÃO PARA INJEÇÃO OU PERFUSÃO – sujeita a avaliação médica e regras locais.




 1
1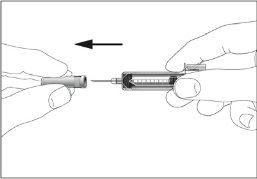 2
2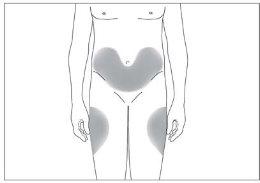 3
3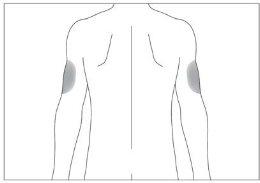 4
4
 1
1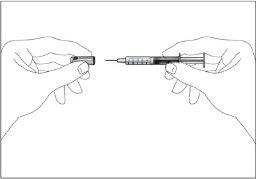 2
2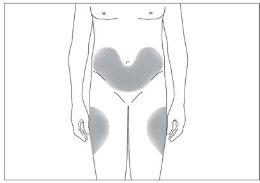 3
3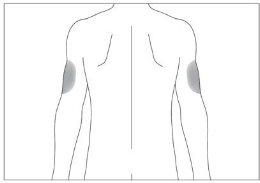 4
4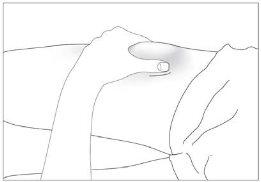 5
5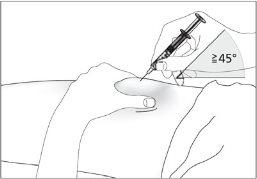 6
6

