TEPADINA 400 mg PÓ E SOLVENTE PARA SOLUÇÃO PARA PERFUSÃO


Como usar TEPADINA 400 mg PÓ E SOLVENTE PARA SOLUÇÃO PARA PERFUSÃO
Introdução
Prospecto: informação para o utilizador
TEPADINA 400 mg pó e dissolvente para solução para perfusão
tiotepa
Leia todo o prospecto atentamente antes de começar a usar o medicamento porque contém informações importantes para si.
- Conserva este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico.
- Se experimentar efeitos adversos, consulte o seu médico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdodo prospecto:
- O que é TEPADINA e para que é utilizado
- O que precisa saber antes de começar a usar TEPADINA
- Como usar TEPADINA
- Efeitos adversos possíveis
- Conservação de TEPADINA
- Conteúdo do envase e informações adicionais
1. O que é TEPADINA e para que é utilizado
TEPADINA contém tiotepa como princípio ativo, um medicamento que pertence ao grupo dos alquilantes.
TEPADINA é utilizado para preparar o paciente para um transplante de medula óssea. Actua destruindo as células da medula óssea. Deste forma pode receber um transplante de novas células da medula óssea (células mãe hematopoiéticas), que por sua vez permitem ao organismo produzir células sanguíneas saudáveis.
TEPADINA pode ser utilizado em adultos, crianças e adolescentes.
2. O que precisa saber antes de começar a usar TEPADINA
Não use TEPADINA
- se for alérgico à tiotepa,
- se estiver grávida ou acredite que possa estar,
- se estiver a amamentar,
- se vai receber a vacina contra a febre amarela com vacinas de vírus vivos e bacterianas.
Advertências e precauções
Informa ao seu médico se tiver:
- problemas de fígado ou rim,
- problemas de coração ou de pulmões,
- convulsões/crises epilépticas ou as teve no passado (se foi tratado com fenitoína ou fosfenitoína).
Una vez que TEPADINA destrói as células da medula óssea responsáveis por produzir células sanguíneas, terá que fazer análises de sangue periódicas durante o tratamento para verificar os seus recuentos de células.
Para a prevenção e o tratamento de infecções, lhe serão administrados anti-infecciosos.
TEPADINA pode causar outro tipo de cancro no futuro. O seu médico explicar-lhe-á este tipo de risco.
Outros medicamentos e TEPADINA
Informa ao seu médico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Gravidez, amamentação e fertilidade
Informa ao seu médico se estiver grávida ou acredite que possa estar antes de receber TEPADINA. Não deve usar TEPADINA durante a gravidez.
Tanto as mulheres como os homens que usem TEPADINA devem utilizar métodos anticonceptivos eficazes durante o tratamento. Os homens não devem gerar qualquer filho durante o tratamento com TEPADINA nem durante o ano posterior à finalização do mesmo.
Desconhece-se se este medicamento é excretado no leite materno. Como medida de precaução, as mulheres não devem amamentar durante o tratamento com TEPADINA.
TEPADINA pode afetar a fertilidade masculina e feminina. Os pacientes do sexo masculino devem procurar aconselhamento sobre a conservação do esperma antes de começar o tratamento.
Condução e uso de máquinas
É provável que alguns efeitos adversos da tiotepa, como tontura, dor de cabeça e visão borrosa, afetem a capacidade para conduzir e utilizar máquinas. Não conduza nem use máquinas se se vir afetado.
TEPADINA contém sódio
Este medicamento contém 1 418 mg (61,6 mmol) de sódio por bolsa, equivalente a 70,9 % da ingestão diária máxima de sódio para adultos recomendada para um adulto.
3. Como usar TEPADINA
O médico calculará a dose com base na sua superfície ou peso corporal e na sua doença.
Como é administrada TEPADINA
TEPADINA tem que ser administrada por um profissional de saúde qualificado mediante perfusão intravenosa (gotejamento numa veia) após a diluição de cada frasco. Cada perfusão dura de 2 a 4 horas.
Frequência de administração
Receberá as perfusões cada 12 ou 24 horas. O tratamento pode durar até 5 dias. A frequência de administração e a duração do tratamento dependerão da sua doença.
4. Efeitos adversos possíveis
Como todos os medicamentos, TEPADINA pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Alguns efeitos secundários mais graves do tratamento com TEPADINA ou do procedimento do transplante são:
- descida dos recuentos de células sanguíneas circulantes (efeito esperado do medicamento como preparação para o seu transplante)
- infecção
- problemas hepáticos, como oclusão de uma veia hepática
- ataque do enxerto contra o seu organismo (doença do enxerto contra o hospedeiro)
- complicações respiratórias
O seu médico vigiará os recuentos de células sanguíneas e as enzimas hepáticas periodicamente para detectar e tratar estes acontecimentos.
Os efeitos adversos de TEPADINA ocorrem com determinadas frequências, que são definidas a seguir:
Efeitos adversos muito frequentes (podem afetar mais de 1 em cada 10 pessoas)
- uma maior predisposição para as infecções
- inflamação generalizada (septicemia)
- diminuição do recuento de leucócitos, plaquetas e eritrócitos (anemia)
- ataque das células transplantadas contra o seu organismo (doença do enxerto contra o hospedeiro)
- tontura, cefaleia, visão borrosa
- tremores incontrolados do corpo (convulsões)
- sensação de formigueiro, picadas ou entorpecimento (parestesia)
- perda parcial da mobilidade
- parada cardíaca
- náuseas, vómitos, diarreia
- inflamação da mucosa oral (mucosite)
- irritação do estômago, esófago, intestino
- inflamação do cólon
- anorexia, diminuição do apetite
- elevação da glicose no sangue
- exantema, prurido, descamação
- alteração da cor da pele (não deve ser confundida com icterícia - ver mais adiante)
- eritema da pele
- queda de cabelo
- dor de costas e abdominal, dor
- dor muscular e articular
- atividade elétrica anormal no coração (arritmia)
- inflamação do tecido pulmonar
- aumento do tamanho do fígado
- função alterada de alguns órgãos
- oclusão de uma veia hepática (doença veno-oclusiva, EVO)
- coloração amarelada da pele e dos olhos (icterícia)
- deterioração da audição
- oclusão linfática
- pressão arterial alta
- aumento do tamanho do fígado, elevação das enzimas renais e digestivas
- valores anormais de eletrólitos no sangue
- aumento de peso
- febre, fraqueza geral, calafrios
- hemorragia (sangramento)
- hemorragia nasal
- inchaço geral devido à retenção de líquidos (edema)
- dor ou inflamação no ponto de injeção
- infecção do olho (conjuntivite)
- diminuição do recuento de espermatozoides
- sangramento vaginal
- ausência de períodos menstruais (amenorreia)
- perda de memória
- atraso no aumento de peso e estatura
- problemas de bexiga
- produção insuficiente de testosterona
- produção insuficiente de hormonas tiroideias
- escassa atividade da hipófise
- estado de confusão
Efeitos adversos frequentes (podem afetar até 1 em cada 10 pessoas)
- ansiedade, confusão
- dilatação anormal de uma das artérias no cérebro (aneurisma intracraniano)
- elevação da creatinina
- reações alérgicas
- oclusão de um vaso sanguíneo (embolia)
- alteração do ritmo cardíaco
- insuficiência cardíaca
- incapacidade cardiovascular
- deficiência de oxigênio
- acumulação de líquidos nos pulmões (edema pulmonar)
- hemorragia pulmonar
- parada respiratória
- sangue na urina (hematuria) e insuficiência renal moderada
- inflamação da bexiga urinária
- desconforto ao urinar e diminuição da produção de urina (disúria e oligúria)
- aumento da quantidade de componentes de nitrogênio no sangue (elevação do BUN)
- cataratas
- insuficiência hepática
- hemorragia cerebral
- tos
- constipação e desconforto gástrico
- obstrução intestinal
- perfuração do estômago
- mudanças do tom muscular
- falta geral de coordenação dos movimentos musculares
- hematomas associados a um baixo recuento de plaquetas
- sintomas menopáusicos
- cancro (neoplasias secundárias principais)
- alteração da função cerebral
- infertilidade masculina e feminina
Efeitos adversos pouco frequentes (podem afetar até 1 em cada 100 pessoas)
- inflamação e descamação da pele (psoríase eritrodérmica)
- delírio, nervosismo, alucinações, agitação
- úlcera gastrointestinal
- inflamação do tecido muscular cardíaco (miocardite)
- doença cardíaca anormal (miocardiopatia)
Frequência não conhecida (a frequência não pode ser estimada a partir dos dados disponíveis)
- aumento da pressão sanguínea nas artérias (vasos sanguíneos) dos pulmões (hipertensão arterial pulmonar)
- dano cutâneo grave (p. ex., lesões graves, bolhas, etc.) que pode afetar a superfície corporal completa, o que pode resultar até em morte
- dano em um componente do cérebro (a chamada matéria branca) que pode ser até potencialmente mortal (leucoencefalopatia).
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de TEPADINA
Mantenha este medicamento fora da vista e do alcance das crianças.
Não use o medicamento após a data de validade que aparece após a abreviatura CAD na caixa, no envoltório e na bolsa.
A data de validade é o último dia do mês que é indicado.
Conservar e transportar refrigerado (2 °C-8 ºC). Não congelar.
Após a ativação e reconstituição da bolsa, o medicamento mantém-se estável até 48 horas quando conservado a 2 °C-8 °C e até 6 horas quando conservado a 25 °C. Do ponto de vista microbiológico, o produto deve ser utilizado imediatamente. O produto não utilizado e os resíduos devem ser eliminados de acordo com os requisitos locais.
6. Conteúdo do envase e informação adicional
Composição de TEPADINA
- O princípio ativo é a tiotepa.
Uma bolsa contém 400 mg de tiotepa. Após a reconstituição com o dissolvente, cada ml de solução contém 1 mg de tiotepa
- Os outros ingredientes são cloreto de sódio e água para preparações injetáveis (ver seção 2 “TEPADINA contém sódio”).
Aspecto do produto e conteúdo do envase
TEPADINA é fornecida em uma bolsa de duas câmaras com 400 mg de tiotepa e 400 ml de solução de cloreto de sódio 9 mg/ml (0,9%) injetável na outra câmara.
Após a reconstituição, a bolsa contém uma solução transparente e incolor para perfusão.
Cada bolsa está dentro de um embalagem de alumínio. Cada caixa contém 1 bolsa.
Título da autorização de comercialização e responsável pela fabricação
ADIENNE S.r.l. S.U.
Via Galileo Galilei, 19 20867 Caponago (MB) Itália Tel: +39 02 40700445
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica Accord Healthcare bv Tel: +32 51 79 40 12 | Lituânia Accord Healthcare AB Tel: +46 8 624 00 25 |
Polónia Accord Healthcare Polska Sp. z o.o. Tel: +48 22 577 28 00 | Luxemburgo Accord Healthcare bv Tel: +32 51 79 40 12 |
República Tcheca Accord Healthcare Polska Sp. z o.o. Tel: +48 22 577 28 00 | Hungria Accord Healthcare Polska Sp. z o.o. Tel: +48 22 577 28 00 |
Dinamarca Accord Healthcare AB Tel: +46 8 624 00 25 | Malta Accord Healthcare Ireland Ltd Tel: +44 (0) 208 901 3370 |
Alemanha Accord Healthcare GmbH Tel: +49 89 700 9951 0 | Países Baixos Accord Healthcare B.V. Tel: +31 30 850 6014 |
Estônia Accord Healthcare AB Tel: +46 8 624 00 25 | Noruega Accord Healthcare AB Tel: +46 8 624 00 25 |
Grécia Accord Healthcare Italia Srl Tel: +39 02 943 23 700 | Áustria Accord Healthcare GmbH Tel: +43 (0)662 424899-0 |
Espanha Accord Healthcare S.L.U. Tel: +34 93 301 00 64 | Polónia Accord Healthcare Polska Sp. z o.o. Tel: +48 22 577 28 00 |
França Accord Healthcare France SAS Tel: +33 (0)320 401 770 | Portugal Accord Healthcare, Unipessoal Lda Tel: +351 214 697 835 |
Croácia Accord Healthcare Polska Sp. z o.o. Tel: +48 22 577 28 00 | Romênia Accord Healthcare Polska Sp. z o.o. Tel: +48 22 577 28 00 |
Irlanda Accord Healthcare Ireland Ltd Tel: +44 (0)1271 385257 | Eslovênia Accord Healthcare Polska Sp. z o.o. Tel: +48 22 577 28 00 |
Islândia Accord Healthcare AB Tel: +46 8 624 00 25 | República Eslovaca Accord Healthcare Polska Sp. z o.o. Tel: +48 22 577 28 00 |
Itália Accord Healthcare Italia Srl Tel: +39 02 943 23 700 | Finlândia Accord Healthcare Oy Tel: +358 10 231 4180 |
Chipre Accord Healthcare S.L.U. Tel: +34 93 301 00 64 | Suécia Accord Healthcare AB Tel: +46 8 624 00 25 |
Letônia Accord Healthcare AB Tel: +46 8 624 00 25 | Reino Unido Accord-UK Ltd Tel: +44 (0)1271 385257 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos http://www.ema.europa.eu.
Esta informação é destinada apenas a profissionais do setor sanitário:
GUIA DE PREPARAÇÃO
TEPADINA 400 mg pó e dissolvente para solução para perfusão
tiotepa
Leia esta guia antes da preparação e administração de TEPADINA.
- APRESENTAÇÃO
Uma bolsa contém 400 mg de tiotepa.
Após a reconstituição com o dissolvente, cada ml de solução contém 1 mg de tiotepa. TEPADINA deve ser reconstituída antes da administração
- POSOLOGIA E FORMA DE ADMINISTRAÇÃO
Cálculo da dose de TEPADINA
TEPADINA é administrada em diferentes doses e em combinação com outros medicamentos quimioterápicos a pacientes que vão receber um transplante convencional de células-tronco hematopoéticas (TCH) por apresentar doenças hematológicas ou tumores sólidos.
A posologia recomendada de TEPADINA em pacientes adultos e pediátricos depende do tipo de TCH (autólogo ou alogênico) e da doença.
Se necessário, o ajuste da dose de TEPADINA será feito de acordo com a aplicação específica.
Se a dose calculada necessária for superior a 400 mg, mas inferior a um múltiplo dessa quantidade, o usuário deve adicionar os mg necessários de frascos de TEPADINA por meio de um puerto exclusivo (puerto luer) de TEPADINA 400 mg. (passo 5 das instruções de uso no prospecto).
Se a dose calculada necessária for inferior a 400 mg, o usuário deve retirar os mg excedentes de 1 mg/ml de solução reconstituída ou colocar uma bomba de perfusão com a quantidade de produto médico que deve ser administrada em ml.
Posologia em adultos
TCH AUTÓLOGO
Doenças hematológicas
A dose recomendada nas doenças hematológicas varia entre 125 mg/m2/dia (3,38 mg/kg/dia) e 300 mg/m2/dia (8,10 mg/kg/dia) mediante uma única perfusão diária, administrada durante 2 a 4 dias consecutivos antes de um TCH autólogo, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 900 mg/m2 (24,32 mg/kg), durante todo o tratamento de acondicionamento.
LINFOMA
A dose recomendada varia entre 125 mg/m2/dia (3,38 mg/kg/dia) e 300 mg/m2/dia (8,10 mg/kg/dia) mediante uma única perfusão diária, administrada durante 2 a 4 dias consecutivos antes de um TCH autólogo, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 900 mg/m2 (24,32 mg/kg), durante todo o tratamento de acondicionamento.
LINFOMA DO SISTEMA NERVOSO CENTRAL (SNC)
A dose recomendada é de 185 mg/m2/dia (5 mg/kg/dia) mediante uma única perfusão diária, administrada durante 2 dias consecutivos antes de um TCH autólogo, sem ultrapassar a dose total acumulada máxima de 370 mg/m2 (10 mg/kg), durante todo o tratamento de acondicionamento. MIELOMA MÚLTIPLO
A dose recomendada varia entre 150 mg/m2/dia (4,05 mg/kg/dia) e 250 mg/m2/dia (6,76 mg/kg/dia) mediante uma única perfusão diária, administrada durante 3 dias consecutivos antes de um TCH autólogo, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 750 mg/m2 (20,27 mg/kg), durante todo o tratamento de acondicionamento.
Tumores sólidos
A dose recomendada nos tumores sólidos varia entre 120 mg/m2/dia (3,24 mg/kg/dia) e 250 mg/m2/dia (6,76 mg/kg/dia) dividida em uma ou duas perfusões diárias, administradas durante 2 a 5 dias consecutivos antes de um TCH autólogo, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 800 mg/m2 (21,62 mg/kg), durante todo o tratamento de acondicionamento.
CÂNCER DE MAMA
A dose recomendada varia entre 120 mg/m2/dia (3,24 mg/kg/dia) e 250 mg/m2/dia (6,76 mg/kg/dia) mediante uma única perfusão diária, administrada durante 3 a 5 dias consecutivos antes de um TCH autólogo, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 800 mg/m2 (21,62 mg/kg), durante todo o tratamento de acondicionamento.
TUMORES DO SNC
A dose recomendada varia entre 125 mg/m2/dia (3,38 mg/kg/dia) e 250 mg/m2/dia (6,76 mg/kg/dia) dividida em uma ou duas perfusões diárias, administradas durante 3 a 4 dias consecutivos antes de um TCH autólogo, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 750 mg/m2 (20,27 mg/kg), durante todo o tratamento de acondicionamento.
CÂNCER DE OVÁRIO
A dose recomendada é de 250 mg/m2/dia (6,76 mg/kg/dia) mediante uma única perfusão diária, administrada durante 2 dias consecutivos antes de um TCH autólogo, sem ultrapassar a dose total acumulada máxima de 500 mg/m2 (13,51 mg/kg), durante todo o tratamento de acondicionamento. TUMORES DE CÉLULAS-TRONCO
A dose recomendada varia entre 150 mg/m2/dia (4,05 mg/kg/dia) e 250 mg/m2/dia (6,76 mg/kg/dia) mediante uma única perfusão diária, administrada durante 3 dias consecutivos antes de um TCH autólogo, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 750 mg/m2 (20,27 mg/kg), durante todo o tratamento de acondicionamento.
TCH ALOGÊNICO
Doenças hematológicas
A dose recomendada nas doenças hematológicas varia entre 185 mg/m2/dia (5 mg/kg/dia) e 481 mg/m2/dia (13 mg/kg/dia) dividida em uma ou duas perfusões diárias, administradas durante 1 a 3 dias consecutivos antes de um TCH alogênico, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 555 mg/m2 (15 mg/kg), durante todo o tratamento de acondicionamento.
LINFOMA
A dose recomendada é de 370 mg/m2/dia (10 mg/kg/dia) dividida em duas perfusões diárias antes de um TCH alogênico, sem ultrapassar a dose total acumulada máxima de 370 mg/m2 (10 mg/kg), durante todo o tratamento de acondicionamento.
MIELOMA MÚLTIPLO
A dose recomendada é de 185 mg/m2/dia (5 mg/kg/dia) mediante uma única perfusão diária antes de um TCH alogênico, sem ultrapassar a dose total acumulada máxima de 185 mg/m2 (5 mg/kg), durante todo o tratamento de acondicionamento.
LEUCEMIA
A dose recomendada varia entre 185 mg/m2/dia (5 mg/kg/dia) e 481 mg/m2/dia (13 mg/kg/dia) dividida em uma ou duas perfusões diárias, administradas durante 1 ou 2 dias consecutivos antes de um TCH alogênico, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 555 mg/m2 (15 mg/kg), durante todo o tratamento de acondicionamento.
TALASSEMIA
A dose recomendada é de 370 mg/m2/dia (10 mg/kg/dia) dividida em duas perfusões diárias, administradas antes de um TCH alogênico, sem ultrapassar a dose total acumulada máxima de 370 mg/m2 (10 mg/kg), durante todo o tratamento de acondicionamento.
Posologia em pacientes pediátricos
TCH AUTÓLOGO
Tumores sólidos
A dose recomendada nos tumores sólidos varia entre 150 mg/m2/dia (6 mg/kg/dia) e 350 mg/m2/dia (14 mg/kg/dia) mediante uma única perfusão diária, administrada durante 2 a 3 dias consecutivos antes de um TCH autólogo, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 1.050 mg/m2 (42 mg/kg), durante todo o tratamento de acondicionamento.
TUMORES DO SNC
A dose recomendada varia entre 250 mg/m2/dia (10 mg/kg/dia) e 350 mg/m2/dia (14 mg/kg/dia) mediante uma única perfusão diária, administrada durante 3 dias consecutivos antes de um TCH autólogo, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 1.050 mg/m2 (42 mg/kg), durante todo o tratamento de acondicionamento.
TCH ALOGÊNICO
Doenças hematológicas
A dose recomendada nas doenças hematológicas varia entre 125 mg/m2/dia (5 mg/kg/dia) e 250 mg/m2/dia (10 mg/kg/dia) dividida em uma ou duas perfusões diárias, administradas durante 1 a 3 dias consecutivos antes de um TCH alogênico, dependendo da combinação com outros fármacos quimioterápicos, sem ultrapassar a dose total acumulada máxima de 375 mg/m2 (15 mg/kg), durante todo o tratamento de acondicionamento.
LEUCEMIA
A dose recomendada é de 250 mg/m2/dia (10 mg/kg/dia) dividida em duas perfusões diárias, administradas antes de um TCH alogênico, sem ultrapassar a dose total acumulada máxima de 250 mg/m2 (10 mg/kg), durante todo o tratamento de acondicionamento.
TALASSEMIA
A dose recomendada varia entre 200 mg/m2/dia (8 mg/kg/dia) e 250 mg/m2/dia (10 mg/kg/dia) dividida em duas perfusões diárias, administradas antes de um TCH alogênico, sem ultrapassar a dose total acumulada máxima de 250 mg/m2 (10 mg/kg), durante todo o tratamento de acondicionamento. CITOPENIA REFRACTÁRIA
A dose recomendada é de 125 mg/m2/dia (5 mg/kg/dia) mediante uma única perfusão diária, administrada durante 3 dias consecutivos antes de um TCH alogênico, sem ultrapassar a dose total acumulada máxima de 375 mg/m2 (15 mg/kg), durante todo o tratamento de acondicionamento.
DOENÇAS GENÉTICAS
A dose recomendada é de 125 mg/m2/dia (5 mg/kg/dia) mediante uma única perfusão diária, administrada durante 2 dias consecutivos antes de um TCH alogênico, sem ultrapassar a dose total acumulada máxima de 250 mg/m2 (10 mg/kg), durante todo o tratamento de acondicionamento.
ANEMIA FALCIFORME
A dose recomendada é de 250 mg/m2/dia (10 mg/kg/dia) dividida em duas perfusões diárias, administrada antes de um TCH alogênico, sem ultrapassar a dose total acumulada máxima de 250 mg/m2 (10 mg/kg), durante todo o tratamento de acondicionamento.
Ativação da bolsa e reconstituição
TEPADINA 400 mg deve ser reconstituída com 400 ml de solução de cloreto de sódio 9 mg/ml (0,9%) para injeção. A solução reconstituída final é obtida após romper o selo da bolsa de duas câmaras e misturar o conteúdo de ambas (pó e dissolvente), até a completa dissolução do pó.
Após a reconstituição com o dissolvente, cada ml de solução contém 1 mg de tiotepa. Somente devem ser usadas soluções incolores e sem partículas.
Não utilize o medicamento se observar qualquer sinal de deterioração.
Administração
A solução para perfusão de TEPADINA deve ser inspecionada visualmente para detectar a presença de partículas antes da administração. Devem ser descartadas as soluções que contenham precipitados.
A solução para perfusão deve ser administrada em pacientes mediante um equipamento de perfusão provido de um filtro de 0,2 µm em linha. O filtrado não altera a potência da solução.
TEPADINA deve ser administrada em condições assépticas mediante perfusão durante 2-4 horas a temperatura ambiente (25 °C aproximadamente) e em condições normais de iluminação.
Antes e após cada perfusão, o catéter permanente deve ser lavado com aproximadamente 5 ml de solução injetável com 9 mg/ml de cloreto de sódio (0,9%).
- PRECAUÇÕES ESPECIAIS DE ELIMINAÇÃO E OUTRAS MANIPULAÇÕES
Generalidades
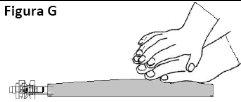
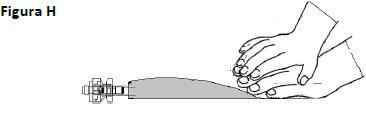
Devem ser considerados os procedimentos adequados de manipulação e eliminação de medicamentos antineoplásicos. Todos os procedimentos de transferência devem cumprir estritamente as técnicas assépticas, empregando preferentemente uma câmara de segurança de fluxo laminar vertical. Assim como com outros compostos citotóxicos, deve-se extremar a precaução durante a manipulação e preparação de soluções de TEPADINA para evitar o contato acidental com a pele ou as mucosas. Podem ocorrer reações tópicas associadas à exposição acidental à tiotepa. Por conseguinte, recomenda-se o uso de luvas durante a preparação da solução para perfusão. Se a solução de tiotepa entrar em contato acidentalmente com a pele, esta deve ser lavada bem com água e sabão imediatamente. Se a tiotepa entrar em contato acidentalmente com as mucosas, estas devem ser lavadas bem com água.
Eliminação
O produto não utilizado e os resíduos devem ser eliminados de acordo com os requisitos locais.
| |
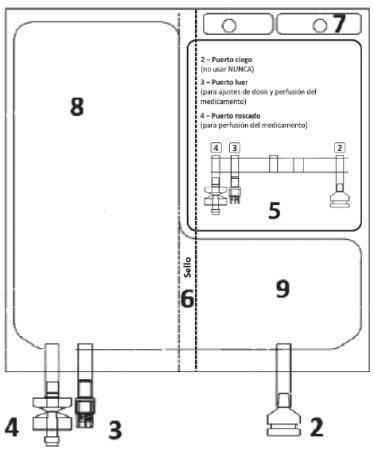
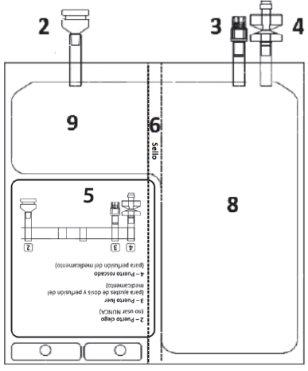
Figura A 1 – Muescas na bolsa exterior
| Figura B 2 – Puerto cego (não usar NUNCA) 3 – Puerto luer
8 – Câmara com o dissolvente 9 – Câmara com o pó
|
| |||||||
|
| ||||||
|
| ||||||
|
|
BOLSA ANTES DA ATIVAÇÃO | BOLSA DEPOIS DA ATIVAÇÃO | |
|
| |
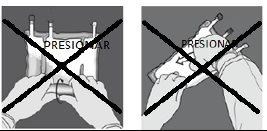
NÃO aperte nem pressione com força. | Figura I
| |
4 – VERIFICAR A BOLSA PARA CONFIRMAR ATIVAÇÃO. | ||
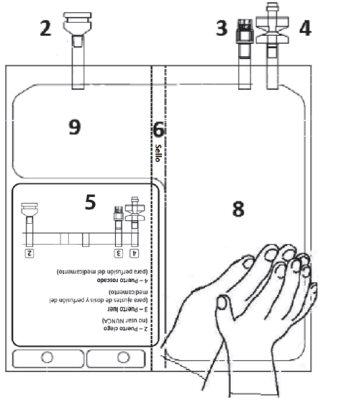
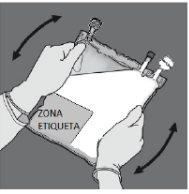
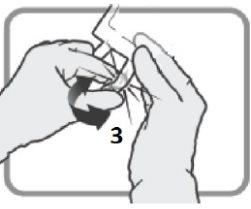
Verifique se o selo 6está totalmente ativado. As câmaras 8e 9se uniram. | Misture suavemente até que o produto se dissolva completamente. | |
Figura J
| Figura K
| |
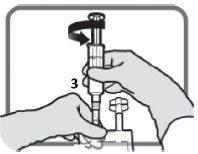
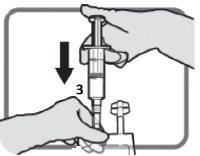
5 – AJUSTAR A DOSAGEM – Consulte as seções 2. “Posologia e modo de administração” e 3. “Precauções especiais de eliminação e outras manipulações” | ||
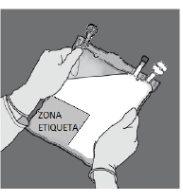
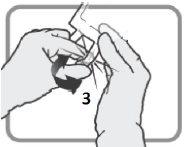
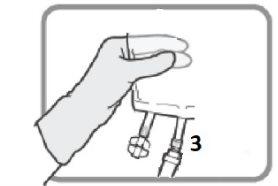
Identifique o puerto luer 3, se necessário, ajuste a dosagem. Retire a tampa de plástico do puerto luer.
Figura L | Enrosque o dispositivo com fechamento luer como na Figura M. Não use dispositivos com fechamentos que não sejam do tipo luer no puerto 3.
Figura M Certifique-se de que a conexão está bem colocada e apertada | Ajuste a dosagem do modo descrito nas seções 2e 3
Figura N Desenrosque o dispositivo quando acabar. Coloque a tampa de plástico sobre o puerto luer 3antes de proceder com a perfusão |
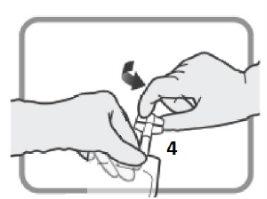
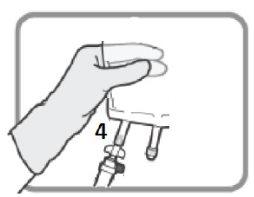
6 – CONEXÃO - O conjunto de perfusão pode ser conectado à bolsa por meio do conector luer ou do conector com pico. | |
OPÇÃO A – CONEXÃO COM PICO Identifique o Puerto rosqueado 4se vai usar um conjunto de perfusão com pico. Gire e retire a tampa de plástico antes de inserir o pico.
Figura O Insira o conector com pico.
Figura P | OPÇÃO B – CONEXÃO LUER Selecione o puerto com tampa luer 3se vai usar um conjunto de perfusão com conector luer. Retire a tampa de plástico do puerto luer 3antes de inserir o conector luer.
Figura Q Insira o conector luer.
Figura R Certifique-se de que a conexão está bem colocada e apertada. |
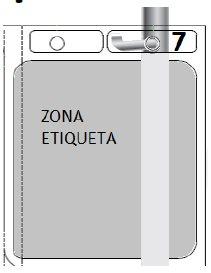
7 – PENDURAR A BOLSA | |
Pendure a bolsa pelo orifício 7. | Figura S
|
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a TEPADINA 400 mg PÓ E SOLVENTE PARA SOLUÇÃO PARA PERFUSÃOForma farmacêutica: PERFURAÇÃO INJETÁVEL, 100 mgSubstância ativa: thiotepaFabricante: Adienne S.R.L.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 15 mgSubstância ativa: thiotepaFabricante: Adienne S.R.L.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 100 mgSubstância ativa: thiotepaFabricante: Esteve Pharmaceuticals GmbhRequer receita médica
Alternativas a TEPADINA 400 mg PÓ E SOLVENTE PARA SOLUÇÃO PARA PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a TEPADINA 400 mg PÓ E SOLVENTE PARA SOLUÇÃO PARA PERFUSÃO em Polónia
Alternativa a TEPADINA 400 mg PÓ E SOLVENTE PARA SOLUÇÃO PARA PERFUSÃO em Ukraine
Médicos online para TEPADINA 400 mg PÓ E SOLVENTE PARA SOLUÇÃO PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de TEPADINA 400 mg PÓ E SOLVENTE PARA SOLUÇÃO PARA PERFUSÃO – sujeita a avaliação médica e regras locais.