
SIRTURO 100 MG COMPRIMIDOS

Pergunte a um médico sobre a prescrição de SIRTURO 100 MG COMPRIMIDOS

Como usar SIRTURO 100 MG COMPRIMIDOS
Introdução
Prospecto: informação para o paciente
SIRTURO 100 mg comprimidos
Bedaquilina
Este medicamento está sujeito a acompanhamento adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da seção 4 inclui informação sobre como comunicar esses efeitos adversos.
Leia todo o prospecto atentamente antes de começar a tomar este medicamento, porque
contém informação importante para si.
- Conserva este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas, pois pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é SIRTURO e para que é utilizado
- O que precisa saber antes de começar a tomar SIRTURO
- Como tomar SIRTURO
- Possíveis efeitos adversos
- Conservação de SIRTURO
- Conteúdo do envase e informação adicional
1. O que é SIRTURO e para que é utilizado
SIRTURO contém o princípio ativo bedaquilina.
SIRTURO é um tipo de antibiótico. Os antibióticos são medicamentos que destroem bactérias
causadoras de doenças.
SIRTURO é utilizado para tratar a tuberculose que afeta os pulmões quando a doença se tornou resistente a outros antibióticos. É o que se denomina tuberculose pulmonar multirresistente.
SIRTURO deve ser utilizado sempre em conjunto com outros medicamentos para o tratamento da tuberculose.
É utilizado em adultos de 18 ou mais anos de idade.
2. O que precisa saber antes de começar a tomar SIRTURO
Não tome SIRTURO:
- se é alérgico à bedaquilina ou a qualquer um dos outros componentes deste medicamento (incluídos na seção 6). Não tome SIRTURO se o anterior se aplica ao seu caso. Se não tiver certeza, consulte o seu médico ou farmacêutico antes de tomar SIRTURO.
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a tomar SIRTURO, se:
- apresenta alguma anomalia no eletrocardiograma (ECG) ou insuficiência cardíaca;
- tem antecedentes pessoais ou familiares de um problema cardíaco chamado “síndrome do QT prolongado congênito”;
- tem uma diminuição da função da glândula tireoide. Isso pode ser observado em um exame de sangue;
- tem uma doença hepática ou se bebe álcool habitualmente;
- tem uma infecção pelo vírus da imunodeficiência humana (VIH).
Se alguma das situações anteriores se aplica ao seu caso (ou se tiver dúvidas), fale com o seu médico, farmacêutico ou enfermeiro antes de tomar SIRTURO.
Crianças e adolescentes
Não administre este medicamento a crianças e adolescentes (menores de 18 anos), pois não foi estudado neste grupo etário.
Toma de SIRTURO com outros medicamentos
Outros medicamentos podem afetar o SIRTURO. Informe o seu médico ou farmacêutico se está tomando, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
A seguir, são indicados exemplos de medicamentos que os pacientes com tuberculose multirresistente podem tomar e que podem interagir potencialmente com o SIRTURO:
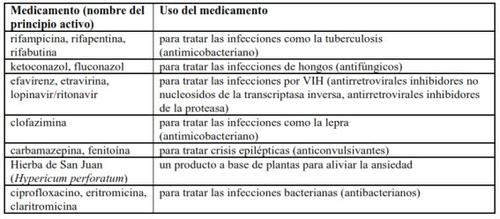
Toma de SIRTURO com álcool
Não deve ingerir álcool enquanto estiver tomando SIRTURO.
Gravidez e lactação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Condução e uso de máquinas
É possível que se sinta mareado após tomar SIRTURO. Se isso acontecer, não conduza nem utilize máquinas.
SIRTURO contém lactosa monohidrato
SIRTURO contém “lactosa” (um tipo de açúcar). Se tem intolerância a alguns açúcares ou não pode digeri-los, fale com o seu médico antes de tomar este medicamento.
3. Como tomar SIRTURO
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
SIRTURO deve ser utilizado sempre em conjunto com outros medicamentos para o tratamento da tuberculose. O seu médico decidirá quais outros medicamentos deve tomar com SIRTURO.
Qual quantidade deve tomar
Tome SIRTURO durante um período de 24 semanas.
Primeiras 2 semanas:
- Tome 400 mg (4 comprimidos de 100 mg) uma vez ao dia.
Da semana 3 à semana 24:
- Tome 200 mg (2 comprimidos de 100 mg) uma vez ao dia durante 3 dias por semana apenas.
- Deve transcorrer um intervalo mínimo de 48 horas entre doses sempre que tomar SIRTURO. Por exemplo, pode tomar SIRTURO nas segundas, quartas e sextas-feiras todas as semanas a partir da semana 3.
É possível que tenha que continuar tomando os outros medicamentos para a tuberculose durante um período superior a 6 meses. Consulte o seu médico ou farmacêutico.
Como tomar este medicamento
- Tome SIRTURO com alimentos. Os alimentos são importantes para conseguir os níveis
- adequados do medicamento no seu corpo.
- Engula os comprimidos inteiros com água.
Se tomar mais SIRTURO do que deve
Se tomar mais SIRTURO do que deve, informe o seu médico imediatamente. Leve consigo o envase do medicamento.
Se esquecer de tomar SIRTURO
Durante as primeiras 2 semanas
- Omita a dose esquecida e tome a dose seguinte à sua hora habitual.
- Não tome uma dose dupla para compensar as doses esquecidas.
A partir da semana 3
- Tome a dose esquecida de 200 mg o mais cedo possível.
- Reinicie a pauta de três vezes por semana
Se esquecer de tomar uma dose e não tiver certeza do que deve fazer, fale com o seu médico ou farmacêutico.
Se interromper o tratamento com SIRTURO
Não deixe de tomar SIRTURO sem falar antes com o seu médico.
A omissão de doses ou a não finalização do ciclo completo de tratamento pode:
- tornar o tratamento ineficaz e piorar a tuberculose e;
- aumentar a probabilidade de que a bactéria se torne resistente ao medicamento. Isso pode fazer com que a sua doença não responda ao tratamento com SIRTURO ou a outros medicamentos no futuro.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Assim como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Muito frequentes(podem afetar mais de 1 em cada 10 pessoas):
- dor de cabeça
- dor nas articulações
- sensação de mareio
- sentir-se ou estar doente (náuseas ou vômitos)
Frequentes(podem afetar até 1 em cada 10 pessoas):
- diarreia
- elevação das enzimas hepáticas (aparece nos exames de sangue)
- dor ou hipersensibilidade muscular, não causada por exercício
- anomalia detectada no eletrocardiograma chamada “prolongação do intervalo QT”. Informe imediatamente ao seu médico se sofrer um desmaio.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de SIRTURO
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa após CAD.
A data de validade é o último dia do mês que se indica.
Conservar SIRTURO no embalagem ou envase original para protegê-lo da luz.
Este medicamento pode ter risco para o meio ambiente. Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de SIRTURO
- O princípio ativo é bedaquilina. Cada comprimido contém fumarato de bedaquilina equivalente a 100 mg de bedaquilina.
- Os demais componentes são: sílica coloidal anidra, croscarmelosa sódica, hipromelosa, lactosa monohidrato, estearato de magnésio, amido de milho, celulose microcristalina, polissorbato 20.
Aspecto do produto e conteúdo do envase
Comprimido não revestido, de cor branca a esbranquiçada, redondo, biconvexo, de 11 mm de diâmetro, com a inscrição “T” sobre “207” gravada em uma face e “100” na outra.
Frasco de plástico com 188 comprimidos.
Envase que contém 4 tiras de blister (que contêm 6 comprimidos por tira).
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização
Janssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Bélgica
Responsável pela fabricação
Janssen Pharmaceutica NV
Turnhoutseweg 30
B-2340 Beerse
36
Bélgica
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica Janssen-Cilag NV Antwerpseweg 15-17 B-2340 Beerse Tel/Tél: +32 14 64 94 11 | Lituânia UAB "JOHNSON & JOHNSON" Konstitucijos pr. 21C LT-08130 Vilnius Tel: +370 5 278 68 88 |
Bulgária „Johnson & Johnson“ EAD ?.?. ??????? 4 ?????? ???? ?????, ?????? 4 ????? 1766 ???.: +359 2 489 94 00 | Luxemburgo Janssen-Cilag NV Antwerpseweg 15-17 B-2340 Beerse Bélgica Tél/Tel: +32 14 64 94 11 |
República Checa Janssen-Cilag s.r.o. Walterovo námestí 329/1 CZ-158 00 Praga 5 – Jinonice Tel: +420 227 012 227 | Hungria Janssen-Cilag Kft. Nagyenyed u. 8-14 H-1123 Budapeste Tel.: +36 1 884 2858 |
Dinamarca Janssen-Cilag A/S Bregnerødvej 133 DK-3460 Birkerød Tlf: +45 45 94 82 82 | Malta AM MANGION LTD. Mangion Building, Triq Gdida fi Triq Valletta MT-Hal-Luqa LQA 6000 Tel: +356 2397 6000 |
Alemanha Janssen-Cilag GmbH Johnson & Johnson Platz 1 D-41470 Neuss Tel: +49 2137 955-955 | Países Baixos Janssen-Cilag B.V. Graaf Engelbertlaan 75 NL-4837 DS Breda Tel: +31 76 711 1111 |
Estônia UAB "JOHNSON & JOHNSON" filial na Estônia Lõõtsa 2 EE-11415 Tallinn Tel: +372 617 7410 | Noruega Janssen-Cilag AS Postboks 144 NO-1325-Lysaker Tlf: +47 24 12 65 00 |
Grécia Janssen-Cilag Faρµaκeυtικ? Α.Ε.Β.Ε. Λeωf?ρος Ειρ?νης 56 GR-151 21 Πe?κη, Αθ?νa Tηλ: +30 210 80 90 000 | Áustria Janssen-Cilag Pharma GmbH Vorgartenstraße 206B A-1020 Viena Tel: +43 1 610 300 |
Espanha Janssen-Cilag, S.A. Paseo de las Doce Estrellas, 5-7 E-28042 Madrid Tel: +34 91 722 81 00 | Polônia Janssen-Cilag Polska Sp. z o.o. ul. Ilzecka 24 PL-02-135 Varsóvia Tel.: +48 22 237 60 00 |
França Janssen-Cilag 1, rue Camille Desmoulins, TSA 91003 F-92787 Issy Les Moulineaux, Cedex 9 Tél: 0 800 25 50 75 / +33 1 55 00 40 03 | Portugal Janssen-Cilag Farmacêutica, Lda. Lagoas Park, Edifício 9 2740-262 Porto Salvo PORTUGAL Tel: +351 214 368 600 |
Croácia Johnson & Johnson S.E. d.o.o. Oreškoviceva 6h 10010 Zagreb Tel: +385 1 6610 700 | Romênia Johnson & Johnson România SRL Str. Tipografilor nr. 11-15 Cladirea S-Park, Corp B3-B4, Etaj 3 013714 Bucareste, ROMÂNIA Tel: +40 21 207 1800 |
Irlanda Janssen Sciences Ireland UC Barnahely Ringaskiddy IRL – Co. Cork P43 FA46 Tel: +353 1 800 709 122 | Eslovênia Johnson & Johnson d.o.o. Šmartinska cesta 53 SI-1000 Liubliana Tel: +386 1 401 18 00 |
Islândia Janssen-Cilag AB c/o Vistor hf. Hörgatúni 2 IS-210 Garðabær Sími: +354 535 7000 | Eslováquia Johnson & Johnson s.r.o. CBC III, Karadžicova 12 SK-821 08 Bratislava Tel: +421 232 408 400 |
Itália Janssen-Cilag SpA Via M.Buonarroti, 23 I-20093 Cologno Monzese MI Tel: +39 02 2510 1 | Finlândia Janssen-Cilag Oy Vaisalantie/Vaisalavägen 2 FI-02130 Espoo/Esbo Puh/Tel: +358 207 531 300 |
Chipre Βaρν?ßaς Χatζηpaνaγ?ς Λtd, Λeωf?ρος Gι?ννου Κrανιdι?tη 226 Λatsι? CY-2234 Λeυκωs?a Τηλ: +357 22 207 700 | Suécia Janssen-Cilag AB Box 4042 SE-16904 Solna Tel: +46 8 626 50 00 |
Letônia UAB "JOHNSON & JOHNSON" filial na Letônia Mukusalas iela 101 Riga, LV-1004 Tel: +371 678 93561 | Reino Unido Janssen-Cilag Ltd. 50-100 Holmers Farm Way High Wycombe Buckinghamshire HP12 4EG - UK Tel: +44 1 494 567 444 |
Data da última revisão deste prospecto
Este medicamento foi autorizado com uma “aprovação condicional”.
Esta modalidade de aprovação significa que se espera obter mais informações sobre este medicamento. A Agência Europeia de Medicamentos revisará as novas informações sobre este medicamento pelo menos uma vez ao ano e este prospecto será atualizado quando necessário.
A informação detalhada sobre este medicamento está disponível na página web da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a SIRTURO 100 MG COMPRIMIDOSForma farmacêutica: COMPRIMIDO, 100 mgSubstância ativa: bedaquilineFabricante: Janssen-Cilag International N.VRequer receita médicaForma farmacêutica: COMPRIMIDO, 50 mgSubstância ativa: delamanidFabricante: Otsuka Novel Products GmbhRequer receita médicaForma farmacêutica: COMPRIMIDO, 400 mgSubstância ativa: ethambutolFabricante: Teofarma S.R.L.Requer receita médica
Médicos online para SIRTURO 100 MG COMPRIMIDOS
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de SIRTURO 100 MG COMPRIMIDOS – sujeita a avaliação médica e regras locais.














