
Rixubis 250 UI/frasco pó e solvente para solução injetável
Pergunte a um médico sobre a prescrição de Rixubis 250 UI/frasco pó e solvente para solução injetável

Como usar Rixubis 250 UI/frasco pó e solvente para solução injetável
Introdução
Prospecto: informação para o utilizador
RIXUBIS250UI Pó edissolvente para solução injetável
RIXUBIS500UI Pó edissolvente para solução injetável
RIXUBIS1000UI Pó edissolvente para solução injetável
RIXUBIS2000UI Pó edissolvente para solução injetável
RIXUBIS3000UI Pó edissolvente para solução injetável
Nonacog gama (fator IX humano de coagulação recombinante)
Este medicamento está sujeito a vigilância adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da seção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de começar ausar este medicamento porque contém informação importante para si.
- Conservar este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas a si, e não deve dá-lo a outras pessoas, ainda que tenham os mesmos sintomas que si, pois pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é RIXUBIS e para que é utilizado
- O que precisa saber antes de começar a usar RIXUBIS
- Como usar RIXUBIS
- Possíveis efeitos adversos
- Conservação de RIXUBIS
- Conteúdo do envase e informação adicional
1. O que é RIXUBIS e para que é utilizado
RIXUBIS contém o princípio ativo nonacog gama e é um fator IX humano de coagulação. O Fator IX é um componente normal do sangue humano necessário para a sua correta coagulação, RIXUBIS é utilizado em pacientes com hemofilia B (doença de Christmas, um distúrbio hereditário do sangue causado por uma deficiência de fator IX). Actua substituindo o fator IX que falta para permitir que o sangue do paciente se coagule.
RIXUBIS é utilizado para o tratamento e a prevenção de hemorragias em pacientes com hemofilia B de todos os grupos etários.
2. O que precisa saber antes de começar a usar RIXUBIS
Não use RIXUBIS
- se é alérgico a nonacog gama ou a qualquer um dos outros componentes deste medicamento (incluídos na seção 6)
- se é alérgico às proteínas de hámster
Advertências eprecauções
É possível que se produzam reacções de hipersensibilidade de tipo alérgico com RIXUBIS. Detenha a perfusão e entre em contacto imediatamente com o seu médico ou procure atendimento médico urgente se experimentar os primeiros sinais das reacções de hipersensibilidade/alergia como habão urticarial, erupção, tirantez no peito, sibilância, pressão arterial baixa ou anafilaxia (reação alérgica grave que pode causar dificuldade para engolir e/ou respirar, cara e/ou mãos vermelhas ou inchadas). É possível que o seu médico precise tratá-lo imediatamente em caso de estas reacções. É possível que o seu médico também lhe faça um exame de sangue para comprovar se desenvolveu anticorpos neutralizantes da atividade (inibidores) face ao medicamento, pois os inibidores podem desenvolver-se juntamente com as alergias. Os pacientes com inibidores de fator IX podem ter um maior risco de anafilaxia durante o tratamento posterior com fator IX.
Consulte imediatamente o seu médico se a hemorragia não se detém da maneira esperada ou se experimenta um aumento significativo do uso de RIXUBIS para controlar uma hemorragia. O seu médico fará um exame de sangue para comprovar se desenvolveu anticorpos neutralizantes da atividade (inibidores) face a RIXUBIS. O risco de desenvolver inibidores é maior em pacientes a quem não foi administrado anteriormente um medicamento substituto de fator IX ou nas primeiras fases do tratamento, ou seja, no caso de crianças pequenas.
A produção de fator IX no corpo é controlada pelo gene de fator IX. Os pacientes que têm mutações específicas do seu gene de fator IX, como por exemplo uma eliminação maior, talvez tenham mais probabilidades de ter inibidores de fator IX e uma reação alérgica nas primeiras fases com qualquer concentrado de fator IX. Por isso, se se sabe que tem tal mutação, o seu médico o controlará com maior cuidado para detectar sinais de uma reação alérgica.
Se padece doença hepática ou cardíaca, ou se se submeteu recentemente a uma intervenção cirúrgica importante, informe o seu médico, pois existe um maior risco de complicações na coagulação do sangue.
Foram notificados casos de distúrbios renais (síndrome nefrótico) após a administração de doses elevadas de fator IX em pacientes com hemofilia B que tinham inibidores de fator IX e antecedentes de reações alérgicas.
Sempre que seja possível, anote o nome do medicamento e o número do lote cada vez que utilize RIXUBIS (por exemplo, no seu diário) para manter um registo dos medicamentos e dos lotes que utilizou.
Uso de RIXUBIS com outros medicamentos
Informar o seu médico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento. Não foram notificadas interacções de RIXUBIS com outros medicamentos.
Gravidez, lactação efertilidade
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar este medicamento. A hemofilia B aparece em muito raras ocasiões em mulheres.
Condução euso de máquinas
A influência de RIXUBIS sobre a capacidade para conduzir e utilizar máquinas é nula.
RIXUBIS contém sódio
Este medicamento contém 19 mg de sódio por frasco, o que se deve ter em conta em pacientes com dietas pobres em sódio.
3. Como usar RIXUBIS
O tratamento com RIXUBIS será iniciado por um médico com experiência no tratamento de pacientes com hemofilia B.
Siga exactamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico.
O seu médico decidirá a dose de RIXUBIS que lhe será administrada. Esta dose e a duração dependerão da gravidade da sua deficiência de fator IX, da localização e da extensão da hemorragia, bem como do seu estado clínico, a idade e a rapidez com que o seu corpo consome o fator IX, que se deve comprovar regularmente.
O seu médico ou enfermeiro administrarão RIXUBIS mediante perfusão intravenosa (IV) após reconstituir o pó com o dissolvente fornecido. O senhor ou qualquer outra pessoa também podem administrar a injeção de RIXUBIS, mas apenas após receber a formação adequada.
Reconstituição e administração
- Para a reconstituição, utilize apenas o dissolvente e o dispositivo de reconstituição (BAXJECT II) incluídos no envase.
- Para a administração é necessário o uso de uma seringa luer lock.
- Não utilize se o equipamento BAXJECT II, o sistema estéril de proteção ou o seu envase está danificado ou mostra algum sinal de deterioração.
Reconstituição
Utilizar técnica asséptica:
- Se o medicamento se encontra na geladeira, retire da geladeira os frascos de pó e de dissolvente de RIXUBIS e espere até que atinjam a temperatura ambiente (entre 15°C e 30°C).
- Lave as mãos com sabão e água morna.
- Retire os protetores dos frascos de pó e dissolvente.
- Limpe os tampões com as toalhetas impregnadas de álcool. Coloque os frascos em uma superfície plana e limpa.
- Abrir o invólucro do equipamento BaxJect II retirando a tampa de papel sem tocar o interior (Fig. a). Não retire o equipamento do invólucro.
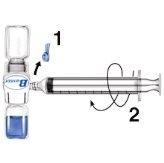
- Dê a volta ao invólucro e insira a ponta de plástico através do tampão do dissolvente. Pegue o invólucro pelo seu extremo e retire o equipamento BaxJect II do invólucro (Fig. b). Não retire o protetor azul do equipamento BAXJECT II.
- Com Baxject II unido ao frasco de dissolvente, inverta o sistema de tal forma que o frasco de dissolvente esteja na parte superior do equipamento. Insira a ponta de plástico branca dentro do tampão do frasco de pó RIXUBIS. O vácuo fará com que o dissolvente penetre no frasco de pó RIXUBIS (Fig. c).
- Agite suavemente até que todo o material se dissolva. O medicamento se dissolve rapidamente (em cerca de 2 minutos). Certifique-se de que RIXUBIS esteja completamente dissolvido, se não estiver, toda a solução reconstituída não passará através do filtro do equipamento. Devem ser inspecionados visualmente os medicamentos reconstituídos para detectar partículas ou decoloração antes da administração. A solução deve ser transparente ou ligeiramente opalescente. Não utilize soluções turvas ou com depósitos.
Fig. aFig. bFig. c



Não refrigere a preparação após a reconstituição.
Utilize imediatamente.
Administração
Utilizar técnica asséptica:
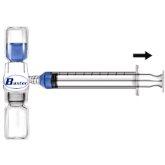
- Retire o protetor azul do equipamento BAXJECT II. Não introduza ar na seringa. Conecte a seringa ao equipamento BAXJECT II (Fig. d).
- Inverta o sistema (o frasco com a solução reconstituída na parte superior). Introduza a solução reconstituída na seringa, puxando o êmbolo para trás lentamente (Fig. e).
- Desconecte a seringa.
- Conecte uma agulha de perfusão com aletas à seringa. Injete por via intravenosa. A solução deve ser administrada lentamente, a uma velocidade determinada de acordo com o nível de confort do paciente, que não exceda 10 ml por minuto.
Fig. dFig. e
Sempre que seja possível, anote o nome do medicamento e o número do lote cada vez que utilize RIXUBIS (por exemplo, no seu diário) para manter um registo dos medicamentos e dos lotes que utilizou.
A eliminação do medicamento não utilizado e de todos os materiais que estiveram em contacto com ele será realizada de acordo com a regulamentação local.
Se usar mais RIXUBIS do que deve
Siga exactamente as instruções de administração de RIXUBIS indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico. Se injetar uma dose maior de RIXUBIS do que a recomendada, consulte o seu médico o mais breve possível.
Se esquecer de usar RIXUBIS
Não se injete uma dose dupla para compensar as doses esquecidas. Administre a próxima injeção como está estabelecido e continue como o seu médico indicou.
Se interromper o tratamento com RIXUBIS
Não deixe de usar RIXUBIS sem consultar o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
É possível que se produzam reacções de hipersensibilidade de tipo alérgico com RIXUBIS. Entre estas reacções incluem-se sensações de ardor e picadas no local de perfusão, arrepios, rubor, letargia, inquietude, formigamento, habão urticarial, picazón e erupção, pressão arterial baixa, frequência cardíaca rápida, tirantez no peito, sibilância, inchação da garganta, anafilaxia (reação alérgica grave), dor de cabeça, náuseas e vómitos. Consulte imediatamente o seu médico se experimentar estes sinais. É possível que o seu médico precise tratá-lo imediatamente em caso de estas reacções (ver seção 2 ‘Advertências e precauções’).
Foram observados os seguintes efeitos adversos com RIXUBIS:
Efeitos adversos frequentes(podem afectar até 1 em cada 10 pacientes)
- alteração do gosto
- dor nas extremidades.
Efeitos adversos com frequência desconhecida(não se pode estimar a frequência a partir dos dados disponíveis)
- reacções alérgicas (hipersensibilidade).
Não foram observados com este medicamento problemas causados por uma coagulação excessiva do sangue (episódios tromboembólicos), mas podem ocorrer com qualquer produto de fator IX. Entre estes, incluem-se ataques cardíacos, coágulos de sangue nas veias ou no pulmão.
Comunicaçãode efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informação sobre a segurança deste medicamento.
5. Conservação de RIXUBIS
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no embalagem exterior e na etiqueta do frasco após CAD. A data de validade é o último dia do mês que se indica.
Conservar abaixo de 30°C.
Não congelar.
Utilize a solução reconstituída imediatamente.
Não utilize RIXUBIS se a solução não for incolor e transparente.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de RIXUBIS
- O princípio ativo é nonacog gama (fator IX humano de coagulação recombinante). Cada frasco contém nominalmente 250, 500, 1000, 2000 ou 3000 UI, correspondentes a uma concentração de 50, 100, 200, 400 ou 600 UI/ml após a reconstituição com 5 ml de dissolvente.
- Os demais componentes do pó são sacarose, manitol, cloreto de sódio, cloreto de cálcio, L-histidina, polissorbato 80.
Frasco de dissolvente: 5 ml de água esterilizada para preparações injetáveis.
Aspecto do produto econteúdo do envase
RIXUBIS é fornecido como pó e dissolvente para solução injetável.
O conteúdo do envase é o seguinte:
- um frasco de pó RIXUBIS 250, 500, 1000, 2000 ou 3000 UI em um frasco de vidro com um fecho de borracha
- um frasco de 5 ml de água esterilizada para preparações injetáveis em um frasco de vidro com um fecho de borracha
- um BAXJECT II (equipamento de reconstituição sem agulhas)
Título da autorização de comercialização
Baxalta Innovations GmbH
Industriestrasse 67
A-1221 Viena
Responsável pela fabricação
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B-7860 Lessines
Bélgica
Baxter SA
Boulevard René Branquart 80
B-7860 Lessines
Bélgica
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica Baxalta Belgium SPRL Tel: +32 2 892 62 00 | Lituânia UAB "Baxter Lithuania" Tel: +370 5 269 16 90/+370 5 252 71 00 |
Bulgária ??????? ???????? ???? ???.: +359 2 9808482 | Luxemburgo Baxalta Belgium SPRL Tel: +32 2 892 62 00 |
República Tcheca Baxter Czech spol.s.r.o. Tel.: +420 225774111 | Hungria Baxter Hungary Kft. Tel.: +361 202 19 80 |
Dinamarca Baxalta Denmark A/S Tlf: +45 32 70 12 00 | Malta Baxalta UK Limited Tel.: +44 1 635 798 777 |
Alemanha Baxalta Deutschland GmbH Tel: +49 89 262077-011 | Países Baixos Baxalta Netherlands B.V. Tel: +31 30 799 27 77 |
Estônia OÜ Baxter Estonia Tel.: +372 6 515 120 | Noruega Baxalta AS Tlf: +47 22 585 000 |
Grécia Baxter (Hellas) Ε.Π.Ε. Τηλ.: +30 210 28 80 000 | Áustria Baxalta Österreich GmbH Tel.: +43 1 20100-0 |
Espanha Baxalta Spain S.L. Tel: +34 91 790 42 22 | Polônia Baxter Polska Sp. z o.o. Tel.: +48 22 4883 777 |
França Baxalta France S.A.S. Tél: +33 1 70 96 06 00 | Portugal Baxalta Portugal, Unipessoal, Lda. Tel: +351 21 122 03 00 |
Croácia Baxter d.o.o. Tel: +386 1 420 16 80 | Romênia FARMACEUTICA REMEDIA SA Tel.: +40 21 321 16 40 |
Irlanda Baxalta UK Limited Tel: +44 1 635 798 777 | Eslovênia Baxter d.o.o. Tel.: +386 1 420 16 80 |
Islândia Lyfjaver ehf. Sími: +354 533 6100 | República Eslovaca Baxter Slovakia s.r.o. Tel: +421 2 3210 1150 |
Itália Baxalta Italy S.r.l. Tel: +39 06 45224 600 | Finlândia Baxalta Finland Oy Puh/Tel: +358 201478200 |
Chipre Baxter (Hellas) Ε.Π.Ε. Τηλ.: +30 210 28 80 000 | Suécia Baxalta Sweden AB Tel: +46 8 50 53 26 00 |
Letônia SIA BAXTER Latvia Tel.: +371 67 784 784 | Reino Unido Baxalta UK Limited Tel: +44 1 635 798 777 |
Data da última revisão deste resumo
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Esta informação é destinada apenas a profissionais do setor de saúde:
Supervisão do tratamento
Durante o tratamento, é recomendada a determinação adequada dos níveis de fator IX para calcular a dose que deve ser administrada e a frequência das perfusões repetidas. Os pacientes individuais podem diferir em sua resposta ao fator IX com diferentes meias-vidas e recuperações. A dose baseada no peso corporal pode requerer um ajuste em pacientes com baixo peso ou sobrepeso. No caso particular de intervenções cirúrgicas importantes, é indispensável uma supervisão precisa da terapia de substituição por meio de análises de coagulação (atividade do fator IX de plasma).
Para garantir que o nível plasmático de atividade de fator IX desejado tenha sido alcançado, é aconselhável realizar um controle exhaustivo utilizando um ensaio adequado de atividade de fator IX e, se necessário, aplicar os ajustes adequados à dose e à frequência das perfusões repetidas. Ao utilizar o ensaio in vitro de coagulação em uma etapa baseado no tempo de tromboplastina (aPTT) para determinar a atividade do fator IX em amostras sanguíneas de pacientes, os resultados de atividade do fator IX podem ser significativamente afetados pelo tipo de reagente de aPTT e pelo padrão de referência utilizado no ensaio. Isso é especialmente importante ao mudar o laboratório e/ou os reagentes utilizados no ensaio.
Posologia
A dose e a duração da terapia de substituição dependem da gravidade da deficiência de fator IX, da localização e extensão da hemorragia, bem como do estado clínico, idade e parâmetros farmacocinéticos de fator IX do paciente, como a recuperação incremental e meia-vida.
O número de unidades de fator IX administradas é expresso em unidades internacionais (UI), que estão relacionadas com o padrão atual da OMS para produtos de fator IX. A atividade de fator IX no plasma é expressa como um percentual (relativo ao plasma humano normal) ou em unidades internacionais (relativas a um padrão internacional para o fator IX no plasma).
Uma unidade internacional (UI) de atividade de fator IX é equivalente à quantidade de fator IX existente em um ml de plasma humano normal.
Tratamento à demanda
O cálculo da dose necessária de fator IX é baseado no achado empírico de que 1 unidade internacional (UI) de fator IX por kg de peso corporal incrementa a atividade de fator IX do plasma em 0,9 UI/dl (intervalo de 0,5 a 1,4 UI/dl) ou 0,9% de atividade normal em pacientes de 12 anos de idade ou mais (para obter informações adicionais, ver seção 5.2).
A dose necessária é determinada utilizando a seguinte fórmula:
Pacientes de 12 anos de idade ou mais
Unidades requeridas | = | peso corporal (kg) | x | aumento desejado de fator IX (%) ou (UI/dl) | x | recíproco de recuperação observada (dl/kg) |
Para uma recuperação incremental de 0,9 UI/dl por UI/kg, a dose é calculada da seguinte maneira:
Unidades requeridas | = | peso corporal (kg) | x | aumento desejado de fator IX (%) ou (UI/dl) | x | 1,1 dl/kg |
A quantidade que deve ser administrada e a frequência da administração devem estar sempre orientadas à eficácia clínica no caso concreto.
No caso dos episódios hemorrágicos subsequentes, a atividade de fator IX não deve ser inferior ao nível de atividade plasmática dada (em % do normal ou UI/dl) no período correspondente. Pode-se utilizar a seguinte tabela como guia de dosificação em episódios hemorrágicos e cirurgia:
Grau de hemorragia / tipo de procedimento cirúrgico | Nível de fator IX requerido (%) ou (UI/dl) | Frequência de dose (horas) / duração da terapia (dias) |
Hemorragia Hemartrose incipiente ou hemorragia muscular ou oral Hemartrose mais extensa, hemorragia muscular ou hematoma Hemorragia com risco vital. | 20 – 40 30 – 60 60 – 100 | Repetir a cada 24 horas. Pelo menos 1 dia, até que o episódio hemorrágico, segundo indique a dor, se resolva ou se logre a cura. Repetir perfusão a cada 24 horas durante 3 – 4 dias ou mais, até que cesse a dor e a incapacidade aguda. Repetir perfusão a cada 8 a 24 horas até superar o perigo. |
Cirurgia Cirurgia menor, incluindo extração dental | 30 – 60 | Cada 24 horas, pelo menos 1 dia, até lograr a cura. |
Operação importante | 80 – 100 (pré e pós-operatório) | Repetir perfusão a cada 8 a 24 horas até que se consiga uma cura adequada da ferida, e luego pelo menos outros 7 dias de terapia para manter uma atividade de fator IX de 30% a 60% (UI/dl). |
É especialmente importante uma supervisão cuidadosa da terapia de substituição nos casos de operação importante ou hemorragia potencialmente mortal.
Profilaxia
Para a profilaxia de longa duração contra hemorragias em pacientes com hemofilia B grave, as doses normais são de 40 a 60 UI de fator IX por quilograma de peso corporal a intervalos de 3 a 4 dias para os pacientes de 12 anos de idade ou mais. Em alguns casos, dependendo dos parâmetros farmacocinéticos, idade, fenótipo de hemorragia e atividade física do paciente, pode ser necessário intervalos de dosificação mais curtos ou doses mais altas.
Perfusão contínua
Não administre RIXUBIS por perfusão contínua.
População pediátrica
Tratamento à demanda:
O cálculo da dose de fator IX necessária é baseado no achado empírico de que 1 unidade internacional (UI) de fator IX por kg de peso corporal incrementa a atividade de fator IX do plasma em 0,7 UI/dl (intervalo de 0,31 a 1,0 UI/dl) ou 0,7% da atividade normal em pacientes com menos de 12 anos de idade (para obter informações adicionais, ver seção 5.2).
A dosagem necessária é determinada mediante a seguinte fórmula:
Pacientes com menos de 12 anos de idade:
Unidades requeridas | = | peso corporal (kg) | x | aumento desejado de fator IX (%) ou (UI/dl) | x | recíproco de recuperação observada (dl/kg) |
Para uma recuperação incremental de 0,7 UI/dl por UI/kg, a dose é calculada da seguinte maneira:
Unidades requeridas | = | peso corporal (kg) | x | aumento desejado de fator IX (%) ou (UI/dl) | x | 1,4 dl/kg |
Pode-se utilizar a mesma tabela para adultos como guia de dosificação em episódios hemorrágicos e cirurgia (ver anterior).
Profilaxia:
O intervalo de doses recomendadas para pacientes pediátricos com menos de 12 anos de idade é de 40 a 80 UI/kg a intervalos de 3 a 4 dias. Em alguns casos, dependendo dos parâmetros farmacocinéticos, idade, fenótipo de hemorragia e atividade física do paciente, pode ser necessário intervalos de dosificação mais curtos ou doses mais altas.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Rixubis 250 UI/frasco pó e solvente para solução injetávelForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médicaForma farmacêutica: INJETÁVEL, 2.000 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médicaForma farmacêutica: INJETÁVEL, 250 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médica
Alternativas a Rixubis 250 UI/frasco pó e solvente para solução injetável noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Rixubis 250 UI/frasco pó e solvente para solução injetável em Polónia
Alternativa a Rixubis 250 UI/frasco pó e solvente para solução injetável em Ukraine
Médicos online para Rixubis 250 UI/frasco pó e solvente para solução injetável
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Rixubis 250 UI/frasco pó e solvente para solução injetável – sujeita a avaliação médica e regras locais.














