REFIXIA 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de REFIXIA 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como usar REFIXIA 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Refixia500UI pó em forma de pó e dissolvente para solução injectável
Refixia 1000UI pó em forma de pó e dissolvente para solução injectável
Refixia 2000UI pó em forma de pó e dissolvente para solução injectável
Refixia 3000UI pó em forma de pó e dissolvente para solução injectável
nonacog beta pegol
Este medicamento está sujeito a monitorização adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da secção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Refixia e para que é utilizado
- O que precisa saber antes de começar a usar Refixia
- Como usar Refixia
- Possíveis efeitos adversos
- Conservação de Refixia
- Conteúdo do envase e informação adicional
1. O que é Refixia e para que é utilizado
O que é Refixia
Refixia contém o princípio ativo nonacog beta pegol. É uma versão do factor IX de acção prolongada. O factor IX é uma proteína que se encontra de forma natural no sangue e que ajuda a parar o sangramento.
Para que é utilizado Refixia
Refixia é utilizado para tratar e prevenir episódios de sangramento em doentes de todas as idades com hemofilia B (deficiência congénita do factor IX).
Nos doentes com hemofilia B, o factor IX falta ou não funciona correctamente. Refixia substitui este factor IX que falta ou não funciona correctamente e ajuda a que o sangue forme coágulos no local do sangramento.
2. O que precisa saber antes de começar a usar Refixia
Não use Refixia
- se é alérgico ao princípio ativo ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
- se é alérgico às proteínas de hámster.
Se se encontrar em alguma das situações acima ou não tiver certeza, consulte o seu médico antes de usar este medicamento.
Advertências e precauções
Rastreabilidade
É importante manter um registo do número do lote de Refixia. Por isso, cada vez que obter uma nova caixa de Refixia, deve anotar a data e o número do lote (que figura no envase após Lote) e guardar esta informação num local seguro.
Reacções alérgicas e desenvolvimento de inibidores
Existe um risco mínimo de que possa ocorrer uma reacção alérgica repentina e grave (p. ex., uma reacção anafiláctica) a Refixia. Pare a injeção e contacte o seu médico ou o serviço de urgência imediatamente se apresentar sinais de uma reacção alérgica, como erupção, habões, ronchas, picazón em amplas zonas da pele, enrubescimento e/ou inchação dos lábios, da língua, da face ou das mãos, dificuldade para engolir ou respirar, falta de ar, sibilância, opressão no peito, pele pálida e fria, palpitações e/ou tontura.
É possível que o seu médico precise tratar rapidamente estas reacções. É possível que o seu médico também lhe faça um exame de sangue para comprovar se desenvolveu inibidores do factor IX (anticorpos neutralizantes) face ao seu medicamento, porque os inibidores podem desenvolver-se juntamente com reacções alérgicas. Se desenvolver tais inibidores, poderá ter um maior risco de experimentar reacções alérgicas repentinas e graves (p. ex., reacções anafilácticas) durante o tratamento futuro com factor IX.
Devido ao risco de experimentar reacções alérgicas com o factor IX, o seu tratamento inicial com Refixia deve ser realizado num centro de saúde ou na presença de um profissional de saúde que possa fornecer-lhe a atenção de saúde adequada a reacções alérgicas, se necessário.
Fale com o seu médico imediatamente se o sangramento não parar como se esperava ou se precisar aumentar significativamente a quantidade de Refixia que precisa para parar um sangramento. O seu médico fará um exame de sangue para comprovar se desenvolveu inibidores (anticorpos neutralizantes) face a Refixia. O risco de desenvolver inibidores é maior nas pessoas a quem não foi administrado anteriormente medicamentos com factor IX, geralmente em crianças pequenas.
Coágulos de sangue
Informa o seu médico se ocorrer alguma das seguintes circunstâncias, porque o risco de formação de coágulos de sangue aumenta durante o tratamento com Refixia:
- foi submetido a uma intervenção cirúrgica recentemente
- tem alguma outra doença grave, como doença hepática, doença cardíaca ou cancro
- apresenta factores de risco de desenvolver uma doença cardíaca, como tensão arterial alta, obesidade ou tabagismo.
Doença renal (síndroma nefrótico)
Existe um risco mínimo de desenvolver uma doença renal específica chamada "síndroma nefrótico" após a administração de doses elevadas de factor IX em doentes com hemofilia B e inibidores do factor IX, bem como com antecedentes de reacções alérgicas.
Complicações relacionadas com o catéter
Se tiver um dispositivo de acesso venoso central (DAVC), poderá desenvolver infecções ou coágulos de sangue no local de inserção do catéter.
Outros medicamentos e Refixia
Informa o seu médico se está a utilizar, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento.
Gravidez e amamentação
Se estiver grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar Refixia.
Condução e uso de máquinas
A influência de Refixia sobre a capacidade para conduzir e utilizar máquinas é nula.
Refixia contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por frasco; isto é, é essencialmente "isento de sódio". Em caso de tratamento com vários frascos, deve ser considerado o conteúdo total de sódio.
3. Como usar Refixia
Um médico com experiência no tratamento de doentes com hemofilia B iniciará o tratamento com Refixia. Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico sobre como utilizar Refixia.
O seu médico calculará a sua dose adequada com base no seu peso e para que é utilizado o medicamento.
Prevenção do sangramento
A dose normal de Refixia é de 40 unidades internacionais (UI) por kg de peso corporal. É administrada por injeção uma vez por semana. O seu médico pode escolher outra dose ou alterar a frequência com que deve ser administrada a injeção, de acordo com as suas necessidades.
Tratamento do sangramento
A dose normal de Refixia é de 40 unidades internacionais (UI) por kg de peso corporal. É possível que, dependendo da localização e gravidade do sangramento, precise de uma dose maior (80 UI por kg) ou injeções adicionais. Consulte com o seu médico a dose e o número de injeções que precisa.
Uso em crianças e adolescentes
Refixia pode ser utilizado em crianças e adolescentes de todas as idades. A dose em crianças e adolescentes também é calculada com base no peso corporal e é a mesma dose que para os adultos.
Como é administrado Refixia
Refixia está disponível em pó e dissolvente para preparar uma solução (reconstituição) e deve ser injetado num vaso. Ver "Instruções para utilizar Refixia" para obter mais informações.
Se usar mais Refixia do que deve
Se usar mais Refixia do que deve, contacte o seu médico.
Se precisar aumentar significativamente a quantidade de Refixia que precisa para parar um sangramento, informe o seu médico imediatamente. Para mais informações, ver secção 2 "Reacções alérgicas e desenvolvimento de inibidores".
Se esquecer de usar Refixia
Se esquecer de uma dose, injete a dose omitida assim que se lembrar. Não administre uma dose dupla para compensar a dose esquecida. Se tiver alguma dúvida, contacte o seu médico.
Se interromper o tratamento com Refixia
Se interromper o tratamento com Refixia, deixará de estar protegido contra o sangramento ou é possível que um sangramento já existente não pare. Não interrompa o tratamento com Refixia sem falar antes com o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode causar efeitos adversos, embora nem todas as pessoas os experimentem.
É possível que ocorram reacções alérgicas com este medicamento.
Se ocorrerem reacções alérgicas repentinas e graves (p. ex., reacções anafilácticas), é necessário parar a injeção imediatamente. Se apresentar algum dos seguintes sintomas precoces de uma reacção alérgica grave (reacção anafiláctica), contacte o seu médico ou o serviço de urgência imediatamente:
- dificuldade para engolir ou respirar
- falta de ar ou sibilância
- opressão no peito
- enrubescimento e/ou inchação dos lábios, da língua, da face ou das mãos
- erupções, habões, ronchas ou picazón
- pele pálida e fria, palpitações e/ou tontura (pressão sanguínea baixa).
Para crianças não tratadas previamente com medicamentos de factor IX, a geração de inibidores (ver secção 2) é frequente (até 1 em cada 10 doentes). Se isso ocorrer, a medicação pode deixar de funcionar adequadamente e o seu filho pode experimentar um sangramento persistente. Se isso ocorrer, deve contactar o seu médico imediatamente.
Foram observados os seguintes efeitos adversos com Refixia:
Efeitos adversos frequentes(podem afetar até 1 em cada 10 pessoas)
- reacções alérgicas (hipersensibilidade). Isto pode ser grave e pode colocar a sua vida em perigo (reacções anafilácticas)
- picazón (prurido)
- reacções cutâneas no local de injeção
- náuseas
- sentir-se muito cansado
- sarpilho
- crianças não tratadas previamente com medicamentos de factor IX: anticorpos neutralizantes (inibidores), reacções anafilácticas.
Efeitos adversos pouco frequentes(podem afetar até 1 em cada 100 pessoas)
- palpitações
- sofocos.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Refixia
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize Refixia após a data de validade que aparece no envase e nas etiquetas do frasco e da seringa pré-carregada após "CAD". A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2 °C e 8 °C). Não congelar. Conservar o frasco no embalagem exterior para protegê-lo da luz.
Refixia pode estar fora do frigorífico durante um período máximo de 1 ano e conservar-se a temperatura ambiente (até 30 °C). Anote no envase a data em que removeu Refixia do frigorífico e o colocou a temperatura ambiente. A nova data de validade nunca deve ser posterior à que aparece no cartucho. Jogue fora este medicamento se não o tiver utilizado antes da nova data de validade. Após conservar o medicamento a temperatura ambiente, não o volte a colocar no frigorífico.
Utilize a injeção imediatamente após preparar a solução (reconstituição). Se não puder utilizá-la imediatamente, deve utilizá-la num prazo de 24 horas se a conservar no frigorífico entre 2 °C e 8 °C ou num prazo de 4 horas se a conservar fora do frigorífico a uma temperatura máxima de 30 °C.
O pó do frasco é um pó branco a esbranquiçado. Se a cor do pó tiver mudado, não o utilize.
A solução reconstituída é transparente e incolora a ligeiramente amarela. Não utilize a solução reconstituída se observar que contém partículas ou decoloração.
Os medicamentos não devem ser jogados fora por meio dos esgotos nem colocados no lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Refixia
- O princípio ativo é nonacog beta pegol (fator IX de coagulação humano [ADNr] peguilado). Cada frasco de Refixia contém 500 UI, 1 000 UI, 2 000 UI ou 3 000 UI de nonacog beta pegol, que correspondem a aproximadamente 125 UI/ml, 250 UI/ml, 500 UI/ml ou 750 UI/ml, respectivamente, após a reconstituição com o diluente de histidina.
- Os outros componentes do pó são cloreto de sódio, histidina, sacarose, polissorbato 80, manitol, hidróxido de sódio e ácido clorídrico. Ver seção 2 “Refixia contém sódio”.
- Os componentes do diluente esterilizado são histidina, água para preparações injetáveis, hidróxido de sódio e ácido clorídrico.
Aspecto de Refixia e conteúdo do envase
- Refixia é fornecida como pó e diluente para solução injetável (500 UI, 1 000 UI, 2 000 UI ou 3 000 UI de pó em um frasco e 4 ml de diluente em uma seringa pré-carregada, uma vara do êmbolo com um adaptador de frasco; tamanho de envase de 1).
- O pó é branco a esbranquiçado e o diluente é transparente e incolor.
Título da autorização de comercialização e responsável pela fabricação
Novo Nordisk A/S
Novo Allé
DK-2880 Bagsværd, Dinamarca
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
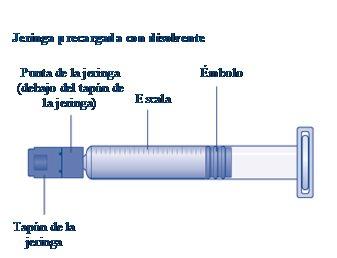
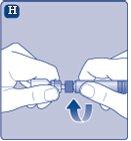
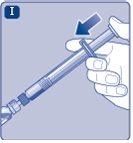
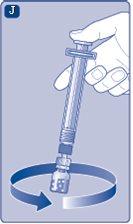
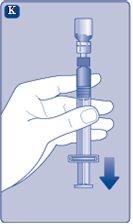
Instruções para utilizarRefixia Leia atentamente estas instruções antes de usar Refixia. Refixia é fornecida na forma de pó. Antes da injeção, deve ser preparada uma solução (reconstituída) com o diluente fornecido na seringa. O diluente é uma solução de histidina. A solução reconstituída deve ser injetada em uma veia (injeção intravenosa [IV]). Os elementos deste envase são projetados para reconstituir e injetar Refixia. Também precisará de um equipamento de infusão intravenosa (tubos e agulha borboleta), toalhetes estéreis com álcool, gazes e ataduras. Esses materiais não estão incluídos no envase de Refixia. Não use o equipamento sem ter recebido a formação adequada de seu médico ou enfermeiro. Lave sempre as mãos e certifique-se de que a área ao seu redor esteja limpa. Ao preparar e injetar o medicamento diretamente nas veias, é importante usar uma técnica limpa e sem germes (asséptica).Uma técnica incorreta pode introduzir germes capazes de infectar o sangue. Não abra o equipamento até que esteja pronto para usá-lo. Não use o equipamento se ele tiver caído ou estiver danificado.Use um envase novo em seu lugar. Não use o equipamento se ele tiver expirado.Use um envase novo em seu lugar. A data de expiração está impressa no embalagem exterior, no frasco, no adaptador do frasco e na seringa pré-carregada. Não use o equipamento se suspeitar que ele esteja contaminado.Use um envase novo em seu lugar. Não descarte nenhum elemento até que a solução reconstituída tenha sido injetada. O equipamento é de uso único. | |
Conteúdo O envase contém:
| |
| |
|
|
|
|
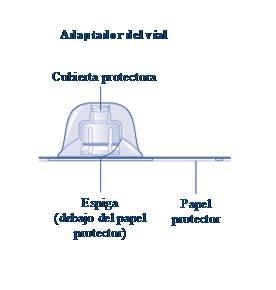
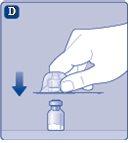
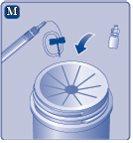
Se o papel protetor não estiver totalmente selado ou se estiver rompido, não use o adaptador do frasco. Não retire o adaptador do frasco da cobertura protetora com os dedos.Se tocar a espiga do adaptador do frasco, pode transferir germes dos seus dedos. |
|
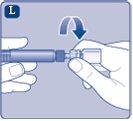
Uma vez unido, não retire do frasco o adaptador do frasco. |
|
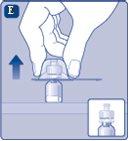
Retire a cobertura protetorado adaptador do frasco. Não retire o adaptador do frasco do frascoao retirar a cobertura protetora. |
|
|
|
Se otampãoda seringa estiver solto ou faltar, não use a seringa pré-carregada. |
|
|
|
|
|
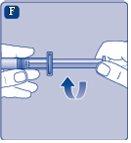
Não agite o frasco, pois isso produziria espuma.
|
|
Recomenda-se usar Refixia imediatamente após a reconstituição,pois, se for deixado, o medicamento pode deixar de ser estéril e poderia causar infecções. Se não puder usar a solução de Refixia reconstituída imediatamente, deve usá-la em um prazo de 4 horas se estiver conservada à temperatura ambiente (até 30 °C) e em um prazo de 24 horas se estiver conservada na geladeira (entre 2 °C e 8 °C). Conservar o produto reconstituído no frasco. Não congele a solução de Refixia reconstituída nem a guarde em seringas. Guarde a solução de Refixia reconstituída longe da luz direta. Se a sua dose requer mais de um frasco, repita os passos Aa Jcom mais frascos, adaptadores de frasco e seringas pré-carregadas até atingir a dose necessária. | |
Se em algum momento houver ar na seringa, injete o ar de volta no frasco.
|
|
|
|
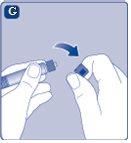
Agora Refixia está pronto para ser injetado em uma veia.
Injeção de Refixia através de conectores sem agulha para catéteres intravenosos (IV) Precaução:a seringa pré-carregada é de vidro e é projetada para ser compatível com conexões luer-lock padrão. Alguns conectores sem agulha que apresentam uma espiga interna são incompatíveis com a seringa pré-carregada. Essa incompatibilidade pode impedir a administração do medicamento e/ou causar danos ao conector sem agulha. Injeção da solução através de um dispositivo de acesso venoso central (DAVC) como um catéter venoso central ou um porto subcutâneo:
| |
Eliminação
Não o jogue na lixeira doméstica. |
|
Não desmonte o equipamento antes de eliminá-lo. Não reutilize o equipamento. |
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a REFIXIA 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médicaForma farmacêutica: INJETÁVEL, 2.000 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médicaForma farmacêutica: INJETÁVEL, 250 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médica
Alternativas a REFIXIA 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a REFIXIA 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Polónia
Alternativa a REFIXIA 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para REFIXIA 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de REFIXIA 2000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.