QDENGA pó e solvente para solução injetável em seringa pré-carregada

Pergunte a um médico sobre a prescrição de QDENGA pó e solvente para solução injetável em seringa pré-carregada

Como usar QDENGA pó e solvente para solução injetável em seringa pré-carregada
Introdução
Prospecto: informação para o utilizador
Qdenga pó e dissolvente para solução injetável em seringa pré-carregada
Vacina tetravalente contra a dengue (viva, atenuada)
Este medicamento está sujeito a monitorização adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da secção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de si ou seu filho serem vacinados, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si ou para seu filho, e não deve ser dado a outras pessoas.
- Se si ou seu filho experimentarem efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Qdenga e para que é utilizado
- O que precisa saber antes de si ou seu filho receberem Qdenga
- Como é administrado Qdenga
- Efeitos adversos possíveis
- Conservação de Qdenga
- Conteúdo do envase e informação adicional
1. O que é Qdenga e para que é utilizado
Qdenga é uma vacina. É utilizado para ajudar a proteger si ou seu filho contra a dengue. A dengue é uma doença causada pelos sorotipos 1, 2, 3 e 4 do vírus da dengue. Qdenga contém versões debilitadas desses 4 sorotipos do vírus da dengue, por isso não pode causar a doença.
Qdenga é administrado a adultos, jovens e crianças (a partir dos 4 anos de idade).
Qdenga deve ser utilizado de acordo com as recomendações oficiais.
Como funciona a vacina
Qdenga estimula as defesas naturais do corpo (sistema imunológico). Isso ajuda a proteger contra os vírus que causam a dengue se o corpo, no futuro, for exposto a esses vírus.
O que é a dengue
A dengue é causada por um vírus.
- O vírus é transmitido através de mosquitos (mosquitos Aedes).
- Se um mosquito pica uma pessoa com dengue, pode transmitir o vírus para as próximas pessoas que pique.
A dengue não é transmitida diretamente de pessoa para pessoa.
Os sinais de dengue incluem febre, dor de cabeça, dor na parte posterior dos olhos, dor muscular e articular, sensibilidade ou mal-estar (náuseas e vômitos), inflamação dos gânglios ou erupção cutânea. Os sinais de dengue geralmente duram de 2 a 7 dias. Também pode estar infectado com o vírus da dengue, mas não mostrar sinais de doença.
Às vezes, a dengue pode ser grave o suficiente para que si ou seu filho precisem ir ao hospital e, em casos raros, pode causar a morte. A dengue grave pode causar febre alta e qualquer um dos seguintes sintomas: dor abdominal (barriga) intensa, náuseas persistentes (vômitos), respiração acelerada, hemorragia grave, sangramento no estômago, sangramento das gengivas, sensação de cansaço, inquietude, coma, ataques (convulsões) e disfunção orgânica.
2. O que precisa saber antes de si ou seu filho receberem Qdenga
Para garantir que Qdenga é adequado para si ou para seu filho, é importante que informe o seu médico, farmacêutico ou enfermeiro se algum dos seguintes pontos se aplicar a si ou a seu filho. Se houver algo que não entenda, peça ao seu médico, farmacêutico ou enfermeiro que o explique.
Não utilize Qdenga se si ou seu filho
- são alérgicos aos princípios ativos ou a algum dos outros componentes de Qdenga (incluídos na secção 6).
- tiveram uma reação alérgica após receber Qdenga anteriormente. Os sinais de uma reação alérgica podem incluir uma erupção que coça, dificuldade para respirar e inflamação do rosto e da língua.
- têm um sistema imunológico debilitado (as defesas naturais do organismo). Isso pode ser devido a um defeito genético ou a uma infecção por VIH.
- estão tomando um medicamento que afeta o sistema imunológico (como doses altas de corticosteroides ou quimioterapia). O seu médico não utilizará Qdenga até 4 semanas após si parar o tratamento com este medicamento.
- está grávida ou em período de amamentação.
Não utilize Qdenga se ocorrer algum dos casos acima.
Advertências e precauções
- Informe o seu médico, farmacêutico ou enfermeiro antes de receber Qdenga se si ou seu filho:
- apresentam uma infecção com febre. Pode ser necessário adiar a vacinação até a recuperação.
- alguma vez tiveram problemas de saúde quando lhes foi administrada uma vacina. O seu médico considerará minuciosamente os riscos e benefícios da vacinação.
- alguma vez se desmaiaram por uma injeção. Pode ocorrer tontura, desmaio e, por vezes, queda (sobretudo em pessoas jovens) após ou mesmo antes de qualquer injeção com agulha.
Informação importante sobre a proteção proporcionada
Como com qualquer vacina, Qdenga pode não proteger todos os que a recebam, e a proteção pode diminuir com o tempo. Ainda pode contrair a dengue por picadas de mosquito, incluindo a doença grave da dengue. Deve continuar a proteger-se a si mesmo ou a seu filho contra picadas de mosquitos mesmo após a vacinação com Qdenga.
Após a vacinação, deve consultar um médico se si ou seu filho acreditam que podem ter uma infecção por dengue e apresentam algum dos seguintes sintomas: febre alta, dor abdominal (barriga) intensa, vômitos persistentes, respiração rápida, gengivas sangrantes, cansaço, inquietude e sangue no vômito.
Outras medidas de proteção
Deve tomar precauções para evitar picadas de mosquito. Isso inclui o uso de repelentes de insetos, roupas protetoras e mosquiteiros.
Crianças pequenas
Crianças menores de 4 anos de idade não devem receber Qdenga.
Outros medicamentos e Qdenga
Qdenga pode ser administrado junto com a vacina contra a hepatite A, a vacina contra a febre amarela ou a vacina contra o vírus do papiloma humano em outro local de injeção (outra parte do corpo, normalmente o outro braço) durante a mesma visita.
Informe o seu médico ou farmacêutico se si ou seu filho estão utilizando, utilizaram recentemente ou possam ter que utilizar qualquer outro medicamento ou vacina.
Em particular, informe o seu médico ou farmacêutico se si ou seu filho estão tomando alguma das seguintes substâncias:
- Medicamentos que afetam as defesas naturais do corpo (sistema imunológico) como doses altas de corticosteroides ou quimioterapia. Nesse caso, o seu médico não utilizará Qdenga até 4 semanas após si parar o tratamento. Isso ocorre porque Qdenga pode não funcionar tão bem.
- Medicamentos denominados “imunoglobulinas” ou hemoderivados que contêm imunoglobulinas, como sangue ou plasma. Nesse caso, o seu médico não utilizará Qdenga até 6 semanas após si parar o tratamento e, preferencialmente, até 3 meses após si parar o tratamento. Isso ocorre porque Qdenga pode não funcionar tão bem.
Gravidez e amamentação
Não utilize Qdenga se si ou sua filha estão grávidas ou em período de amamentação. Se si ou sua filha:
- estão em idade fértil, devem tomar as precauções necessárias para evitar a gravidez durante um mês após a vacinação com Qdenga.
- acreditam que possam estar grávidas ou estão planejando ter um bebê, perguntem ao seu médico, farmacêutico ou enfermeiro antes de utilizar Qdenga.
Condução e uso de máquinas
Qdenga tem uma influência pequena sobre a capacidade de conduzir e utilizar máquinas nos primeiros dias após a vacinação.
Qdenga contém sódio e potássio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose de 0,5 ml; isto é, é essencialmente “isento de sódio”.
Este medicamento contém menos de 1 mmol (39 mg) de potássio por dose de 0,5 ml; isto é, é essencialmente “isento de potássio”.
3. Como é administrado Qdenga
Qdenga é administrado pelo médico ou enfermeiro como uma injeção sob a pele (injeção subcutânea) na parte superior do braço. Não deve ser injetado em um vaso sanguíneo.
Si ou seu filho receberão 2 injeções.
A segunda injeção é administrada 3 meses após a primeira.
Não existem dados de adultos maiores de 60 anos de idade. Consulte o seu médico para saber se Qdenga é benéfico para si.
Qdenga deve ser utilizado de acordo com as recomendações oficiais.
As instruções para a preparação da vacina para médicos e profissionais de saúde figuram no final do prospecto.
Se si ou seu filho saltarem uma injeção de Qdenga
- Se si ou seu filho saltarem uma injeção programada, o médico decidirá quando administrar a injeção que falta. É importante que si ou seu filho sigam as instruções do médico, farmacêutico ou enfermeiro sobre a injeção de acompanhamento.
- Se esquecer ou não puder voltar na hora programada, pergunte ao seu médico, farmacêutico ou enfermeiro para que o aconselhe.
Se tiver alguma outra dúvida sobre o uso desta vacina, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Efeitos adversos possíveis
Como com todos os medicamentos, Qdenga pode causar efeitos adversos, embora nem todas as pessoas os sofram.
Reação alérgica(anafilática)grave
Se ocorrer algum desses sintomas após abandonar o local em que si ou seu filho receberam uma injeção, entre em contato com um médico imediatamente:
- dificuldade para respirar
- língua ou lábios azuis
- erupção
- inchaço do rosto ou da garganta
- pressão arterial baixa que causa tontura ou desfalecimento
- sensação repentina e grave de mal-estar ou inquietude, acompanhada de uma queda de tensão que causa tontura e perda de consciência, além de batimentos cardíacos acelerados associados à dificuldade para respirar
Esses sinais ou sintomas (reações anafiláticas) geralmente aparecem pouco após a administração da injeção e enquanto si ou seu filho ainda estão no centro ou na consulta do médico. Também podem ocorrer muito raramente após receber qualquer vacina.
Os seguintes efeitos adversos ocorreram durante os estudos em crianças, jovens e adultos.
Muito frequentes(podem afetar mais de 1 pessoa em cada 10):
- dor no local da injeção
- dor de cabeça
- dor muscular
- vermelhidão no local da injeção
- sensação de mal-estar geral
- fraqueza
- infecções do nariz ou da garganta
- febre
Frequentes(podem afetar até 1 em cada 10 pessoas):
- inchaço no local da injeção
- dor ou inchaço do nariz ou da garganta
- hematomas no local da injeção
- coceira no local da injeção
- inchaço da garganta e das amígdalas
- dor articular
- doença tipo gripe
Pouco frequentes(podem afetar até 1 em cada 100 pessoas):
- diarreia
- náuseas
- dor de estômago
- vômitos
- sangramento no local da injeção
- sensação de tontura
- coceira na pele
- erupção cutânea, incluindo erupções na pele com manchas ou coceira na pele
- urticárias
- fraqueza
- mudança da cor da pele no local da injeção
- inchaço das vias respiratórias
- corrimento nasal
Muito raros(podem afetar até 1 em cada 10.000 pessoas):
- inchaço rápido abaixo da pele em áreas como o rosto, a garganta, os braços e as pernas
Frequência não conhecida(não pode ser estimada a partir dos dados disponíveis):
- reação alérgica (anafilática) repentina e grave, com dificuldade para respirar, inchaço, desfalecimento, batimentos cardíacos acelerados, suor e perda de consciência
Outros efeitos adversos em crianças de 4 a 5 anos de idade:
Muito frequentes(podem afetar mais de 1 pessoa em cada 10):
- diminuição do apetite
- sensação de sono
- irritabilidade
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Ao comunicar efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Qdenga
Mantenha Qdenga fora da vista e do alcance das crianças.
Não utilize Qdenga após a data de validade que aparece na caixa após CAD. A data de validade é o último dia do mês que é indicado.
Conservar em refrigerador (entre 2 ºC e 8 ºC).
Não congelar.
Conservar a vacina no embalagem exterior.
Após a mistura (reconstituição) com o dissolvente fornecido, Qdenga deve ser utilizado imediatamente. Se não for utilizado imediatamente, Qdenga deve ser utilizado em um prazo de 2 horas.
Os medicamentos não devem ser jogados nos esgotos ou na lixeira. Pergunte ao seu farmacêutico como se livrar dos embalagens e dos medicamentos que já não precisa. Dessa forma, você ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
O que contém Qdenga
- Após a reconstituição, uma dose (0,5 ml) contém:
Vírus do dengue sorotipo 1 (vivo, atenuado)*: ≥ 3,3 log10 UFP**/dose
Vírus do dengue sorotipo 2 (vivo, atenuado)#: ≥ 2,7 log10 UFP**/dose
Vírus do dengue sorotipo 3 (vivo, atenuado)*: ≥ 4,0 log10 UFP**/dose
Vírus do dengue sorotipo 4 (vivo, atenuado)*: ≥ 4,5 log10 UFP**/dose
- Produzido em células Vero por tecnologia de ADN recombinante. Genes das proteínas de superfície específicas de cada sorotipo, inseridos no esqueleto do dengue tipo 2. Este produto contém organismos modificados geneticamente (OMG).
# Produzido em células Vero por tecnologia de ADN recombinante.
** UFP = unidades formadoras de placas
- Os demais ingredientes são: a,a-trealose diidratado, poloxâmero 407, albumina de soro humano, diidrogenofosfato de potássio, diidrogenofosfato de sódio, cloreto potássico, cloreto de sódio, água para preparações injetáveis.
Aspecto de Qdenga e conteúdo do envase
Qdenga é um pó e diluente para solução injetável. Qdenga é fornecido como pó em um frasco de dose única e um diluente em uma seringa pré-carregada com 2 agulhas aparte ou sem agulha.
O pó e o diluente devem ser misturados antes do uso.
Qdenga em pó e diluente para solução injetável em seringa pré-carregada está disponível em envases de 1 ou 5.
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
O pó é compacto para suspensão de cor branca a esbranquiçada.
O diluente (0,22 % de solução de cloreto de sódio) é um líquido incolor e transparente.
Após a reconstituição, Qdenga é uma solução transparente, de incolora a amarela pálida, essencialmente sem partículas estranhas.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
Takeda GmbH
Byk-Gulden-Str. 2
78467 Konstanz
Alemanha
Responsável pela fabricação
Takeda GmbH
Local de produção Singen
Robert-Bosch-Str. 8
78224 Singen
Alemanha
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica Takeda Bélgica NV Tel: +32 2 464 06 11 | Lituânia Takeda, UAB Tel: +370 521 09 070 |
| Luxemburgo Takeda Bélgica NV Tel: +32 2 464 06 11 |
República Tcheca Takeda Pharmaceuticals República Tcheca s.r.o. Tel: +420 234 722 722 | Hungria Takeda Pharma Kft. Tel: +36 1 270 7030 |
Dinamarca Takeda Pharma A/S Tlf.: +45 46 77 10 10 | Malta Takeda HELLAS S.A. Tel: +30 210 6387800 |
Alemanha Takeda GmbH Tel: +49 (0) 800 825 3325 | Países Baixos Takeda Países Baixos B.V. Tel: +31 20 203 5492 |
Estônia Takeda Pharma AS Tel: +372 6177 669 | Noruega Takeda AS Tlf: 800 800 30 |
Grécia Takeda ΕΛΛΑΣ Α.Ε. Τηλ: +30 210 6387800 | Áustria Takeda Pharma Ges.m.b.H. Tel: +43 (0) 800-20 80 50 |
Espanha Takeda Farmacêutica Espanha S.A. Tel: +34 917 90 42 22 | Polônia Takeda Pharma sp. z o.o. Tel: +48 22 306 24 47 |
França Takeda França SAS Tél: +33 1 40 67 33 00 | Portugal Takeda Farmacêuticos Portugal, Lda. Tel: +351 21 120 1457 |
Croácia Takeda Pharmaceuticals Croácia d.o.o. Tel: +385 1 377 88 96 | Irlanda Takeda Products Irlanda Ltd. Tel: 1800 937 970 |
Romênia Takeda Pharmaceuticals SRL Tel: +40 21 335 03 91 | Eslovênia Takeda Pharmaceuticals farmacêutica družba d.o.o. Tel: +386 (0) 59 082 480 |
Islândia Vistor hf. Sími: +354 535 7000 | Eslováquia Takeda Pharmaceuticals Eslováquia s.r.o. Tel: +421 (2) 20 602 600 |
Itália Takeda Itália S.p.A. Tel: +39 06 502601 | Finlândia Takeda Oy Puh/Tel: 0800 774 051 |
Chipre Takeda ΕΛΛΑΣ Α.Ε. Τηλ: +30 2106387800 | Suécia Takeda Pharma AB Tel: 020 795 079 |
Letônia Takeda Letônia SIA Tel: +371 67840082 | Reino Unido (Irlanda do Norte) Takeda Reino Unido Ltd Tel: +44 (0) 3333 000 181 |
Data da última revisão deste prospecto: Outubro 2024.
Outras fontes de informação
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
Esta informação está destinada apenas a profissionais de saúde:
- Qdenga não deve ser misturado com outros medicamentos ou vacinas na mesma seringa.
- Qdenga não deve ser administrado como injeção por via intravascular sob nenhuma circunstância.
- A vacinação deve ser realizada por injeção subcutânea, preferencialmente na parte superior do braço, no deltóide. Qdenga não deve ser administrado como injeção intramuscular.
- Pode ocorrer síncope (desmaio) após, ou mesmo antes, de qualquer vacinação como resposta psicogênica à injeção com agulha. Devem ser estabelecidos procedimentos para evitar lesões por quedas e gerenciar as reações sincopais.
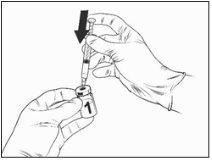
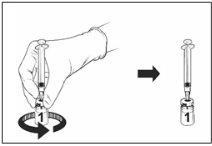
Instruções para a reconstituição da vacina com o diluente apresentado na seringa pré-carregada:
Qdenga é uma vacina de 2 componentes que consiste em um frasco que contém a vacina liofilizada e diluente fornecido na seringa pré-carregada. A vacina liofilizada deve ser reconstituída com o diluente antes da administração.
Qdenga não deve ser misturado com outras vacinas na mesma seringa.
Para reconstituir Qdenga, use apenas o diluente (solução de cloreto de sódio a 0,22 %) na seringa pré-carregada fornecida com a vacina, pois não contém conservantes nem outras substâncias antivíricas. Deve-se evitar o contato com conservantes, antisépticos, detergentes e outras substâncias antivíricas, pois podem inativar a vacina.
Retire o frasco da vacina e o diluente da seringa pré-carregada da geladeira e coloque-os a temperatura ambiente durante aproximadamente 15 minutos.
Frasco de vacina liofilizada |
|
Vacina reconstituída |
|
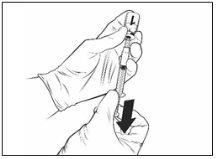
Após a reconstituição, a solução resultante deve ser transparente, entre incolora e amarela pálida, e basicamente sem partículas estranhas. Descarte a vacina se forem apreciadas nela partículas ou mudanças de cor.
Vacina reconstituída |
|
Qdenga deve ser administrado imediatamente após a reconstituição. Foi demonstrada sua estabilidade físico-química durante o uso por um período de 2 horas a temperatura ambiente (até 32,5 ºC) desde o momento da reconstituição do frasco da vacina. Uma vez transcorrido este período, a vacina deve ser descartada. Não a devolva à geladeira. Do ponto de vista microbiológico, Qdenga deve ser usada imediatamente. Se não for usada imediatamente, os tempos e condições de conservação serão responsabilidade do usuário.
A eliminação do medicamento não utilizado e de todos os materiais descartáveis será realizada de acordo com a normativa local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a QDENGA pó e solvente para solução injetável em seringa pré-carregadaForma farmacêutica: INJETÁVEL, 60 microgramas/dose + 60 microgramas/doseSubstância ativa: respiratory syncytial virus vaccinesFabricante: Pfizer Europe Ma EeigRequer receita médicaForma farmacêutica: INJETÁVEL, 0,5 mLSubstância ativa: respiratory syncytial virus vaccinesFabricante: Glaxosmithkline BiologicalsRequer receita médicaForma farmacêutica: INJETÁVEL, 50 µgSubstância ativa: respiratory syncytial virus vaccinesFabricante: Moderna Biotech Spain S.L.Requer receita médica
Médicos online para QDENGA pó e solvente para solução injetável em seringa pré-carregada
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de QDENGA pó e solvente para solução injetável em seringa pré-carregada – sujeita a avaliação médica e regras locais.