ABRYSVO pó e solvente para solução injetável

Pergunte a um médico sobre a prescrição de ABRYSVO pó e solvente para solução injetável

Como usar ABRYSVO pó e solvente para solução injetável
Introdução
Prospecto: informação para o utilizador
Abrysvo pó e dissolvente para solução injectável
vacina contra o vírus respiratório sincicial (bivalente, recombinante)
Este medicamento está sujeito a monitorização adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da secção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de começar a receber esta vacina, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que o reler.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Abrysvo e para que é utilizado
- O que precisa saber antes de receber Abrysvo
- Como é administrado Abrysvo
- Possíveis efeitos adversos
- Conservação de Abrysvo
- Conteúdo do envase e informação adicional
1. O que é Abrysvo e para que é utilizado
Abrysvo é uma vacina para prevenir a doença pulmonar (das vias respiratórias) causada por um vírus chamado vírus respiratório sincicial (VRS). Abrysvo é administrado a:
- mulheres grávidas para proteger os seus bebés desde o nascimento até aos 6 meses de idade,
ou
- pessoas com 18 anos de idade ou mais.
O VRS é um vírus comum que, na maioria dos casos, causa sintomas leves semelhantes aos de um resfriado, como dor de garganta, tos ou congestão nasal. No entanto, nos lactentes pequenos, o VRS pode causar problemas pulmonares graves. Em adultos de idade avançada e em pessoas com patologias crónicas, o VRS pode agravar doenças como a doença pulmonar obstructiva crónica (DPOC) e a insuficiência cardíaca congestiva (ICC). O VRS pode dar origem a hospitalização em casos graves e, em algumas circunstâncias, pode ser mortal.
Como funciona Abrysvo
Esta vacina ajuda o sistema imunológico (as defesas naturais do organismo) a produzir anticorpos (substanças no sangue que ajudam o corpo a combater infecções) que protegem contra a doença pulmonar causada pelo VRS. Nas mulheres grávidas vacinadas entre as semanas 24 e 36 de gravidez, estes anticorpos passam para o bebé através da placenta antes do nascimento, o que protege os bebés quando correm maior risco de contrair o VRS.
2. O que precisa saber antes de começar a receber Abrysvo
Abrysvo não deve ser administrado
- se é alérgico aos princípios ativos ou a algum dos outros componentes desta vacina (incluídos na secção 6).
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de que lhe administrem esta vacina
- Se alguma vez sofreu uma reação alérgica grave ou problemas respiratórios após ter recebido alguma outra vacina ou após ter recebido Abrysvo no passado.
- Se se sente nervoso por receber a vacina ou alguma vez se desmaiou após uma injeção. O desmaio pode ocorrer antes ou após qualquer injeção.
- Se sofre uma infecção com febre alta. Se for o caso, a vacinação será adiada. Não há necessidade de retardar a vacinação por uma infecção leve, como um resfriado, mas consulte primeiro com o seu médico.
- Se sofre um problema de sangramento ou lhe saem hematomas com facilidade.
- Se tem um sistema imunológico debilitado que pode impedir que obtenha todos os benefícios de Abrysvo.
- Se tem menos de 24 semanas de gravidez.
Se se cumprir alguma das situações mencionadas anteriormente (ou não estiver seguro), consulte com o seu médico, farmacêutico ou enfermeiro antes de que lhe administrem Abrysvo.
Assim como com qualquer vacina, é possível que Abrysvo não proteja completamente todos os que a recebem.
Crianças e adolescentes
Abrysvo não é recomendado em crianças e jovens com menos de 18 anos de idade, excepto durante a gravidez (ver mais adiante a secção “Gravidez”).
Outros medicamentos e Abrysvo
Informa o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento ou recebeu recentemente alguma outra vacina.
Abrysvo pode ser administrado ao mesmo tempo que a vacina contra a gripe ou a COVID-19. Recomenda-se um intervalo de pelo menos duas semanas entre a administração de Abrysvo e a vacina contra o tétano, difteria e tosferina acelular.
Gravidez e amamentação
As mulheres grávidas podem receber esta vacina no final do segundo ou terceiro trimestre (semanas 24 a 36). Se estiver em período de amamentação, consulte o seu médico ou enfermeiro antes de receber esta vacina.
Condução e uso de máquinas
É pouco provável que Abrysvo afete a sua capacidade para conduzir ou utilizar máquinas.
Abrysvo contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose; isto é, é essencialmente “isento de sódio”.
Abrysvo contém polissorbato 80
Uma dose de Abrysvo contém 0,08 mg de polissorbato 80. Os polissorbatos podem causar reações alérgicas. Informe o seu médico se tiver alguma alergia conhecida.
3. Como é administrado Abrysvo
Ser-lhe-á administrada uma injeção de 0,5 ml num músculo da parte superior do braço.
Se tiver alguma dúvida sobre o uso de Abrysvo, consulte o seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Assim como com todas as vacinas, esta vacina pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Efeitos adversos graves
Muito raros(podem afetar até 1 de cada 10 000 pessoas)
- reações alérgicas graves: os sinais de uma reação alérgica grave incluem inchaço do rosto, lábios, língua ou garganta, dificuldade para respirar ou engolir e tonturas. Ver também a secção 2.
- síndrome de Guillain-Barré (um distúrbio neurológico que geralmente começa com formigueiros e fraqueza nos membros e pode evoluir até a paralisia de parte ou todo o corpo).
Informa o seu médico imediatamente se notar sinais destes efeitos adversos graves.
Foram notificados os seguintes efeitos adversos em mulheres grávidas
Muito frequentes(podem afetar mais de 1 de cada 10 pessoas)
- dor no local da injeção
- dor de cabeça
- dor muscular (mialgia).
Frequentes(podem afetar até 1 de cada 10 pessoas)
- vermelhidão no local da injeção
- inchaço no local da injeção.
Raros(podem afetar até 1 de cada 1 000 pessoas)
- reações alérgicas como erupção ou urticária
- inflamação das glândulas (linfadenopatia).
Não foram notificados efeitos adversos em lactentes nascidos de mães vacinadas.
Foram notificados os seguintes efeitos adversos em pessoas com 18 anos de idade ou mais
Muito frequentes(podem afetar mais de 1 de cada 10 pessoas)
- fadiga (cansancio)
- dor de cabeça
- dor no local da injeção
- dor muscular (mialgia).
Frequentes(podem afetar até 1 de cada 10 pessoas)
- dor articular (artralgia)
- vermelhidão no local da injeção
- inchaço no local da injeção.
Pouco frequentes(podem afetar até 1 de cada 100 pessoas)
- febre (pirexia).
Raros(podem afetar até 1 de cada 1 000 pessoas)
- reações alérgicas como erupção ou urticária
- inflamação das glândulas (linfadenopatia)
- hematomas no local da injeção (hematoma)
- picazão no local da injeção (prurito).
Muito raros(podem afetar até 1 de cada 10 000 pessoas)
- reações alérgicas graves (ver Efeitos adversos graves, acima)
- síndrome de Guillain-Barré (ver Efeitos adversos graves, acima).
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informação sobre a segurança deste medicamento.
5. Conservação de Abrysvo
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no envase e na etiqueta após EXP. A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2 ºC e 8 ºC).
Não congelar. Elimine se o envase se congelou.
Após a reconstituição, Abrysvo deve ser administrado imediatamente ou nas 4 horas seguintes se for conservado entre 15 ºC e 30 ºC. Não congelar.
6. Conteúdo do envase e informação adicional
Composição de Abrysvo
Os princípios ativos são:
Antígeno F estabilizado em pré-fusão do subgrupo A do VRS1,2 60 microgramas
Antígeno F estabilizado em pré-fusão do subgrupo B do VRS1,2 60 microgramas
(antígenos do VRS)
1glicoproteína F estabilizada na conformação de pré-fusão.
2produzido em células de ovário de hamster chinês (OHC) mediante tecnologia de ADN recombinante.
Os demais componentes são:
Pó
- trometamol
- hidrocloruro de trometamol
- sacarose
- manitol (E421)
- polissorbato 80 (E433)
- cloruro de sódio
- ácido clorídrico
Veículo
- água para preparações injetáveis
Aspecto do produto e conteúdo do envase
Abrysvo é fornecido como:
- pó branco em um frasco de vidro
- veículo em uma seringa pré-carregada ou um frasco para dissolver o pó.
Depois de dissolver o pó no veículo, a solução é transparente e incolor.
Abrysvo está disponível em:
- um envase com 1 frasco de pó, 1 seringa pré-carregada de veículo, 1 adaptador do frasco com 1 agulha ou sem agulhas (envase de 1 dose);
- um envase com 5 frascos de pó, 5 seringas pré-carregadas de veículo, 5 adaptadores do frasco com 5 agulhas ou sem agulhas (envase de 5 doses);
- um envase com 10 frascos de pó, 10 seringas pré-carregadas de veículo, 10 adaptadores do frasco com 10 agulhas ou sem agulhas (envase de 10 doses);
- um envase com 5 frascos de pó e 5 frascos de veículo (envase de 5 doses).
- um envase com 10 frascos de pó e 10 frascos de veículo (envase de 10 doses).
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Título da autorização de comercialização
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelas
Bélgica
Responsável pela fabricação
Pfizer Manufacturing Belgium NV
Rijksweg 12
2870 Puurs-Sint-Amands
Bélgica
Pfizer Ireland Pharmaceuticals
Grange Castle Business Park
Clondalkin, Dublin 22
Irlanda
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica/Bélgica/Bélgica Luxemburgo/Luxemburgo Pfizer NV/SA Tel: + 32 (0)2 554 62 11 | Letônia Pfizer Luxembourg SARL filial Letônia Tel.: + 371 670 35 775 |
| Lituânia Pfizer Luxembourg SARL filial Lituânia Tel: +370 5 251 4000 |
República Tcheca Pfizer, spol. s r.o. Tel: +420 283 004 111 | Hungria Pfizer Kft Tel: + 36 1 488 37 00 |
Dinamarca Pfizer ApS Tlf: + 45 44 20 11 00 | Malta Vivian Corporation Ltd. Tel: + 356 21344610 |
Alemanha PFIZER PHARMA GmbH Tel: +49 (0)30 550055-51000 | Países Baixos Pfizer bv Tel: +31 (0)800 63 34 636 |
Estônia Pfizer Luxembourg SARL Estônia filial Tel: +372 666 7500 | Noruega Pfizer AS Tlf: +47 67 52 61 00 |
Grécia Pfizer Ελλάς A.E. Τηλ.: +30 210 6785800 | Áustria Pfizer Corporation Áustria Ges.m.b.H Tel: +43 (0)1 521 15-0 |
Espanha Pfizer, S.L. Téf: +34 91 490 99 00 | Polônia Pfizer Polônia Sp. z o.o. Tel.: +48 22 335 61 00 |
França Pfizer Tél +33 (0)1 58 07 34 40 | Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
Croácia Pfizer Croácia d.o.o. Tel: + 385 1 3908 777 | Romênia Pfizer Romênia S.R.L Tel: +40 (0) 21 207 28 00 |
Irlanda Pfizer Healthcare Irlanda Unlimited Company Tel: +1800 633 363 (toll free) Tel: +44 (0)1304 616161 | Eslovênia Pfizer Luxembourg SARL Pfizer, filial para atividades de consultoria farmacêutica, Ljubljana Tel.: +386 (0)1 52 11 400 |
Islândia Icepharma hf. Simi: + 354 540 8000 | República Eslovaca Pfizer Luxembourg SARL, filial Tel: + 421 2 3355 5500 |
Itália Pfizer S.r.l. Tel: +39 06 33 18 21 | Finlândia Pfizer Oy Puh/Tel: +358 (0)9 430 040 |
Chipre Pfizer Ελλάς Α.Ε. (filial Chipre) Τηλ: +357 22817690 | Suécia Pfizer AB Tel: +46 (0)8 550 520 00 |
Data da última revisão deste prospecto:04/2025.
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu
--------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais de saúde:
Rastreabilidade
Com o objetivo de melhorar a rastreabilidade dos medicamentos biológicos, o nome e o número do lote do medicamento administrado devem estar claramente registrados.
Administração
Abrysvo só pode ser administrado por via intramuscular.
O frasco não aberto é estável durante 5 dias quando armazenado a temperaturas de 8 ºC a 30 ºC. Ao final deste período, Abrysvo deve ser utilizado ou descartado. Esta informação é usada para orientar os profissionais de saúde apenas em caso de desvios temporários de temperatura.
Conservação da vacina reconstituída
Abrysvo deve ser administrado imediatamente após a reconstituição ou nas 4 horas seguintes. Mantenha a vacina reconstituída entre 15 ºC e 30 ºC. Não congele a vacina reconstituída.
Foi demonstrada a estabilidade química e física em uso durante 4 horas entre 15 ºC e 30 ºC. Do ponto de vista microbiológico, a vacina deve ser utilizada imediatamente. Se não for usada imediatamente, os tempos e as condições de conservação antes de sua utilização são responsabilidade do usuário.
Preparação para a administração
Para o uso do frasco de antígenos para Abrysvo (pó), seringa pré-carregada com veículo e adaptador do frasco
O pó deve ser reconstituído apenas com o veículo fornecido na seringa pré-carregada utilizando o adaptador do frasco.
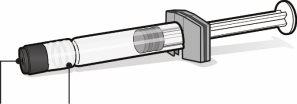
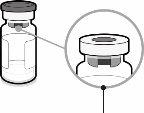
Seringa pré-carregada com veículo para Abrysvo | Frasco com antígenos para Abrysvo (pó) | Adaptador do frasco | |
|
|
| |
Tampa da seringa | Adaptador Luer lock | Tampa do frasco (sem a cápsula de fechamento extraível) |
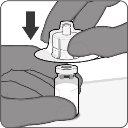
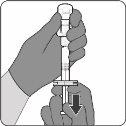
| Passo1. Coloque o adaptador do frasco
|
| Passo2. Reconstitua o componente em pó (antígenos) para formar Abrysvo
|
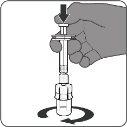
| Passo3. Retire a vacina reconstituída
|
A vacina preparada é uma solução transparente e incolor. Inspeccione visualmente a vacina para detectar partículas grandes e mudanças de cor antes da administração. Não a use se observar partículas grandes ou mudanças de cor.
Para o uso do frasco de antígenos para Abrysvo (pó) e o frasco do veículo
O pó deve ser reconstituído apenas com o frasco do veículo fornecido.
- Utilizando uma agulha e uma seringa esterilizadas, retire todo o conteúdo do frasco com o veículo e injete todo o conteúdo da seringa no frasco com o pó.
- Agite suavemente o frasco com movimentos circulares até que o pó se dissolva completamente. Não agite.
- Retire 0,5 ml do frasco com a vacina reconstituída.
A vacina preparada é uma solução transparente e incolor. Inspeccione visualmente a vacina para detectar partículas grandes e mudanças de cor antes da administração. Não a use se observar partículas grandes ou mudanças de cor.
Eliminação
A eliminação do produto não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a ABRYSVO pó e solvente para solução injetávelForma farmacêutica: INJETÁVEL, 0,5 mLSubstância ativa: respiratory syncytial virus vaccinesFabricante: Glaxosmithkline BiologicalsRequer receita médicaForma farmacêutica: INJETÁVEL, 50 µgSubstância ativa: respiratory syncytial virus vaccinesFabricante: Moderna Biotech Spain S.L.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,5 mlSubstância ativa: ebola vaccinesFabricante: Janssen-Cilag International N.VRequer receita médica
Médicos online para ABRYSVO pó e solvente para solução injetável
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de ABRYSVO pó e solvente para solução injetável – sujeita a avaliação médica e regras locais.