AREXVY pó e suspensão para suspensão injetável

Pergunte a um médico sobre a prescrição de AREXVY pó e suspensão para suspensão injetável

Como usar AREXVY pó e suspensão para suspensão injetável
Introdução
Prospecto: informação para o utilizador
Arexvy pó e suspensão para suspensão injetável
vacina contra o vírus respiratório sincicial (recombinante, adjuvada)
Este medicamento está sujeito a monitorização adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da secção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de começar a receber esta vacina, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Arexvy e para que é utilizado
- O que precisa saber antes de receber Arexvy
- Como é administrado Arexvy
- Possíveis efeitos adversos
- Conservação de Arexvy
- Conteúdo do envase e informação adicional
1. O que é Arexvy e para que é utilizado
Arexvy é uma vacina que ajuda a proteger os adultos a partir dos 60 anos de idade contra um vírus denominado “vírus respiratório sincicial” (VRS).
Arexvy também ajuda a proteger contra o VRS os adultos de 50 a 59 anos de idade com maior risco de contrair a doença por VRS.
O VRS é um vírus respiratório que se propaga muito facilmente.
- O VRS pode produzir doença das vias respiratórias inferiores - infecções nos pulmões e outras partes do corpo que o ajudam a respirar.
A infecção por VRS normalmente produz sintomas leves semelhantes aos de um resfriado em adultos saudáveis. No entanto, também pode:
- produzir doenças respiratórias e complicações mais graves, tais como infecções nos pulmões (pneumonia), em adultos mais velhos e em adultos com doenças subjacentes
- agravar algumas doenças, tais como doenças respiratórias ou cardíacas a longo prazo.
Como funciona Arexvy
Arexvy ajuda às defesas naturais do seu corpo a gerar anticorpos e glóbulos brancos especiais. Estes protegem-no contra o VRS.
Arexvy não contém o vírus. Isto significa que não pode produzir uma infecção.
2. O que precisa saber antes de receber Arexvy
Não use Arexvy
- se é alérgico aos princípios ativos ou a algum dos outros componentes desta vacina (incluídos na secção 6).
Não use Arexvy se lhe aplicar alguma das condições acima. Se não tiver certeza, consulte o seu médico ou farmacêutico.
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a receber Arexvy se:
- teve alguma vez uma reação alérgica grave após a injeção de qualquer outra vacina
- tem uma infecção grave com temperatura alta (febre). Se isto acontecer, pode ser adiada a vacinação até que se sinta melhor. Uma infecção menor, tal como um resfriado, não deve ser um problema, mas consulte primeiro com o seu médico
- tem um problema de sangramento ou apresenta hematomas com facilidade
- desmaiou com uma injeção anterior. O desmaio pode ocorrer antes ou depois de qualquer injeção com agulha.
Se lhe aplicar alguma das condições acima, ou não tiver certeza, consulte o seu médico ou farmacêutico antes de que lhe seja administrado Arexvy.
Como com todas as vacinas, pode ser que Arexvy não proteja por completo todos os vacinados.
Outros medicamentos/vacinas e Arexvy
Informa o seu médico ou farmacêutico se:
- está a tomar, tomou recentemente ou pode ter que tomar qualquer outro medicamento. Isto inclui medicamentos obtidos sem receita
- recebeu recentemente qualquer outra vacina.
Arexvy pode ser administrado ao mesmo tempo que uma vacina contra a gripe.
Se Arexvy for administrado ao mesmo tempo que outra vacina injetável, será utilizado um local de injeção distinto para cada vacina, ou seja, um braço diferente para cada injeção.
Gravidez e amamentação
Se estiver grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de que lhe seja administrada esta vacina.
Não se recomenda Arexvy durante a gravidez ou amamentação.
Condução e uso de máquinas
Alguns dos efeitos mencionados a seguir na secção 4 “Possíveis efeitos adversos” (p. ex., sensação de cansaço) podem afetar temporariamente a capacidade para conduzir ou utilizar máquinas. Não conduza nem utilize máquinas ou ferramentas se não se sentir bem.
Arexvy contém sódio e potássio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose; isto é, é essencialmente “isento de sódio”.
Este medicamento contém potássio, menos de 1 mmol (39 mg) por dose; isto é, é essencialmente “isento de potássio”.
3. Como é administrado Arexvy
Arexvy é administrado por meio de uma injeção de dose única de 0,5 ml num músculo. Normalmente, é administrado na parte superior do braço.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Efeitos adversos graves
Muito raros(podem produzir-se até em 1 de cada 10 000 doses de vacina):
- um distúrbio neurológico que, geralmente, começa com sensação de formigueiro e fraqueza nas extremidades e que pode progredir para paralisia de uma parte ou de todo o corpo (síndrome de Guillain-Barré).
Informa o seu médico imediatamente se perceber sinais deste efeito adverso grave.
Os seguintes efeitos adversos podem ocorrer após a administração de Arexvy:
Muito frequentes(podem produzir-se em mais de 1 de cada 10 doses de vacina):
- dor na zona de injeção
- cansaço (fadiga)
- dor de cabeça
- dor muscular (mialgia)
- dor nas articulações (artralgia)
- vermelhidão na zona de injeção
Frequentes(podem produzir-se até em 1 de cada 10 doses de vacina):
- inchaço na zona de injeção
- febre
- arrepios
Pouco frequentes(podem produzir-se até em 1 de cada 100 doses de vacina):
- coceira na zona de injeção
- dor
- mau-estar geral
- aumento dos gânglios linfáticos, ou inchaço dos gânglios do pescoço, axilas ou virilhas (linfoadenopatia)
- reações alérgicas, tais como erupção
- náuseas
- vómitos
- dor de estômago
Não conhecidos(não se podem estimar a partir dos dados disponíveis):
- morte do tecido cutâneo na zona de injeção (necrose na zona de injeção)
Informa o seu médico ou farmacêutico se apresentar algum dos efeitos adversos mencionados acima. A intensidade da maioria destes efeitos adversos é de leve a moderada e não dura muito.
Se algum dos efeitos adversos que sofre for grave ou se notar qualquer efeito adverso não mencionado neste prospecto, informa o seu médico ou farmacêutico.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informação sobre a segurança deste medicamento.
5. Conservação de Arexvy
- Mantenha este medicamento fora da vista e do alcance das crianças.
- Não utilize este medicamento após a data de validade que aparece na etiqueta e na caixa, após CAD. A data de validade é o último dia do mês que se indica.
- Conservar em frigorífico (entre 2 ºC e 8 ºC).
- Não congelar.
- Conservar no embalagem original para protegê-lo da luz.
- Os medicamentos não devem ser jogados fora pelo esgoto nem para o lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Arexvy
- Os princípios ativos são:
Após a reconstituição, uma dose (0,5 ml) contém:
Antígeno2,3 VRSPreF31 | 120 microgramas |
1 glicoproteína F recombinante do vírus respiratório sincicial estabilizada na conformação de pré-fusão = VRSPreF3
2 VRSPreF3 produzido em células de ovário de hámster chinês (OHC) mediante tecnologia do ADN recombinante
3 adjuvado com AS01E que contém: | |
extrato da planta Quillaja saponariaMolina, fração 21 (QS-21) | 25 microgramas |
3-O-desacil-4’-monofosforil lípido A (MPL) de Salmonella minnesota | 25 microgramas |
VRSPreF3 é uma proteína do vírus respiratório sincicial. Esta proteína não é infecciosa.
O adjuvante é utilizado para melhorar a resposta do organismo à vacina.
- Os outros componentes são:
- Pó(antígeno VRSPreF3): trealose diidratado, polissorbato 80 (E 433), dihidrogenofosfato de potássio (E 340) e fosfato dipotássico (E 340).
- Suspensão: dioleoil fosfatidilcolina (E 322), colesterol, cloreto de sódio, fosfato disódico anidro (E 339), dihidrogenofosfato de potássio (E 340) e água para preparações injetáveis.
Ver secção 2 “Arexvy contém sódio e potássio”.
Aspecto do produto e conteúdo do envase
- Pó e suspensão para suspensão injetável.
- O pó é branco.
- A suspensão é um líquido opalescente, de incoloro a marrom claro.
Um envase de Arexvy consiste em:
- Pó (antígeno) para 1 dose em um frasco
- Suspensão (adjuvante) para 1 dose em um frasco
Arexvy está disponível em envases de 1 frasco com pó e 1 frasco com suspensão ou em envases de 10 frascos com pó e 10 frascos com suspensão.
Pode ser que apenas alguns tamanhos de envases estejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
GlaxoSmithKline Biologicals SA
Rue de l’Institut 89
1330 Rixensart
Bélgica
Pode solicitar mais informação sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica GlaxoSmithKline Pharmaceuticals s.a./n.v Tel: + 32 (0) 10 85 52 00 | Lituânia GlaxoSmithKline Biologicals SA Tel: +370 80000334 |
| Luxemburgo GlaxoSmithKline Pharmaceuticals s.a./n.v Bélgica Tel: + 32 (0) 10 85 52 00 |
República Checa GlaxoSmithKline s.r.o. Tel: + 420 222 001 111 | Hungria GlaxoSmithKline Biologicals SA Tel.: +36 80088309 |
Dinamarca GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 | Malta GlaxoSmithKline Biologicals SA Tel: +356 80065004 |
Alemanha GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 | Países Baixos GlaxoSmithKline BV Tel: + 31 (0)33 2081100 |
Estônia GlaxoSmithKline Biologicals SA Tel: +372 8002640 | Noruega GlaxoSmithKline AS Tlf: + 47 22 70 20 00 |
Grécia GlaxoSmithKline Movoπρóσωπη A.E.B.E. Tel: + 30 210 68 82 100 | Áustria GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 |
Espanha GlaxoSmithKline, S.A. Tel: + 34 900 202 700 | Polônia GSK Services Sp. z o.o. Tel.: + 48 (22) 576 9000 |
França Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 | Portugal GlaxoSmithKline – Produtos Farmacêuticos, Lda. Tel: + 351 21 412 95 00 |
Croácia GlaxoSmithKline Biologicals SA Tel.: +385 800787089 | Romênia GlaxoSmithKline Biologicals SA Tel: +40 800672524 |
Irlanda GlaxoSmithKline (Irlanda) Ltd Tel: + 353 (0)1 495 5000 | Eslovênia GlaxoSmithKline Biologicals SA Tel: +386 80688869 |
Islândia Vistor hf. Sími: +354 535 7000 | República Eslovaca GlaxoSmithKline Biologicals SA Tel.: +421 800500589 |
Itália GlaxoSmithKline S.p.A. Tel: + 39 (0)45 7741 111 | Finlândia GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 |
Chipre GlaxoSmithKline Biologicals SA Tel: +357 80070017 | Suécia GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 |
Letônia GlaxoSmithKline Biologicals SA Tel: +371 80205045 | Reino Unido (Irlanda do Norte) GlaxoSmithKline Biologicals SA Tel: +44(0)800 221441 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: http://www.ema.europa.eu, e na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es/).
Na página web da Agência Europeia de Medicamentos pode encontrar-se este prospecto em todas as línguas da União Europeia/Espaço Econômico Europeu.
<---------------------------------------------------------------------------------------------------------->
Esta informação está destinada apenas a profissionais de saúde:
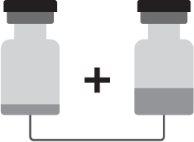
Arexvy é apresentado como um frasco com tampa removível verde mostarda que contém o pó (antígeno) e um frasco com tampa removível marrom que contém a suspensão (adjuvante).
Devem ser reconstituídos o pó e a suspensão antes da administração.
Antígeno | Adjuvante |
Pó | Suspensão |
| |
1 dose (0,5 ml) |
Devem ser examinados visualmente o pó e a suspensão para observar se existe alguma partícula estranha e/ou variação do aspecto. Se se apreciar alguma destas circunstâncias, não reconstituir a vacina.
Como preparar Arexvy
Arexvy deve ser reconstituído antes da administração.
- Retirar todo o conteúdo do frasco que contém a suspensão com uma seringa.
- Adicionar todo o conteúdo da seringa ao frasco que contém o pó.
- Agitar suavemente até que o pó se dissolva por completo.
A vacina reconstituída é um líquido opalescente, de incoloro a marrom claro.
A vacina reconstituída deve ser examinada visualmente para observar se existe alguma partícula estranha e/ou variação do aspecto. Se se apreciar alguma destas circunstâncias, não administrar a vacina.
Demonstrou-se a estabilidade física e química em uso durante 4 horas entre 2 ºC e 8 ºC ou a temperatura ambiente até 25 ºC.
Desde o ponto de vista microbiológico, a vacina deve ser utilizada imediatamente. Se não for utilizada imediatamente, os tempos e condições de conservação em uso antes da sua utilização são responsabilidade do utilizador e não devem superar as 4 horas.
Antes da administração
- Retirar 0,5 ml da vacina reconstituída com a seringa.
- Trocar a agulha de modo a que se utilize uma nova agulha.
Administrar a vacina por via intramuscular.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contacto com ele será realizada de acordo com a normativa local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a AREXVY pó e suspensão para suspensão injetávelForma farmacêutica: INJETÁVEL, 60 microgramas/dose + 60 microgramas/doseSubstância ativa: respiratory syncytial virus vaccinesFabricante: Pfizer Europe Ma EeigRequer receita médicaForma farmacêutica: INJETÁVEL, 50 µgSubstância ativa: respiratory syncytial virus vaccinesFabricante: Moderna Biotech Spain S.L.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,5 mlSubstância ativa: ebola vaccinesFabricante: Janssen-Cilag International N.VRequer receita médica
Médicos online para AREXVY pó e suspensão para suspensão injetável
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de AREXVY pó e suspensão para suspensão injetável – sujeita a avaliação médica e regras locais.