

NUCEIVA 50 unidades pó para solução injetável

Pergunte a um médico sobre a prescrição de NUCEIVA 50 unidades pó para solução injetável

Como usar NUCEIVA 50 unidades pó para solução injetável
Introdução
Prospecto: informação para o utilizador
NUCEIVA 50 Unidades pó para solução injectável
toxina botulínica de tipo A
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é NUCEIVA e para que é utilizado
- O que precisa saber antes de começar a usar NUCEIVA
- Como usar NUCEIVA
- Efeitos adversos possíveis
- Conservação de NUCEIVA
- Conteúdo do envase e informação adicional
1. O que é NUCEIVA e para que é utilizado
NUCEIVA contém o princípio ativo toxina botulínica de tipo A.
Impede a contração dos músculos, o que provoca uma paralisia temporária. Actua bloqueando os impulsos nervosos para os músculos em que é injectada.
NUCEIVA é utilizado para melhorar temporariamente o aspecto das rugas verticais entre as sobrancelhas. É utilizado em adultos com menos de 65 anos de idade em que as rugas faciais têm um impacto psicológico importante.
2. O que precisa saber antes de começar a usar NUCEIVA
Não use NUCEIVA:
- se é alérgico à toxina botulínica de tipo A ou a algum dos outros componentes deste medicamento (incluídos na secção 6);
- se padece miastenia grave ou síndrome de Eaton Lambert (doenças crónicas que afectam os músculos);
- se tem uma infecção ou inflamação nos locais de injeção propostos entre as sobrancelhas e sobre elas (como se indica na figura 1).
Advertências e precauções
Muito raramente se produzem efeitos adversos possivelmente relacionados com a disseminação da toxina botulínica desde o local de injeção (p. ex., fraqueza muscular, dificuldade para engolir ou entrada de alimentos ou líquidos nas vias respiratórias). Os pacientes que recebem as doses recomendadas podem apresentar fraqueza muscular exagerada.
A injeção está associada a dor localizada, inflamação/inchação, sensibilidade anómala (parestesia), diminuição da sensibilidade (hipoestesia), dor à palpação, erupção cutânea (eritema), infecção localizada, hemorragia e/ou hematomas. A dor e/ou a ansiedade relacionadas com a agulha deram lugar a respostas vasovagais, como palidez, náuseas, suor, visão borrosa, ritmo cardíaco rápido, tontura e/ou um descenso temporário na pressão arterial que provoca tonturas ou desmaios.
Visite o seu médico imediatamente se lhe resultar difícil engolir, falar ou respirar após o tratamento.
- Este medicamento não está recomendado em pacientes que tenham tido problemas para engolir (disfagia) e respirar recentemente ou no passado, porque impediria a administração segura do medicamento na opinião do médico.
- A administração demasiado frequente ou excessiva pode provocar a formação de anticorpos. A formação de anticorpos pode impedir que a toxina botulínica de tipo A actue mesmo para outros usos.
- Muito raramente, pode produzir-se uma reação alérgica após a injeção de toxina botulínica.
Entre os sintomas incluem-se reacções cutâneas, como urticária, picazón e pele enrubescida ou pálida, inchação dos olhos, dos lábios, da boca ou da garganta, pulso débil e rápido, tonturas e sibilâncias ou falta de alento
- Pode produzir-se queda do párpado após o tratamento.
Informa ao seu médico se:
- teve problemas com injeções anteriores de toxina botulínica;
- não observa qualquer melhoria significativa das rugas um mês após o primeiro ciclo de tratamento;
- padece determinadas doenças que afectam o sistema nervoso (como esclerose lateral amiotrófica ou neuropatia motora);
- tem inflamação no local de injeção proposto;
- os músculos que se vão injectar são fracos ou estão deteriorados;
- tem um distúrbio hemorrágico, porque a injeção pode causar hematomas.
Crianças e adolescentes
Não se recomenda o uso deste medicamento em menores de 18 anos de idade.
Outros medicamentos e NUCEIVA
Informa ao seu médico ou farmacêutico se está a tomar, tomou recentemente ou possa ter que tomar qualquer outro medicamento.
Não se recomenda o uso de toxina botulínica associada a antibióticos aminoglicosídios, espectinomicina ou outros medicamentos que afectem os impulsos nervosos para o músculo.
Informa ao seu médico se lhe foi injectado recentemente um medicamento que contenha toxina botulínica (o princípio ativo de NUCEIVA), porque isso pode aumentar excessivamente o efeito deste medicamento.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de utilizar este medicamento.
Não se recomenda o uso deste medicamento durante a gravidez nem em mulheres capazes de ter filhos que não utilizem métodos anticonceptivos.
Este medicamento não está recomendado em mulheres em período de amamentação.
Condução e uso de máquinas
Foram descritas fraqueza muscular, tonturas e alterações visuais com este medicamento que podem tornar perigosa a condução ou o uso de máquinas. Não conduza nem utilize máquinas até que estes efeitos tenham desaparecido.
NUCEIVA contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose; isto é, é essencialmente
«exento de sódio».
3. Como usar NUCEIVA
As doses unitárias de NUCEIVA não são intercambiáveis com as utilizadas para outros preparados de toxina botulínica.
Este medicamento apenas deve ser injectado por médicos com a devida qualificação e experiência no tratamento das rugas do entrecejo com o cenho franzido.
A dose habitual de NUCEIVA é de 20 Unidades. Ser-lhe-á injectado o volume recomendado de 0,1 mililitros (ml) (4 Unidades) deste medicamento em cada um dos 5 locais de injeção.
A melhoria da profundidade das rugas entre as sobrancelhas produz-se geralmente nos poucos dias após o tratamento.
O intervalo entre os tratamentos será decidido pelo seu médico.
Como se injecta NUCEIVA
Este medicamento é injectado nos músculos (por via intramuscular), directamente na zona afectada entre as sobrancelhas e sobre elas.
Uma vez reconstituído, NUCEIVA apenas deve ser utilizado para tratar um único paciente durante uma única sessão.
Se tiver alguma outra dúvida sobre o uso deste produto, pergunte ao seu médico ou farmacêutico.
4. Efeitos adversos possíveis
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Em geral, os efeitos adversos aparecem nos primeiros dias após a injeção e são passageiros. A maioria dos efeitos adversos é de intensidade ligeira ou moderada.
Se tiver alguma dificuldade para respirar, engolir ou falar após receber este medicamento, contacte imediatamente o seu médico.
Se apresentar habones, inchação, incluindo inchação da face ou da garganta, sibilâncias, sensação de fraqueza e falta de alento, contacte imediatamente o seu médico, porque podem ser sintomas de uma reação alérgica.
A probabilidade de sofrer um efeito adverso é descrita nas seguintes categorias:
Frequentes (podem afectar até 1 de cada 10) | Dor de cabeça, desequilíbrio muscular que produz sobrancelhas elevadas ou assimétricas, queda de pálpebra, hematomas no local de injeção |
Pouco frequentes (podem afectar até 1 de cada 100 pessoas) | Trastornos sensitivos, molestias na cabeça, olho seco, inchação das pálpebras, inchação dos olhos, contrações musculares, local de injeção: enrubescimento, dor, formigueiro |
Comunicação de efeitos adversos
Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de NUCEIVA
Conservar em frigorífico (entre 2ºC e 8ºC)
Mantenha fora da vista e do alcance das crianças.
Frasco sem abrir
Não utilize este medicamento após a data de caducidade que aparece no frasco e na caixa após CAD.
6. Conteúdo do envase e informação adicional
Composição de NUCEIVA
- O princípio ativo é: 50 Unidades de toxina botulínica de tipo A.
- Os outros componentes são albúmina humana e cloreto de sódio.
Aspecto do produto e conteúdo do envase
NUCEIVA apresenta-se sob a forma de pó branco para solução injectável em um frasco de vidro transparente.
Cada envase contém 1 frasco.
Titular da autorização de comercialização e Fabricantes
Evolus Pharma B.V.
Apollolaan 151
1077 AR Amesterdão
Países Baixos
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização.
Data da última revisão deste prospecto: maio 2024.
ESTA INFORMAÇÃO ESTÁ DESTINADA ÚNICAMENTE A MÉDICOS OU PROFISSIONAIS DO SECTOR SANITÁRIO:
As Unidades de toxina botulínica não são intercambiáveis de um produto para outro. As doses recomendadas em Unidades são diferentes das de outros preparados de toxina botulínica.
A reconstituição deve ser realizada de acordo com as boas práticas clínicas, especialmente no que respeita à técnica asséptica. NUCEIVA é reconstituído com cloreto de sódio 9 mg/ml (0,9 %) para solução injectável. São extraídos 1,25 ml de cloreto de sódio 9 mg/ml (0,9 %) para solução injectável para obter uma solução reconstituída injectável em uma concentração de 4 Unidades/0,1 ml.
Quantidade de diluente adicionada ao frasco de 50 Unidades (cloreto de sódio 9 mg/ml (0,9%) para solução injectável) | Dose resultante (Unidades por 0,1 ml) |
1,25 ml | 4,0 U |
A parte central do tampão de borracha deve ser limpa com álcool. Injetar lentamente o diluente no frasco com uma agulha através do tampão de borracha e girar suavemente o frasco evitando a formação de bolhas. O frasco deve ser deitado fora se, ao fazer-se o vácuo, não se introduzir o diluente no frasco. Uma vez reconstituído, a solução injectável deve ser inspeccionada visualmente antes do seu uso para verificar que é uma solução transparente e incolor, livre de partículas.
NUCEIVA reconstituído (50 Unidades/1,25 ml) é injectado com uma agulha estéril de calibre 30. São administradas quatro unidades (4 U/0,1 ml) em cada um dos 5 locais de injeção (ver figura 1): 2 injeções em cada músculo corrugador (cara interna inferior e cara interna superior) e 1 injeção no músculo prócer, o que representa uma dose total de 20 Unidades.
Figura 1 Pontos de injeção
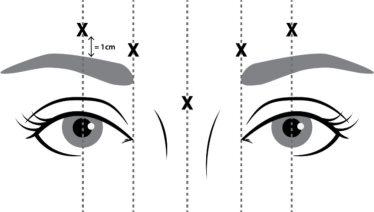
Para reduzir a complicação da ptose palpebral, devem ser adoptadas as seguintes medidas:
- Evite a injeção perto do elevador do pálpebra superior, sobretudo nos pacientes com complexos depressores da sobrancelha de grande tamanho.
- As injeções no corrugador lateral devem ser aplicadas pelo menos 1 cm por cima do bordo supraorbitário ósseo.
- Certifique-se de que o volume/dose injectado é exacto e de que, quando possível, é mantido ao mínimo.
Procedimento para a eliminação segura dos frascos, das seringas e dos materiais utilizados:
Imediatamente após o seu uso, a solução injectável de NUCEIVA reconstituída não utilizada que reste no frasco ou na seringa deve ser inactivada, antes da sua eliminação, com 2 ml de solução de hipoclorito de sódio diluído a 0,5 % ou a 1 % de cloro disponível. Após a inactivação, eliminar de acordo com os requisitos locais.
Os frascos, as seringas e os materiais utilizados não devem ser esvaziados e devem ser deitados fora em recipientes apropriados e eliminados de acordo com a normativa local.
Recomendações em caso de acidente durante a manipulação da toxina botulínica:
Em caso de acidente ao manipular o produto, seja em estado de seco ao vácuo ou reconstituído, devem ser aplicadas imediatamente as medidas apropriadas que se descrevem a seguir.
- A toxina é muito sensível ao calor e a determinados agentes químicos.
- Os derrames devem ser limpos com um material absorbente empapado em uma solução de hipoclorito de sódio (lixívia) no caso do produto seco ao vácuo ou com um material absorbente seco se o produto já estiver reconstituído.
- As superfícies contaminadas devem ser limpas com um material absorbente empapado em uma solução de hipoclorito de sódio (lixívia) e secas a seguir.
- Se um frasco se partir, recolha cuidadosamente os pedaços de vidro e limpe o produto como se indicou anteriormente, evitando cortes na pele.
- Em caso de salpicaduras, lave com uma solução de hipoclorito de sódio e enxágue abundantemente com água.
- Em caso de salpicar nos olhos, lave-os bem com água abundante ou com uma solução para lavagem ocular.
- Se o operador se lesionar (se cortar, se picar), siga os passos anteriores e tome as medidas médicas oportunas, dependendo da dose injectada.
Devem ser seguidas estritamente estas instruções de uso, manipulação e eliminação.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a NUCEIVA 50 unidades pó para solução injetávelForma farmacêutica: INJETÁVEL, 200 U/mlSubstância ativa: botulinum toxinFabricante: Ipsen PharmaRequer receita médicaForma farmacêutica: INJETÁVEL, 125 Unidades SpeywoodSubstância ativa: botulinum toxinFabricante: Ipsen Pharma S.A.U.Requer receita médicaForma farmacêutica: INJETÁVEL, 100 unidadesSubstância ativa: botulinum toxinFabricante: Merz Pharmaceuticals GmbhRequer receita médica
Alternativas a NUCEIVA 50 unidades pó para solução injetável noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a NUCEIVA 50 unidades pó para solução injetável em Poland
Alternativa a NUCEIVA 50 unidades pó para solução injetável em Ukraine
Médicos online para NUCEIVA 50 unidades pó para solução injetável
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de NUCEIVA 50 unidades pó para solução injetável – sujeita a avaliação médica e regras locais.








