
ISOPROTRACE 10 MICROGRAMAS KIT PARA PREPARAÇÃO RADIOFARMACÊUTICA

Pergunte a um médico sobre a prescrição de ISOPROTRACE 10 MICROGRAMAS KIT PARA PREPARAÇÃO RADIOFARMACÊUTICA

Como usar ISOPROTRACE 10 MICROGRAMAS KIT PARA PREPARAÇÃO RADIOFARMACÊUTICA
Introdução
Prospecto: informação para o paciente
Isoprotrace 10microgramas equipamento de reagentes para preparação radiofarmacêutica
gozetotida
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conservar este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico nuclear que supervisionará o procedimento.
- Se experimentar efeitos adversos, consulte o seu médico nuclear, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Isoprotrace e para que se utiliza
- O que precisa saber antes de que lhe administrem Isoprotrace
- Como se administra Isoprotrace
- Possíveis efeitos adversos
- Conservação de Isoprotrace
- Conteúdo do envase e informação adicional
1. O que é Isoprotrace e para que se utiliza
Este medicamento é um radiofármaco unicamente para uso diagnóstico.
Contém uma substância denominada gozetotida. Antes de poder utilizá-lo, o pó do frasco se mistura com uma substância radiativa chamada cloreto de gálio (68Ga) para produzir gálio (68Ga)-gozetotida (este procedimento recebe o nome de marcação radiativa).
Depois da marcação radiativa com gálio (68Ga), Isoprotrace se emprega em um tipo especial de técnica de diagnóstico por imagens denominada tomografia por emissão de pósitrons (PET, por suas siglas em inglês) para detectar determinados tipos de células cancerosas que têm uma proteína chamada antígeno prostático específico de membrana (PSMA, por suas siglas em inglês) em pacientes:
- com cancro da próstata com um risco elevado de que a doença se estenda a outras partes do corpo e que sejam aptos para receber um tratamento capaz de curar o cancro
- que tenham recebido um tratamento anterior para o cancro da próstata e em quem se suspeite que tenha voltado a aparecer o cancro, tendo em conta os resultados obtidos em outras provas (p. ex., antígeno prostático específico [PSA]).
O uso de Isoprotrace implica receber uma pequena quantidade de radiatividade. O seu médico e o médico nuclear consideraram que o benefício clínico que você obterá do procedimento com o radiofármaco supera o risco da radiação.
2. O que precisa saber antes de que lhe administrem Isoprotrace
Não lhe devem administrar Isoprotrace
- se for alérgico a gozetotida ou a algum dos outros componentes deste medicamento (incluídos na seção 6).
Advertências e precauções
Antes de começar a receber Isoprotrace, fale com o seu médico nuclear se padece uma doença renal.
Antes da administração de Isoprotrace
Deve beber muita água antes de começar o procedimento para urinar muito frequentemente durante as primeiras horas após a sua finalização para garantir que Isoprotrace se elimine do seu corpo o mais rápido possível.
Crianças e adolescentes
Isoprotrace não está indicado para uso em crianças e adolescentes menores de 18 anos de idade. Não se estabeleceu a segurança e eficácia de gálio (68Ga)-gozetotida nesta população de pacientes.
Gravidez e amamentação
Isoprotrace não está indicado para uso em mulheres. Todos os radiofármacos, incluindo Isoprotrace, podem causar dano ao feto.
Condução e uso de máquinas
Considera-se improvável que Isoprotrace afete a capacidade de conduzir e utilizar máquinas.
Isoprotrace contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por frasco; isto é, essencialmente «isento de sódio».
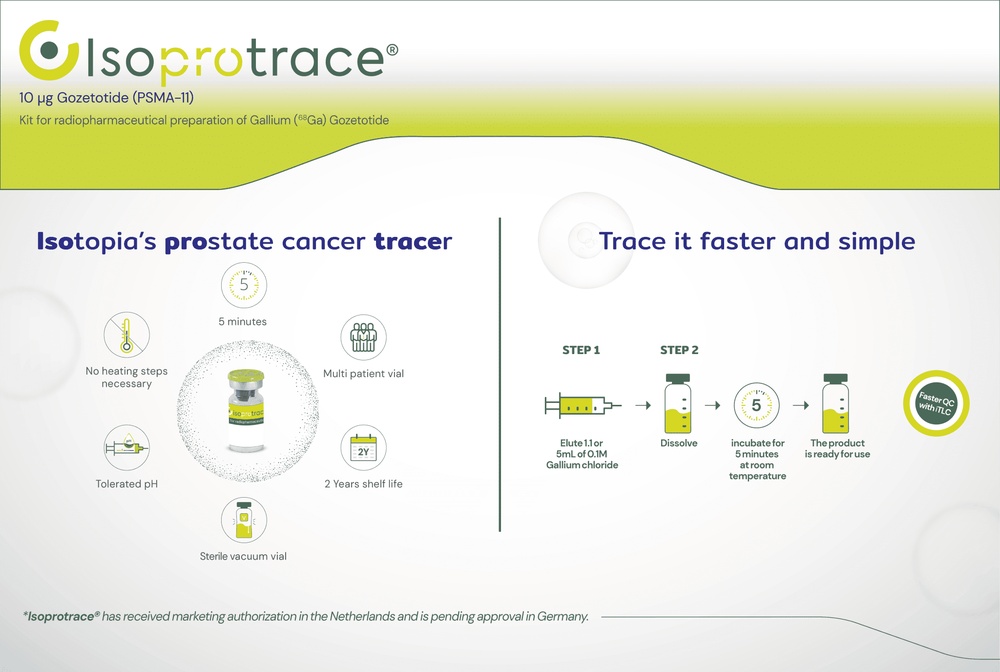
3. Como se administra Isoprotrace
Há normas estritas sobre o uso, manipulação e eliminação de radiofármacos. Isoprotrace se utilizará unicamente em áreas controladas especiais. Este produto só será manuseado e administrado por pessoal treinado e qualificado para usá-lo de forma segura. Essas pessoas colocarão especial cuidado no uso seguro deste produto e o informarão das suas ações.
O médico nuclear que supervisiona o procedimento decidirá a quantidade de Isoprotrace que se deve usar no seu caso. Esta será a quantidade mínima necessária para obter a informação desejada.
A quantidade habitualmente recomendada para administrar a um adulto é de 111 a 259 MBq (megabequerelios, a unidade utilizada para expressar radiatividade).
Administração de Isoprotrace e realização do procedimento
Após a marcação radiativa, Isoprotrace se administra mediante uma injeção intravenosa lenta. Uma única injeção é suficiente para realizar a prova que o seu médico precisa.
Duração do procedimento
O seu médico nuclear o informará sobre a duração habitual do procedimento.
Depois da administração de Isoprotrace, você deve
- continuar a beber água em abundância para se manter hidratado e urinar com a maior frequência possível a fim de eliminar o medicamento do seu organismo
- evitar o contato direto com crianças pequenas e mulheres grávidas durante as primeiras 6 horas posteriores à injeção.
O médico nuclear o informará se for necessário que tome alguma precaução especial após receber este medicamento. Consulte com o seu médico nuclear se tiver alguma dúvida.
Se lhe foi administrada mais Isoprotrace do que deve
É improvável que se produza uma sobredosagem, porque unicamente receberá uma única dose de Isoprotrace controlada com precisão pelo médico nuclear que supervisiona o procedimento. No entanto, em caso de produzir-se uma sobredosagem, receberá o tratamento adequado. Beber e urinar com frequência o ajudará a eliminar a radiatividade do seu organismo com maior rapidez.
Se tiver alguma outra dúvida sobre o uso de Isoprotrace, pergunte ao médico nuclear que supervisiona o procedimento.
4. Possíveis efeitos adversos
Assim como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Podem produzir-se os seguintes efeitos adversos:
Pouco frequentes (podem afetar até 1 de cada 100 pessoas):
- dor de cabeça
- tontura
- sensação de formigamento e entorpecimento da pele
- sensação de sonolência durante o dia ou problemas para conciliar o sono à noite
- náuseas
- diarreia
- dificuldade para engolir
- erupção
- cansaço
- ardor, picor e dor no local da injeção
A administração deste radiofármaco implica receber uma pequena quantidade de radiação ionizante com um risco muito baixo de desenvolver cancro e defeitos hereditários.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico de medicina nuclear, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaRAM.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Isoprotrace
Você não terá que armazenar este medicamento. Este medicamento se armazena sob a responsabilidade do especialista em instalações apropriadas. O armazenamento de radiofármacos se realizará conforme a normativa nacional sobre materiais radiativos.
A seguinte informação está destinada unicamente ao especialista:
Não utilize este medicamento após a data de caducidade que aparece no envase e na etiqueta após «CAD». A data de caducidade é o último dia do mês que se indica.
Conservar em refrigerador (2 °C – 8 °C).
Após a reconstituição e a marcação radiativa: conservar em posição vertical por debaixo de 25 °C e usar em um prazo de 4 horas.
Desde um ponto de vista microbiológico, a menos que o método de abertura, marcação radiativa ou diluição exclua o risco de contaminação microbiana, o produto deve ser utilizado imediatamente. Se não for utilizado de imediato, os tempos e as condições de conservação em uso são responsabilidade do usuário.
6. Conteúdo do envase e informação adicional
Composição de Isoprotrace
- O princípio ativo é gozetotida. Cada frasco contém 10 microgramas de gozetotida.
- Os demais excipientes são: gelatina hidrolisada, acetato sódico anidro e cloreto sódico. Ver seção 2 “Isoprotrace contém sódio”.
Após a marcação radiativa, a solução obtida contém também, como excipiente, ácido clorídrico.
Aspecto de Isoprotrace e conteúdo do envase
O envase contém 5 frascos de vidro multidose com um volume de 10 ml em uma caixa de cartão. Cada frasco contém um pó branco ou esbranquiçado.
A substância radiativa não faz parte do equipamento e deverá ser adicionada durante os passos de preparação antes da administração.
Titular da autorização de comercialização
Billev Pharma ApS
Slotsmarken 10
2970 Hørsholm
Dinamarca
Responsável pela fabricação
Cilatus Manufacturing Services Limited
Pembroke House
28-32 Pembroke Street Upper
Dublin 2, D02 EK84
Irlanda
Podem solicitar mais informações respeito a este medicamento dirigindo-se aorepresentante localdo titular da autorização de comercialização:
NUCLIBER, S.A.
N° Telf. +34 915062940
Data da última revisão deste prospecto: 02/2025.
A informação detalhada deste medicamento está disponível na página web da Agência Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
------------------------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a profissionais de saúde:
A ficha técnica completa de Isoprotrace se inclui como documento separado no envase do produto, com o fim de proporcionar aos profissionais de saúde outra informação científica e prática adicional sobre a administração e o uso deste radiofármaco.
Por favor, consulte a ficha técnica.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a ISOPROTRACE 10 MICROGRAMAS KIT PARA PREPARAÇÃO RADIOFARMACÊUTICAForma farmacêutica: RADIOFÁRMACO, 25 microgramasSubstância ativa: gallium (68Ga) gozetotideFabricante: Telix InnovationsRequer receita médicaForma farmacêutica: RADIOFÁRMACO, 25 microgramasSubstância ativa: gallium (68Ga) gozetotideFabricante: Novartis Europharm LimitedRequer receita médicaForma farmacêutica: INJETÁVEL, 74 MBq iobenguano (123I)Substância ativa: iobenguane (123I)Fabricante: Ge Healthcare Bio-Sciences, S.A.U.Requer receita médica
Médicos online para ISOPROTRACE 10 MICROGRAMAS KIT PARA PREPARAÇÃO RADIOFARMACÊUTICA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de ISOPROTRACE 10 MICROGRAMAS KIT PARA PREPARAÇÃO RADIOFARMACÊUTICA – sujeita a avaliação médica e regras locais.











