
IMMUNINE 1200 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL OU PARA PERFUSÃO

Pergunte a um médico sobre a prescrição de IMMUNINE 1200 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL OU PARA PERFUSÃO

Como usar IMMUNINE 1200 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL OU PARA PERFUSÃO
Introdução
Prospecto: informação para o utilizador
IMMUNINE 1200 UI
Pó e diluente para solução injetável ou para perfusão
fator IX humano de coagulação sanguínea
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas para si e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é IMMUNINE e para que é utilizado
- O que precisa saber antes de começar a usar IMMUNINE
- Como usar IMMUNINE
- Possíveis efeitos adversos
- Conservação de IMMUNINE
- Conteúdo do envase e informação adicional
1. O que é IMMUNINE e para que é utilizado
IMMUNINE é um concentrado do fator IX da coagulação. Substitui o fator IX que falta ou que não funciona corretamente na hemofilia B. A hemofilia B é um defeito na coagulação do sangue de tipo hereditário e ligado ao sexo e que se deve à diminuição dos níveis de fator IX. Provoca hemorragias graves em articulações, músculos e órgãos internos, seja de forma espontânea ou como consequência de um trauma acidental ou quirúrgico. A administração de IMMININE corrige temporariamente a deficiência de fator IX e reduz a tendência a sofrer hemorragias.
IMMUNINE é utilizado para o tratamento e a profilaxia de hemorragias em pacientes com hemofilia B congénita.
IMMUNINE está indicado para todos os grupos etários, desde crianças maiores de 6 anos até adultos.
Não há dados suficientes para recomendar o uso de IMMUNINE em crianças menores de 6 anos de idade.
2. O que precisa saber antes de começar a usar IMMUNINE
Não use IMMUNINE
- Se é alérgicoao fator IX de coagulação humano ou a qualquer um dos outros componentes deste medicamento (incluídos na seção 6).
- Se tem alergia conhecida à heparina ou teve um descenso anormal do número de células sanguíneas envolvidas na formação de coágulos sanguíneos que é causado pela administração de heparina (trombocitopenia induzida por heparina).
Depois de um tratamento adequado dessas situações, IMMUNINE deve ser utilizado apenas em caso de episódios hemorrágicos com risco vital.
Advertências e precauções
Consulte o seu médico ou farmacêutico antes de começar a usar IMMUNINE.
Quando se produzem reações alérgicas:
Existe a possibilidade pouco frequente de que possa experimentar uma reação alérgica repentina e grave (reação anafiláctica) a IMMUNINE.
Se detectar um ou mais dos seguintes sintomas interrompa imediatamente a administração e peça assistência médica ao instante. Pode ser sinal de um choque anafiláctico e requer um tratamento urgente imediato.
- vermelhidão da pele
- erupção cutânea
- formação de borbulhas na pele (urticária)
- coceira em todo o corpo
- inchaço dos lábios e língua
- dificuldades para respirar / dispneia
- dificuldade para inspirar ou expirar devido à constrição das vias respiratórias (sibilância)
- opressão no peito
- mau-estar geral
- tontura
- diminuição da tensão arterial
- perda de consciência
Quando se requer uma monitorização:
- É possível que o seu médico deseje realizar alguma prova para assegurar que a dose que recebe é suficiente para atingir e manter níveis adequados do fator IX no sangue.
- O seu médico o vigiará com especial cuidado com o objetivo de detectar possíveis complicações:
- se recebe doses altas de IMMUNINE
- se é propenso a desenvolver trombose. Nesse caso, receberá níveis mais baixos de fator IX, o princípio ativo de IMMUNINE.
Quando a hemorragia segue produzindo-se:
- Se a sua hemorragia não chega a controlar-se com IMMUNINE, consulte o seu médico imediatamente. É possível que tenha desenvolvido inibidores do Fator IX. Os inibidores do fator IX são anticorpos presentes no sangue que contrariam o efeito do fator IX. Isso reduz a eficácia de IMMUNINE no tratamento das hemorragias. O seu médico realizará as provas necessárias para confirmá-lo.
- Existe uma possível conexão entre a aparição de inibidores do fator IX e as reações alérgicas. Os pacientes com inibidores do fator IX podem ter um maior risco de reações alérgicas (anafilaxia) repentinas e graves. Por conseguinte, nos pacientes que sofram uma reação alérgica, deve ser investigada a presença de um inibidor do fator IX.
Informe ao seu médico se padece doença cardíaca ou hepática ou se se submeteu recentemente a intervenções de cirurgia maior, porque existe um maior risco de complicações de formação de coágulos (coagulação) de sangue.
Informação de segurança com respeito a agentes transmissores de infecções
Quando se administram medicamentos derivados de plasma ou sangue humano, há que levar a cabo certas medidas para evitar que as infecções passem aos pacientes. Tais medidas incluem:
- uma cuidadosa seleção dos doadores, para excluir aqueles que estão em risco de ser portadores de doenças infecciosas
- análise de marcadores específicos de infecções nas doações individuais e nas misturas de plasma para detectar possíveis vírus ou infecções
- a inclusão de etapas no processo de fabricação para eliminar / inativar vírus.
Apesar disto, quando se administram medicamentos derivados da sangue ou plasma humanos, a possibilidade de transmissão de agentes infecciosos não se pode excluir totalmente. Isso também se refere a vírus emergentes ou de natureza desconhecida ou outros tipos de infecções.
Estas medidas são consideradas eficazes para vírus envoltos como o vírus da imunodeficiência humana (VIH), vírus da hepatite B e vírus da hepatite C e para o vírus não envolto da hepatite A.
As medidas tomadas podem ter um valor limitado frente a outros vírus não envoltos como o parvovirus B19 (vírus que causa vermelhidão da pele (eritema infeccioso)).
A infecção por parvovirus B19 pode ser grave para uma mulher grávida (infecção fetal) e para pessoas cujo sistema imunológico está deprimido ou em pacientes que têm algum tipo de anemia (por exemplo anemia drepanocítica ou anemia hemolítica).
É possível que o seu médico lhe recomende vacinar-se contra hepatite A e hepatite B, se a si se lhe administra de forma regular ou repetida medicamentos obtidos de plasma humano.
Recomenda-se encarecidamente que, cada vez que se administre uma dose de IMMNUNINE, se deixe constância do nome do medicamento e do número do lote administrado com o fim de manter um registo dos lotes utilizados.
Crianças
Não há dados suficientes para recomendar o uso de IMMUNINE em crianças menores de 6 anos.
Uso de IMMUNINE com outros medicamentosInforme ao seu médico ou farmacêutico se está a tomar ou se tomou ou pudesse ter que tomar outro medicamento.
Não se conhecem interações de IMMUNINE com outros medicamentos.
Gravidez e lactação
A hemofilia B é rara na mulher. Por conseguinte, atualmente não se dispõe de experiência sobre o uso de IMMUNINE durante a gravidez e a lactação.
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de usar este medicamento.
O seu médico decidirá se pode usar Immunine durante a gravidez e a lactação.
Condução e uso de máquinas
Não se observaram efeitos sobre a capacidade para conduzir e utilizar máquinas.
IMMUNINE contém cloreto de sódio e citrato de sódio
Este medicamento contém 41 mg de sódio (componente principal da sal de mesa/para cozinhar) em cada frasco. Isso equivale a 2 % da ingestão diária máxima de sódio recomendada para um adulto.
3. Como usar IMMUNINE
O tratamento deve ser iniciado e supervisionado por um médico com experiência no tratamento da hemofilia B.
O seu médico decidirá qual é a dose adequada para si. Calculará a dose de acordo com as suas necessidades particulares. Informe ao seu médico se tem a impressão de que o efeito de Immunine é demasiado forte ou demasiado fraco em si.
Uso em crianças
Não existem dados suficientes para recomendar o uso de IMMUNINE em crianças menores de 6 anos.
Monitorização pelo seu médico
O seu médico realizará os análises de laboratório apropriados a intervalos regulares para assegurar que tem níveis suficientes de Fator IX. Isso é especialmente importante se se vai submeter a uma operação importante ou de hemorragias que ponham em perigo a sua vida.
Pacientes com inibidores
Se o nível de fator IX no sangue não atinge os níveis esperados, ou se não se controla a hemorragia após uma dose adequada, deve-se suspeitar a presença de inibidores do fator IX. O seu médico comprovará a presença de inibidores realizando as provas adequadas. Em caso de desenvolvimento de inibidor, deve-se contactar com um centro especializado em hemofilia.
Se desenvolveu inibidores do fator IX, pode precisar de uma maior quantidade de IMMUNINE para controlar a hemorragia. Se esta dose não controla a sua hemorragia, o seu médico pode considerar o uso de outro medicamento alternativo. Não aumente a dose total de IMMUNINE que utiliza para controlar a sua hemorragia sem consultar o seu médico.
Frequência de administração
O seu médico lhe indicará com que frequência e a que intervalos deve administrar-se IMMUNINE. Lo calculará para o seu caso em particular, dependendo da sua resposta a IMMUNINE.
Via e/ou forma de administração
IMMUNINE é administrado lentamentenuma veia (por via intravenosa) após preparar a solução com o diluente proporcionado.
Antes da sua administração, IMMUNINE não deve ser misturado com outros medicamentos. Isso pode afetar a eficácia e a segurança do produto.
Por favor, siga estritamente as instruções do seu médico.
A velocidade de administração dependerá das molestias que possa sentir, sem ultrapassar os 2 ml por minuto.
- Utilize apenas o equipamento de administração fornecido. Se se utilizam outros equipamentos de administração, pode produzir-se uma dosagem incorrecta como consequência da adsorção de IMMUNINE às superfícies internas de alguns equipamentos de perfusão.
- Se recebe também outros produtos através do mesmo acesso venoso, develavar esse acesso com uma solução adequada, como soro salino fisiológico, antes e depoisda administração de IMMUNINE.
- IMMUNINE deve ser reconstituído apenas imediatamente antes de ser administrado e a solução deve ser utilizada de imediato. (A solução não contém conservantes). A perfusão deve ser completada nas 3 horas seguintes à reconstituição.
- A solução injetável é transparente ou ligeiramente leitosa (opalescente). Não utilize soluções turvas ou que contenham partículas visíveis.
- Qualquer solução não utilizada deve ser eliminada correctamente.
Reconstituição do pó para preparar uma solução injetável:
¡Procure preparar a solução em condições o mais limpas e estéreis possíveis!
- Aqueça o frasco fechado com tampão de borracha que contém o diluente (água esterilizada para preparações injetáveis) a temperatura ambiente (máx. 37 ºC).
- Retire os protectores dos frascos com tampões de borracha que contêm o pó e o diluente (fig. A) e limpe os tampões de borracha de ambos os frascos.
- Retire o precinto que cobre um dos extremos da agulha de transvasação girando e puxando-o. Introduza a agulha através do tampão de borracha do frasco de diluente (fig. B e C).
- Retire o precinto que cobre o outro extremo da agulha de transvasação, tendo cuidado para não tocar o extremo exposto.
- Vire o frasco de diluente sobre o frasco de pó e introduza o extremo livre da água de transvasação no frasco de pó, perfurando o tampão obturador (fig. D). O vácuo existente no frasco de pó aspirará o diluente.
- Depois de que todo o diluente tenha passado para o frasco de pó, separe os dois frascos retirando a agulha de transvasação do frasco de pó (fig. E). Agite suavemente o frasco de pó para acelerar a dissolução.
- Uma vez que o pó tenha sido completamente dissolvido, introduza a agulha de arejamento incluída (Fig. F) e desaparecerá a espuma que pudesse ter-se formado. Retire a agulha de arejamento.
Injeção / Perfusão:
¡Procure preparar a solução em condições o mais limpas e estéreis possíveis!
- Retire o protector da agulha filtro incluída girando e puxando-o e coloque-a numa seringa estéril descartável. Aspire a solução com a seringa (fig. G).
- Separe a seringa da agulha filtro e injete lentamente (velocidade máxima de 2 ml por minuto) a solução por via intravenosa com o equipamento de perfusão que se fornece (ou com a agulha descartável incluída).
Se o produto for administrado por perfusão, utilize o equipamento de perfusão com aletas descartável com um filtro adequado.
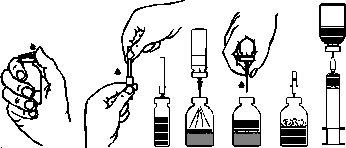
fig.A fig.B fig.C fig.D fig.E fig.F fig.G
Duração do tratamento
O tratamento com IMMUNINE normalmente deve ser mantido por toda a vida.
Se usa mais IMMUNINE do que devia:
Informe ao seu médico. Os sintomas por sobredosagem com fator IX não foram notificados.
Se esqueceu de usar IMMUNINE
- Não tome uma dose dupla para compensar as doses esquecidas.
- Continue com a próxima administração imediatamente e siga a intervalos regulares tal como lhe indicou o seu médico.
Se interrompeu o tratamento com IMMUNINE
Não decida interromper o tratamento com IMMUNINE sem consultar o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Deve procurar ajuda médica urgente se se produzirem alguns dos seguintes efeitos adversos graves
- reação alérgica perigosa (reação anafiláctica). Interrompa imediatamente a administração e peça assistência médica ao instante se experimentar algum dos seguintes sintomas. Preste uma atenção especial se o seu médico detecta inibidores no seu sangue. vermelhidão da pele
- erupção cutânea
- formação de borbulhas na pele (urticária)
- coceira em todo o corpo
- inchaço dos lábios e língua
- dificuldades para respirar (dispneia)
- dificuldade para inspirar ou expirar devido à constrição das vias respiratórias (sibilância)
- opressão no peito
- mau-estar geral
- tontura
- diminuição da tensão arterial
- perda de consciência uma inchação repentina da pele ou das membranas mucosas, com ou sem dificuldade para engolir ou respirar (angioedema)
- formação de coágulos de sangue em vasos sanguíneos pequenos por todo o corpo (coagulação intravascular disseminada (DIC))
- ataque cardíaco (infarto de miocárdio)
- palpitação rápida do coração (taquicardia)
- queda da tensão arterial (hipotensão),
- coágulos em sangue (episódios tromboembólicos)
- oclusão de um vaso por um coágulo de sangue (p. ex. embolia pulmonar, trombose venosa, trombose arterial, trombose da arteria cerebral)
- vermelhidão.
- dificuldade para inspirar ou expirar devido à constrição das vias respiratórias (sibilância)
- dificuldade para respirar (dispneia)
- um tipo de distúrbio renal com sintomas como inchaço dos lábios, rosto e parte inferior das pernas, com aumento de peso e eliminação de proteínas pela urina (síndrome nefrótico)
Se o seu médico detecta inibidores no seu sangue pode ter um risco específico de padecer uma doença chamada doença do soro. Interrompa imediatamente a administração e peça assistência médica ao instante se experimentar algum dos seguintes sintomas
- erupção cutânea
- coceira
- dor das articulações (artralgia), especialmente nos dedos das mãos e dos pés
- febre
- inchaço dos nódulos linfáticos (linfoadenopatias)
- queda da tensão arterial (hipotensão)
- aumento do tamanho do baço (esplenomegalia)
Outros efeitos adversos
Efeitos adversos pouco frequentes (podem afetar até 1 de cada 100 pessoas)
- irritação de garganta, dor de garganta e tos (seca)
- erupção cutânea e coceira (prurito)
- febre (pirexia)
Efeitos adversos com frequência não conhecida (não pode ser estimada a partir dos dados disponíveis)
- dor de cabeça
- inquietude
- formigamento
- sensação de tontura (náuseas)
- vómitos
- erupção cutânea em todo o corpo (urticária)
- arrepios
- reações de hipersensibilidade
- sensação de queimadura e picadura no local da injeção
- letargia
- vermelhidão
- opressão no peito
Os seguintes efeitos adversos foram observados com outros medicamentos do mesmo grupo:sensibilidade reduzida ou anormal (parestesia).
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM.es.
Ao comunicar efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de IMMUNINE
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e na caixa. A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (2°C-8°C). Não congelar.
Conservar o frasco no embalagem exterior para protegê-lo da luz.
Durante o seu período de validade, IMMUNINE pode ser conservado a temperatura ambiente até 25°C durante um período não superior a 3 meses únicamente. Anote no envase do produto o início e o final do período de conservação a temperatura ambiente (até 25°C). IMMUNINE tem que ser utilizado dentro desses três meses. Após o final deste período, IMMUNINE não deve ser refrigerado, mas utilizado imediatamente ou descartado.
Os medicamentos não devem ser jogados nos deságues nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de IMMUNINE
Pó
- O princípio ativo é fator IX humano de coagulação sanguínea. 1 frasco com pó para solução injetável contém 1200 UI de fator IX humano de coagulação. 1 ml de solução contém aproximadamente 120 UI de fator IX humano de coagulação, quando reconstituído com 10 ml de água esterilizada para preparações injetáveis.
- Os outros componentes são cloreto de sódio e citrato de sódio.
Veículo
- Água esterilizada para preparações injetáveis
Aspecto do produto e conteúdo do envase
Immunine é um pó de cor branca ou amarela clara para preparar uma solução injetável. Após a reconstituição com o veículo fornecido (água esterilizada para preparações injetáveis), obtém-se uma solução transparente ou ligeiramente leitosa (opalescente). Se forem observadas partículas ou coloração ou a solução estiver turva, por favor, não utilize o produto e contate o departamento de Serviço ao Cliente da Shire.
Tamanho do envase:1 x 1200 UI
Cada caixa contém:- 1 frasco de IMMUNINE 1200 UI
- 1 frasco com 10 ml de água esterilizada para preparações injetáveis
-1 agulha de trasvasação
-1 agulha de aireação
-1 agulha de filtro
-1 agulha descartável
-1 seringa descartável (10 ml)
- 1 equipamento de perfusão
Titular da autorização de comercializaçãoe responsável pela fabricação:
Titular da autorização de comercialização:
Baxalta Innovations GmbH
Industriestrasse 67
1221 Viena
Áustria
Responsável pela fabricação:
Takeda Manufacturing Austria AG
Industriestrasse, 67
A-1221 Viena, Áustria
Representante local:
Takeda Farmacêutica España S.A.
Calle Albacete, 5 , planta 9ª
Edificio Los Cubos
28027 Madrid
Espanha
Tel: +34 91 790 42 22
Número de autorização de comercialização: 69603
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Áustria, Bulgária, República Checa, Estônia, Alemanha, Letônia, Lituânia, Noruega, Polônia, Portugal, Romênia, Eslováquia, Eslovênia, Espanha, Suécia: Immunine
Itália: Fixnove
Data da última revisão deste prospecto:agosto 2022.
A informação detalhada e atualizada deste medicamento está disponível na página web da Agência Espanhola do Medicamento e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
---------------------------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a profissionais do setor sanitário:
Posologia e forma de administração
O tratamento deve ser iniciado sob a supervisão de um médico com experiência no tratamento da hemofilia.
Posologia
A dose e duração da terapia de substituição dependem da gravidade da deficiência do fator IX, da localização e extensão da hemorragia e do estado clínico do paciente.
O número de unidades de fator IX administradas é expresso em Unidades Internacionais (UI), que se relacionam com o padrão atual da OMS para produtos de fator IX. A atividade do fator IX no plasma é expressa bem como porcentagem (referida a plasma humano normal) ou em Unidades Internacionais (referidas a um padrão internacional de concentrados de fator IX no plasma).
Uma Unidade Internacional (UI) de atividade de fator IX é equivalente à quantidade de fator IX existente em um ml de plasma humano normal.
Tratamento a demanda
O cálculo da dose de fator IX requerida é baseado no achado empírico de que 1 Unidade Internacional (UI) de fator IX por kg de peso corporal incrementa a atividade do fator IX no plasma em um 1,1 % da atividade normal em pacientes de 12 anos e mais.
A dose requerida é determinada utilizando a seguinte fórmula:
UI requeridas = peso corporal (kg) x aumento de fator IX desejado (%)(UI/dl) x 0,9
A quantidade a administrar e a frequência de administração sempre devem ser orientadas pela eficácia clínica em cada caso individual. Os produtos de fator IX raramente precisam ser administrados mais de uma vez ao dia.
Em caso de episódios hemorrágicos, a atividade do fator IX não deve descender abaixo do nível de atividade plasmática dada (em % do normal ou em UI/dl) no período de tempo correspondente.
Em cirurgia e nos episódios hemorrágicos, pode ser utilizada a seguinte tabela como guia de dosificação:
Grau de hemorragia/Tipo de intervenção cirúrgica | Nível de fator IX requerido (% do normal)(UI/dl) | Frequência de dose (horas)/Duração do tratamento (dias) |
Hemorragia | ||
Hemartrose incipiente ou hemorragia muscular ou oral | 20-40 | Repetir cada 24 horas pelo menos 1 dia, até que o episódio hemorrágico, segundo indique a dor, se resolva ou se logre a cura. |
Hemartrose mais extensa, hemorragia muscular ou hematoma | 30–60 | Repetir a perfusão cada 24 horas durante 3-4 dias ou mais, até que cesse a dor e se resolva a incapacidade aguda. |
Hemorragias com risco vital | 60-100 | Repetir a perfusão cada 8-24 horas até superar o perigo. |
Cirurgia | ||
Cirurgia menor incluindo as extrações dentárias | 30-60 | Cada 24 horas, pelo menos durante 1 dia, até a cura. |
Cirurgia maior | 80-100 (pré e pós-operatório) | Repetir a perfusão cada 8-24 horas até a adequada cura da ferida e continuar a terapia pelo menos durante outros 7 dias, para manter uma atividade do fator IX de 30% a 60 % |
Profilaxia
Para a profilaxia de longa duração contra as hemorragias em pacientes com hemofilia B grave, as doses normais são de 20 a 40 UI de fator IX por kg de peso corporal a intervalos de 3 a 4 dias.
Em alguns casos, especialmente nos pacientes mais jovens, podem ser requeridos intervalos de dosificação mais curtos ou doses maiores.
Durante o curso do tratamento, aconselha-se determinar de forma adequada os níveis de fator IX como guia da dose a administrar e da frequência das infusões repetidas. Particularmente, no caso de intervenções de cirurgia maior é indispensável uma exata monitorização da terapia de substituição por meio de análises de coagulação (atividade do fator IX plasmático). A resposta ao fator IX pode variar em cada paciente individualmente, alcançando diferentes níveis de recuperação in vivo e mostrando diferentes vidas médias.
População pediátrica
De acordo com os dados clínicos disponíveis, a recomendação posológica na população pediátrica pode ser realizada em pacientes de 12 a 18 anos de idade. Não há dados clínicos suficientes para fornecer uma recomendação posológica em pacientes entre 6 e 12 anos de idade.
Reações adversas
População especial
O uso de IMMUNINE foi investigado em pacientes pediátricos com hemofilia B. A segurança foi semelhante à dos adultos que utilizam IMMUNINE.
O uso de IMMUNINE foi investigado em dois estudos observacionais em crianças até 6 anos de idade e em pacientes de 0-64 anos de idade com hemofilia B, respectivamente. A segurança em crianças até 6 anos de idade foi semelhante à de crianças maiores de 6 anos de idade e à de adultos que utilizam IMMUNINE.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a IMMUNINE 1200 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL OU PARA PERFUSÃOForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médicaForma farmacêutica: INJETÁVEL, 2.000 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médicaForma farmacêutica: INJETÁVEL, 250 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médica
Alternativas a IMMUNINE 1200 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL OU PARA PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a IMMUNINE 1200 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL OU PARA PERFUSÃO em Polonia
Alternativa a IMMUNINE 1200 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL OU PARA PERFUSÃO em Ucrania
Médicos online para IMMUNINE 1200 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL OU PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de IMMUNINE 1200 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL OU PARA PERFUSÃO – sujeita a avaliação médica e regras locais.














