
IDELVION 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de IDELVION 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como usar IDELVION 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
IDELVION 250 UI, pó e dissolvente para solução injectável
IDELVION 500 UI, pó e dissolvente para solução injectável
IDELVION 1.000 UI, pó e dissolvente para solução injectável
IDELVION 2.000 UI, pó e dissolvente para solução injectável
IDELVION 3.500 UI, pó e dissolvente para solução injectável
albutrepenonacog alfa (factor de coagulação IX recombinante)
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, ainda que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é IDELVION e para que é utilizado
- O que precisa saber antes de começar a usar IDELVION
- Como usar IDELVION
- Possíveis efeitos adversos
- Conservação de IDELVION
- Conteúdo do envase e informações adicionais
1. O que é IDELVION e para que é utilizado
O que é IDELVION?
IDELVION é um medicamento para o tratamento da hemofilia que substitui o factor IX natural de coagulação. O princípio ativo de IDELVION é albutrepenonacog alfa (proteína de fusão recombinante que une o factor IX de coagulação com a albumina [rIX-FP]).
O factor IX intervém na coagulação sanguínea. Os doentes com hemofilia B não têm este factor, o que significa que o sangue não se coagula tão rapidamente como deveria, por isso há uma maior tendência a sangrar. IDELVION actua substituindo o factor IX nos doentes com hemofilia B para fazer com que o seu sangue possa coagular-se.
Para que é utilizado IDELVION?
IDELVION é utilizado para prevenir ou deter o sangramento causado pela falta de suficiente factor IX nos doentes de todas as idades com hemofilia B (também denominada deficiência congénita de factor IXou doença de Christmas).
2. O que precisa saber antes de começar a usar IDELVION
Não use IDELVION
- se é alérgico ao princípio ativo (albutrepenonacog alfa) ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
- se é alérgico às proteínas de hamster.
Advertências e precauções
Recomenda-se encarecidamente que cada vez que utilize IDELVION, registe o nome e o número do lote do produto para realizar um seguimento dos produtos e dos lotes do produto que utilizou.
Rastreabilidade
Com o objectivo de melhorar a rastreabilidade dos medicamentos biológicos, o nome e o número do lote do medicamento administrado devem estar claramente registados.
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar IDELVION.
- É possível que ocorram reacções alérgicas (hipersensibilidade). O produto contém resíduos de proteínas de hámster (ver também "Não use IDELVION"). Se manifestaremsintomas de reacções alérgicas, deve interromper o tratamento imediatamente e contactar o seu médico ou centro de tratamento onde lhe realizam o seguimento. O seu médico deve informá-lo sobre os primeiros sinais das reacções de hipersensibilidade.Estes incluem urticária, erupção cutânea generalizada, pressão no peito, dificuldade para respirar, queda da pressão arterial (hipotensão) e anafilaxia (uma reacção alérgica grave que causa dificuldades respiratórias graves ou mareios).
- Devido ao risco de reacções alérgicas com o factor IX, a administração inicial de IDELVION deve ser realizada sob supervisão médica para garantir o acesso a uma atenção médica adequada em caso de reacções alérgicas.
- A formação de inibidores(anticorpos neutralizantes) é uma complicação conhecida da qual se informou durante o tratamento com IDELVION. Os inibidores impedem que o tratamento funcione corretamente. Se com IDELVION não controlar as suas hemorragias, informe o seu médico imediatamente. Deve ser controlado regularmente por si desenvolver inibidores.
- Se sofre de doença hepática ou cardíaca ou se teve recentemente uma cirurgia maior, por favor informe o seu médico, porque existe um maior risco de complicações de coagulação do sangue.
- Se para a administração de IDELVION for necessário um dispositivo de acesso venoso central (DAVC), o seu médico terá em conta o risco de complicações relacionadas com o DAVC, como infecções locais, bactérias no sangue (bacteriemia) e a formação de um coágulo sanguíneo nos vasos sanguíneos (trombose) no local de inserção do catéter.
Uso de IDELVION com outros medicamentos
- Informa o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Gravidez e amamentação
- Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
- Durante a gravidez e o período de amamentação, IDELVION só deve ser administrado se for claramente necessário.
Condução e uso de máquinas
IDELVION não afecta a sua capacidade para conduzir ou usar máquinas.
IDELVION contém sódio
Este medicamento contém até 8,6 mg de sódio (componente principal do sal de cozinha) em cada frasco. Isto equivale a 0,4% da ingestão diária máxima de sódio recomendada para um adulto.
3. Como usar IDELVION
O seu tratamento deve ser iniciado e supervisionado por um médico com experiência no tratamento de distúrbios de coagulação do sangue. Siga exactamente as instruções do seu médico para o uso deste medicamento. Consulte com o seu médico se tiver dúvidas.
O seu médico calculará a dose de IDELVION que precisa. A quantidade de IDELVION que precisa e a duração do tratamento dependem:
- da gravidade da sua doença
- do local e da intensidade da hemorragia
- do seu estado clínico e da sua resposta clínica
- do seu peso corporal
IDELVION é administrado como uma injeção numa veia (intravenosa, IV) após a reconstituição do pó com o dissolvente fornecido pelo seu médico ou enfermeiro. O senhor ou outra pessoa também poderia administrar IDELVION como uma injeção intravenosa, mas apenas após receber a formação adequada.
Se usar mais IDELVION do que deve
Entre em contacto imediatamente com o seu médico se se injectar mais IDELVION do que o recomendado pelo seu médico.
Se interromper o tratamento com IDELVION
Não deixe de usar IDELVION sem consultar antes o seu médico.
Reconstituição e administração
Instruções gerais
- O pó deve ser misturado com o dissolvente (líquido) e extraído do frasco mantendo o medicamento estéril (livre de germes). O seu médico mostrar-lhe-á como preparar a solução e como extrair a solução do frasco corretamente.
- IDELVION não deve ser misturado com outros medicamentos, dissolventes, excepto os mencionados na secção 6.
- A solução deve ser transparente ou ligeiramente opalescente, entre amarela e incolor, isto é, pode brilhar quando exposta à luz mas não deve conter qualquer partícula visível. Após a extração ou filtração da solução (ver mais adiante) deve ser revista visualmente antes do seu uso. Não utilize a solução se estiver turva ou se contiver flóculos ou partículas.
- A eliminação do produto não utilizado e de todos os materiais residuais será realizada de acordo com a regulamentação local e as instruções do seu médico.
Reconstituição
Sem abrir nenhum dos frascos, aqueça o pó de IDELVION e o líquido até que estejam à temperatura ambiente ou corporal. Isto pode ser feito deixando os frascos à temperatura ambiente durante uma hora aproximadamente ou segurando-os com as mãos durante alguns minutos.
NÃO exponha os frascos ao calor directo. Os frascos não devem ser aquecidos acima da temperatura corporal (37 ºC).
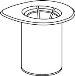
Retire com cuidado as cápsulas protectoras dos frascos e, a seguir, limpe a parte exposta dos tampões de borracha com um pano impregnado de álcool. Deixe secar os frascos antes de abrir o envase do Mix2Vial (que contém o trasvasador com filtro) e, a seguir, siga as instruções que se indicam a seguir.
|
|
|
|
|
|
|
|
|
Elimine o frasco do dissolvente com o adaptador do Mix2Vial azul acoplado. |
|
|
|
|
Transvasamento e administração
|
|
9 |
|
Utilize o kit de venopunção fornecido com o produto e insira a agulha numa veia. Deixe que o sangue flua até ao fim do tubo. Ligue a seringa ao extremo de bloqueio rosqueado do kit de venopunção. Injete lentamente a solução reconstituída (a uma velocidade que lhe resulteconfortável, até um máximo de 5 ml/min) na veiade acordo com as instruções que lhe deu o seu médico. Tente que não entre sangue na seringa que contém o produto.
Verifique se experimenta efeitos adversos logo após a injeção. Se experimentar algum efeito adverso que possa estar relacionado com a administração de IDELVION, a injeção deve ser interrompida (ver também as secções 2 e 4).
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Entre em contacto com o seu médico:
- se notar sintomas de reacções alérgicas (ver a seguir);
- se notar que o medicamento deixou de funcionar corretamente.
Foram observados os seguintes efeitos adversos com os medicamentos com factor IX:
- É possível que ocorram reacções de hipersensibilidade de tipo alérgico (frequente) que incluem os sintomas seguintes: eritema, comichão na pele (urticária generalizada), pressão no peito, dificuldade para respirar, pressão sanguínea baixa (hipotensão) e anafilaxia (uma reacção grave que causa uma grave dificuldade para respirar e mareios). Se isto acontecer, deve interromper a administração do medicamento imediatamente e entrar em contacto com o seu médico.
- Inibidores: o medicamento deixou de funcionar corretamente (sangramento contínuo). Pode desenvolver um inibidor (anticorpo neutralizante) do factor IX (frequência desconhecida), o que significa que o factor IX já não funcionará corretamente. Se isto acontecer, deve interromper a administração do medicamento imediatamente e entrar em contacto com o seu médico.
Foram observados os seguintes efeitos adversos com IDELVION (podem afectar até 1 de cada 10 pessoas):
- Dor de cabeça
- Reacções na zona de injeção
- Mareio
- Erupção cutânea
Foram observados os seguintes efeitos adversos com IDELVION (podem afectar até 1 de cada 100 pessoas):
- Eczema
Efeitos adversos em crianças e adolescentes
É esperado que os efeitos adversos em crianças sejam os mesmos que em adultos.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de IDELVION
- Mantenha este medicamento fora da vista e do alcance das crianças.
- Não utilize este medicamento após a data de validade que aparece na etiqueta e na caixa.
- Não conserve a uma temperatura superior a 25 ºC.
- Não congele.
- Conserva o frasco dentro da sua caixa para protegê-lo da luz.
- Uma vez reconstituído o produto, deve ser utilizado preferentemente de imediato.
Se o produto reconstituído não for administrado imediatamente, os tempos e as condições de conservação antes do seu uso são da responsabilidade do utilizador.
6. Conteúdo do envase e informação adicional
Composição de IDELVION
O princípio ativo é:
250 UI por frasco; após a reconstituição com 2,5 ml de água para preparações injetáveis, a solução contém 100 UI/ml de albutrepenonacog alfa.
500 UI por frasco; após a reconstituição com 2,5 ml de água para preparações injetáveis, a solução contém 200 UI/ml de albutrepenonacog alfa.
1.000 UI por frasco; após a reconstituição com 2,5 ml de água para preparações injetáveis, a solução contém 400 UI/ml de albutrepenonacog alfa.
2.000 UI por frasco; após a reconstituição com 5 ml de água para preparações injetáveis, a solução contém 400 UI/ml de albutrepenonacog alfa.
3.500 UI por frasco; após a reconstituição com 5 ml de água para preparações injetáveis, a solução contém 700 UI/ml de albutrepenonacog alfa.
Os outros componentes são:
Citrato sódico, polissorbato 80, manitol, sacarose e ácido clorídrico (para o ajuste do pH).
Ver o último parágrafo da seção 2.
Dissolvente: água para preparações injetáveis
Aspecto de IDELVION e conteúdo do envase
IDELVION é apresentado como um pó entre amarelo e branco e é fornecido com um dissolvente na forma de água para preparações injetáveis.
A solução reconstituída deve ser transparente ou ligeiramente opalescente, entre amarela e incolor, ou seja, pode brilhar quando exposta à luz, mas não deve conter nenhuma partícula visível.
Apresentações
Um envase com 250, 500 ou 1.000 UI que contém:
1 frasco com pó
1 frasco com 2,5 ml de água para preparações injetáveis
1 transferidor com filtro 20/20
Equipamento de administração (caixa interior):
1 seringa de 5 ml descartável
1 equipamento de venopunção
2 compressas impregnadas de álcool
1 curativo não estéril
Um envase com 2.000 ou 3.500 UI que contém:
1 frasco com pó
1 frasco com 5 ml de água para preparações injetáveis
1 transferidor com filtro 20/20
Equipamento de administração (caixa interior):
1 seringa de 10 ml descartável
1 equipamento de venopunção
2 compressas impregnadas de álcool
1 curativo não estéril
Pode ser que apenas alguns tamanhos de envase sejam comercializados.
Título da autorização de comercialização e responsável pela fabricação
CSL Behring GmbH
Emil-von-Behring-Straße 76
35041 Marburg
Alemanha
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica CSL Behring NV Tel: +32 15 28 89 20 | Lituânia CentralPharma Communications UAB Tel: +370 5 243 0444 |
| Luxemburgo CSL Behring NV Tel: +32 15 28 89 20 |
República Tcheca CSL Behring s.r.o. Tel: + 420 702 137 233 | Hungria CSL Behring Kft. Tel: +36 1 213 4290 |
Dinamarca CSL Behring AB Tlf: +46 8 544 966 70 | Malta AM Mangion Ltd. Tel: +356 2397 6333 |
Alemanha CSL Behring GmbH Tel: +49 6190 75 84810 | Países Baixos CSL Behring BV Tel: + 31 85 111 96 00 |
Estônia CentralPharma Communications OÜ Tel: +3726015540 | Noruega CSL Behring AB Tlf: +46 8 544 966 70 |
Grécia CSL Behring ΕΠΕ Τηλ: +30 210 7255 660 | Áustria CSL Behring GmbH Tel: +43 1 80101 1040 |
Espanha CSL Behring S.A. Tel: +34 933 67 1870 | Polônia CSL Behring Sp.z o.o. Tel: +48 22 213 22 65 |
França CSL Behring S.A. Tél: + 33 –(0)-1 53 58 54 00 | Portugal CSL Behring Lda Tel: +351 21 782 62 30 |
Croácia Marti Farm d.o.o. Tel: +385 1 5588297 | Romênia Prisum Healthcare S.R.L. Tel: +40 21 322 0171 |
Irlanda CSL Behring GmbH Tel: +49 6190 75 84700 Islândia CSL Behring AB Sími: +46 8 544 966 70 | Eslovênia Emmes Biopharma Global s.r.o. podružnica v Sloveniji Tel: + 386 41 42 0002 Eslováquia CSL Behring Slovakia s.r.o. Tel: +421 911 653 862 |
Itália CSL Behring S.p.A. Tel: +39 02 34964 200 | Finlândia CSL Behring AB Puh/Tel: +46 8 544 966 70 |
Chipre CSL Behring ΕΠΕ Τηλ: +30 210 7255 660 | Suécia CSL Behring AB Tel: +46 8 544 966 70 |
Letônia CentralPharma Communications SIA Tel: +371 6 7450497 | |
Data da última revisão deste prospecto
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu, e no site da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es/).
---------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do setor sanitário:
Posologia
A dose e a duração do tratamento de substituição dependem da gravidade da deficiência de fator IX, da localização e gravidade da hemorragia e do estado clínico do paciente.
O número de unidades de fator IX administradas é expresso em Unidades Internacionais (UI), em relação ao padrão atual da OMS para produtos que contêm fator IX. A atividade plasmática do fator IX é expressa como um percentual (em relação ao plasma humano normal) ou em Unidades Internacionais (em relação a um padrão internacional para o fator IX plasmático).
Uma Unidade Internacional (UI) de atividade do fator IX equivale à quantidade de fator IX presente em 1 ml de plasma humano normal.
Tratamento a demanda
O cálculo da dose necessária de fator IX baseia-se no achado empírico de que 1 UI de fator IX por kg de peso corporal aumenta a atividade do fator IX plasmático em 1,3 UI/dl de média (1,3% da atividade normal) em pacientes ≥ 12 anos e em 1,0 UI/dl (1,0% da atividade normal) em pacientes <12 anos. a dose necessária é determinada mediante fórmula seguinte:< p>
Dose necessária (UI) = peso corporal (kg) x aumento desejado do fator IX (% do nível normal ou UI/dl) x {recuperação recíproca observada (UI/kg por UI/dl)}
Aumento previsto do fator IX (UI/dl ou % do nível normal) = dose (UI) x recuperação (UI/dl por UI/kg)/peso corporal (kg)
A dose e a frequência de administração devem ser estabelecidas sempre com base na eficácia clínica observada em cada caso.
Pacientes <12 anos de idade< em>
Em caso de uma recuperação incremental de 1 UI/dl por 1 UI/kg, a dose é calculada da seguinte maneira:
Dose necessária (UI) = peso corporal (kg) x aumento desejado do fator IX (UI/dl) x 1 dl/kg
Exemplo:
- É necessário um nível máximo de 50% do nível normal em um paciente de 20 kg com hemofilia B grave. A dose adequada seria de 20 kg x 50 UI/dl x 1 dl/kg = 1.000 UI.
- Deve-se esperar que uma dose de 1.000 UI de IDELVION, administrada a um paciente de 25 kg, cause um aumento máximo do fator IX após a injeção de 1.000 UI/25 kg x 1,0 (UI/dl por UI/kg) = 40 UI/dl (40% do nível normal).
Pacientes ≥ 12 anos de idade
Em caso de uma recuperação incremental de 1,3 UI/dl por 1 UI/kg, a dose é calculada da seguinte maneira:
Dose necessária (UI) = peso corporal (kg) x aumento desejado do fator IX (UI/dl) x 0,77 dl/kg
Exemplo:
- É necessário um nível máximo de 50% do nível normal em um paciente de 80 kg com hemofilia B grave. A dose adequada seria de 80 kg x 50 UI/dl x 0,77 dl/kg = 3.080 UI.
- Deve-se esperar que uma dose de 2.000 UI de IDELVION, administrada a um paciente de 80 kg, cause um aumento máximo do fator IX após a injeção de 2.000 UI x 1,3 (UI/dl por UI/kg)/80 kg = 32,5 UI/dl (32,5% do nível normal).
No caso dos eventos hemorrágicos seguintes, a atividade do fator IX não deve ser inferior ao nível de atividade plasmática estabelecido (em % do nível normal ou em UI/dl) durante o período correspondente. A tabela seguinte pode ser usada como guia posológica em episódios hemorrágicos e cirurgia:
Grau de hemorragia/ tipo de procedimento cirúrgico | Nível de fator IX requerido (% ou UI/dl) | Frequência de dosificação (horas)/duração do tratamento (dias) |
Hemorragia Henartrose leve ou moderada, sangramento muscular (exceto no iliopsoas) ou sangramento da cavidade oral | 30-60 | Uma dose única deve ser suficiente na maioria das hemorragias. Deve-se administrar uma dose de manutenção após 24 - 72 horas se houver evidência adicional de hemorragia. |
Hemorragia maior Hemorragias potencialmente mortais, sangramento muscular profundo, incluído o iliopsoas | 60-100 | Deve-se repetir a cada 24 - 72 horas durante a primeira semana e, após, administrar uma dose de manutenção semanal até que a hemorragia pare e a ferida cicatrize. |
Cirurgia menor Por exemplo, (incluindo extrações dentárias não complicadas) | 50-80 (pré- e pós-operatório) | Uma dose única deve ser suficiente na maioria das intervenções menores. Se necessário, pode-se administrar uma dose de manutenção após 24 - 72 horas até que a hemorragia pare e a ferida cicatrize. |
Cirurgia maior | 60-100 (pré- e pós-operatório) | Deve-se repetir a cada 24 - 72 horas durante a primeira semana e, após, administrar uma dose de manutenção 1 - 2 vezes por semana até que a hemorragia pare e a ferida cicatrize. |
Tratamento profilático
Para a profilaxia a longo prazo para prevenir o sangramento em pacientes com hemofilia B grave, a dose habitual é de 35 a 50 UI/kg uma vez por semana. Pacientes bem controlados com um regime de uma vez por semana podem ser tratados com até 75 UI/kg a cada 10 ou 14 dias. Em pacientes > 18 anos, pode-se considerar uma maior extensão do intervalo de tratamento.
Em alguns casos, especialmente em pacientes jovens, pode ser necessário encurtar os intervalos de administração ou usar doses mais elevadas.
Após um episódio de sangramento durante a profilaxia, os pacientes devem manter seu regime de profilaxia na maior medida possível, com a administração de 2 doses de IDELVION com 24 horas de diferença no mínimo, mas mais tempo quando se considerar apropriado para o paciente.
População pediátrica
No tratamento profilático a longo prazo, a posologia recomendada é de 35 a 50 UI/kg uma vez por semana. Para os adolescentes de 12 anos ou mais, as recomendações de dose são as mesmas que para os adultos (ver acima).
Advertências e precauções especiais de emprego
Inibidores
Após o tratamento repetido com produtos com fator IX de coagulação humano, deve-se realizar um acompanhamento dos pacientes para detectar a presença de anticorpos neutralizantes (inibidores) que se devem quantificar em Unidades Bethesda (UB) mediante testes biológicos adequados.
Na bibliografia, foram notificados casos que demonstram uma correlação entre a aparência de um inibidor do fator IX e reações alérgicas. Portanto, os pacientes que experimentam reações alérgicas devem ser avaliados para detectar a presença de um inibidor. Deve-se ter em conta que é possível que os pacientes com inibidores do fator IX apresentem um maior risco de anafilaxia, com a exposição posterior ao fator IX.
Acompanhamento do tratamento
Durante o tratamento, recomenda-se controlar adequadamente os níveis de fator IX para determinar a dose que se deve administrar e a frequência das perfusões. As respostas dos pacientes ao fator IX podem variar, o que demonstra que possuem diferentes meias-vidas e recuperações. Pode ser que a dose baseada no peso corporal precise ser ajustada em pacientes com peso insuficiente ou sobrepeso. No caso especial das intervenções de cirurgia maior, é indispensável controlar com precisão o tratamento de substituição mediante testes de coagulação (atividade do fator IX plasmático).
Ao utilizar um ensaio de coagulação de uma etapa baseado no tempo de tromboplastina parcial ativada (TTPa) in vitropara determinar a atividade do fator IX nas amostras de sangue dos pacientes, os resultados da atividade do fator IX plasmático podem ser significativamente afetados pelo reagente de TTP e pelo padrão de referência utilizado no ensaio. É provável que a medição realizada com um ensaio de coagulação de uma etapa utilizando o reagente de TTPa baseado em caolim ou o reagente de TTPa com Actin FS resulte em uma subestimação do nível de atividade. Isso é especialmente importante quando se muda o laboratório ou os reagentes utilizados no ensaio.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a IDELVION 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médicaForma farmacêutica: INJETÁVEL, 2.000 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médicaForma farmacêutica: INJETÁVEL, 250 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médica
Alternativas a IDELVION 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a IDELVION 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Polónia
Alternativa a IDELVION 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para IDELVION 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de IDELVION 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.




 1
1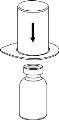 2
2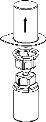 3
3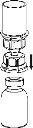 4
4 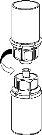 5
5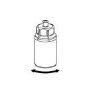 6
6 7
7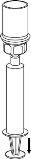 8
8










