FYDRANE 0,2 mg/mL + 3,1 mg/mL + 10 mg/mL Solução Injectável

Pergunte a um médico sobre a prescrição de FYDRANE 0,2 mg/mL + 3,1 mg/mL + 10 mg/mL Solução Injectável

Como usar FYDRANE 0,2 mg/mL + 3,1 mg/mL + 10 mg/mL Solução Injectável
Introdução
Prospecto: informação para o utilizador
FYDRANE0,2 mg/ml +3,1 mg/ml +10 mg/ml, solução injetável
tropicamida /fenilefrina hidrocloruro / lidocaína hidrocloruro monohidrato
Leia todo o prospecto detenidamente antes de começar a usar o medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é FYDRANE e para que é utilizado
- O que necessita saber antes de começar a usar FYDRANE
- Como usar FYDRANE
- Possíveis efeitos adversos
- Conservação de FYDRANE
- Conteúdo do envase e informação adicional
1. O que é FYDRANE e para que é utilizado
O que é FYDRANE
Este medicamento é uma solução para injetar no olho.
Contém três princípios ativos:
- Tropicamida que pertence ao grupo de medicamentos que bloqueiam o passo dos impulsos através dos nervos (conhecidos como anticolinérgicos),
- Fenilefrina (como fenilefrina hidrocloruro) que pertence a um grupo de medicamentos que mimetizam os efeitos dos impulsos transmitidos através de determinados nervos (que pertencem aos alfa-simpaticomiméticos),
- Lidocaína (como lidocaína hidrocloruro monohidrato) que pertence a um grupo de medicamentos chamados anestésicos locais de tipo amida.
Para que é utilizado
Este medicamento é utilizado apenas em adultos.
Será administrado pelo seu cirurgião oftalmologista mediante uma injeção no olho no início da cirurgia de cataratas (opacidade do cristalino) para dilatar a pupila do seu olho (midríase) e obter anestesia no seu olho durante o procedimento cirúrgico.
2. O que necessita saber antes de começar a usar FYDRANE
Não lhe deve ser administrado FYDRANE:
- se é alérgico à tropicamida, fenilefrina hidrocloruro e/ou lidocaína hidrocloruro monohidrato ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6),
- se é alérgico a anestésicos de tipo amida (como articaina, bupivacaína, mepivacaína, prilocaina, ropivacaína),
- se é alérgico a derivados da atropina.
Advertências e precauções
FYDRANE não é recomendado:
- em cirurgia de cataratas combinada com certo tipo de cirurgia do olho (vitrectomia),
- se a parte anterior (câmara anterior) do seu olho é pouco profunda,
- se sofreu alguma vez um aumento agudo da pressão ocular (glaucoma agudo de ângulo fechado).
Consulte com o seu médico se tem:
- pressão arterial elevada (hipertensão)
- engrossamento das paredes arteriais (aterosclerose)
- qualquer doença cardíaca e, particularmente, se esta afeta a frequência cardíaca,
- uma contraindicação a medicamentos que aumentam a pressão arterial (aminas vasopressoras: epinefrina, norepinefrina, dopamina, dobutamina) por via sistémica,
- glândula tireoide hiperativa (hipertireoidismo),
- distúrbios da glândula prostática,
- convulsões (epilepsia),
- qualquer doença do fígado ou problemas de rim,
- qualquer problema respiratório,
- perda de função muscular e fraqueza (miastenia gravis).
Uso de FYDRANE com outros medicamentos
Comunique ao seu médico ou farmacêutico se está utilizando, utilizou recentemente ou poderia ter que utilizar qualquer outro medicamento.
Gravidez, lactação e fertilidade
Este medicamento não deve ser utilizado:
- durante a gravidez
- durante a lactação
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Condução e uso de máquinas
FYDRANE tem uma influência moderada sobre a capacidade de conduzir e utilizar máquinas. Por conseguinte, não deve conduzir e/ou utilizar máquinas até que a sua visão seja normal.
FYDRANE contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose; isto é, essencialmente “isento de sódio”.
3. Como usar FYDRANE
Só deve ser administrado este medicamento se já demonstrou, em uma avaliação pré-operatória, uma dilatação pupilar satisfatória com um midriático tópico.
Dose e método de administração
- FYDRANE solução para injeção deve ser administrado por um cirurgião oftalmologista, com anestesia local, no início da cirurgia de cataratas.
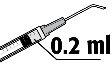
- A dose recomendada é de 0,2 ml de solução em uma única injeção. Não devem ser injetadas doses adicionais, pois não se demonstraram efeitos acumulativos e devido a que se observou um aumento na perda de células endoteliais (células da camada que recobre a superfície posterior da córnea).
- A mesma dose é utilizada em adultos e em pessoas de idade avançada.
Se lhe administrarem demasiada quantidade, ou demasiada pouca, FYDRANE:
A sua medicação será administrada por um cirurgião oftalmologista. É improvável que lhe administrem uma sobredose. Uma sobredose pode causar perda de células endoteliais da córnea (células de uma camada que cobre a superfície posterior da córnea).
Se tiver alguma outra dúvida sobre o uso deste produto, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode ter efeitos adversos, embora nem todas as pessoas os sofram.
As complicações conhecidas mais graves ocorrem durante ou após a cirurgia de cataratas:
Pouco frequentes: podem afetar até 1 de cada 100 pessoas
- Lesão na lente (rotura da cápsula posterior),
- Inflamação da retina (edema macular cistoide).
Por favor, solicite atenção médica urgente nestes casos.
Outros efeitos adversos:
Pouco frequentes: podem afetar até 1 de cada 100 pessoas
- Dor de cabeça,
- Inflamação da córnea (queratite), aumento da pressão no olho, vermelhidão do olho (hiperemia ocular),
- Pressão arterial elevada (hipertensão).
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de FYDRANE
Mantenha fora da vista e do alcance das crianças.
Não use este medicamento após a data de validade que aparece na caixa, blíster e ampola após “CAD.”. A data de validade é o último dia do mês que se indica.
Este medicamento não requer condições especiais de conservação.
Para o uso em um único olho. Este medicamento deve ser utilizado imediatamente após abrir a ampola.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição deFYDRANE
- Os princípios ativos são tropicamida 0,04 mg, fenilefrina hidrocloruro 0,62 mg e lidocaína hidrocloruro monohidrato 2 mg por cada dose de 0,2 ml, equivalente a 0,2 mg de tropicamida, 3,1 mg de fenilefrina hidrocloruro e 10 mg de lidocaína hidrocloruro monohidrato para 1 ml.
- Os outros componentes são: cloreto de sódio, fosfato disódico dodecahidrato, fosfato disódico dihidrato, edetato de disódio e água para preparações injetáveis.
Aspecto do produto e tamanho do envase
FYDRANE é uma solução para injeção transparente, de cor amarela a ligeiramente pardacenta e praticamente livre de partículas visíveis, envasado em uma ampola de vidro topázio de 1 ml. Cada ampola estéril contém 0,6 ml da solução para injeção e é apresentada sozinha ou junto com uma agulha com filtro estéril de 5 micras em um blíster selado de papel/PVC.
Cada envase contém 1, 20 ou 100 ampolas estéreis (com uma agulha com filtro estéril de 5 micrómetros). A agulha com filtro de 5 micras deve ser utilizada apenas para extrair o conteúdo do frasco.
Todos os componentes são para um único uso.
Nem todos os tamanhos de envase podem estar comercializados.
Titular da autorização de comercialização
LABORATOIRES THEA
RUE LOUIS BLÉRIOT, 12
F-63017 CLERMONT-FERRAND CEDEX 2
FRANÇA
Responsável pela fabricação
DELPHARM TOURS
RUE PAUL LANGEVIN
37170 CHAMBRAY LES TOURS
FRANÇA
O
LABORATOIRES THEA
RUE LOUIS BLÉRIOT, 12
F-63017 CLERMONT-FERRAND CEDEX 2
FRANÇA
Representante local:
LABORATORIOS THEA, S.A.
C/ Enric Granados, nº 86-88, 2ª planta
08008 Barcelona
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Áustria, Bélgica, Bulgária, Chipre, Croácia, República Checa, Dinamarca, Finlândia, França, Alemanha, Grécia, Islândia, Itália, Luxemburgo, Holanda, Polónia, Portugal, Roménia, República Eslovaca, Eslovénia, Suécia, Reino Unido………………………………………….……….Mydrane
Irlanda,Espanha………………………………………………………………………………….Fydrane
Noruega……………………………………………………………........................................Mydane
Data da última revisão deste prospecto: Setembro 2023
A informação detalhada e actualizada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS): http://www.aemps.es/
Esta informação está destinada apenas a profissionais do sector sanitário:
Incompatibilidades
Na literatura não se têm notificado incompatibilidades dos princípios ativos com a maioria dos produtos utilizados na cirurgia de cataratas, e tampouco durante os ensaios clínicos. Para os viscoelásticos habituais, isto também foi confirmado por provas de interação farmacológica.
Advertências
Não utilizar se o blíster está danificado ou roto. Abrir apenas em condições de assepsia. A esterilidade do conteúdo do blíster está garantida.
Como preparar e administrar FYDRANE
Uso único da solução para um olho por via intracameral apenas.
FYDRANE deve ser administrado mediante injeção intraocular na câmara anterior do olho (injeção intracameral), por um cirurgião oftalmologista, em condições assépticas recomendadas para a cirurgia de cataratas.
Antes da injeção intracameral, a solução deve ser visualmente inspecionada e apenas deve ser utilizada se for uma solução transparente com um ligeiro cor amarelo a ligeiramente pardacento e praticamente livre de partículas visíveis.
A dose recomendada é de 0, 2 ml de FYDRANE; não se deve injetar uma dose adicional, pois não se demonstraram efeitos acumulativos significativos e porque se observou um aumento da perda de células do endotélio.
O produto deve ser utilizado imediatamente após abrir a ampola e não deve ser reutilizado para o outro olho ou para qualquer outro paciente.
Apenas para a apresentação em kit (ou seja, blíster que contém uma ampola e uma agulha): colar a etiqueta desprendível do blíster na história do paciente.
Para preparar FYDRANEpara a administração intracameral, siga por favor as seguintes instruções: | |
|
|
Depois do seu uso, eliminar adequadamente a solução restante. Não deve ser conservada para um uso posterior. |
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contacto com ele será realizada de acordo com a normativa local. Descartar as agulhas utilizadas em um contentor para materiais pontiagudos.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FYDRANE 0,2 mg/mL + 3,1 mg/mL + 10 mg/mL Solução InjectávelForma farmacêutica: IMPLANTE OFTÁLMICO, 5,376mg Cloridrato de Fenilefrina/0,28mg TropicamidaSubstância ativa: tropicamide, combinationsFabricante: Laboratoires TheaRequer receita médicaForma farmacêutica: COLÍRIO, -Substância ativa: atropineFabricante: Alcon Healthcare S.A.Requer receita médicaForma farmacêutica: COLÍRIO, 5 mgSubstância ativa: atropineFabricante: Alcon Healthcare S.A.Requer receita médica
Alternativas a FYDRANE 0,2 mg/mL + 3,1 mg/mL + 10 mg/mL Solução Injectável noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a FYDRANE 0,2 mg/mL + 3,1 mg/mL + 10 mg/mL Solução Injectável em Polónia
Alternativa a FYDRANE 0,2 mg/mL + 3,1 mg/mL + 10 mg/mL Solução Injectável em Ukraine
Médicos online para FYDRANE 0,2 mg/mL + 3,1 mg/mL + 10 mg/mL Solução Injectável
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de FYDRANE 0,2 mg/mL + 3,1 mg/mL + 10 mg/mL Solução Injectável – sujeita a avaliação médica e regras locais.