FOSTIPUR KIT 225 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL


Como usar FOSTIPUR KIT 225 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Fostipur Kit225 UIpó e solvente para solução injetável
Urofolitropina
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Fostipur Kit e para que é utilizado
- O que precisa saber antes de começar a usar Fostipur Kit
- Como usar Fostipur Kit
- Possíveis efeitos adversos
- Conservação de Fostipur Kit
- Conteúdo do envase e informação adicional
1. O que é Fostipur Kit e para que é utilizado
- Fostipur Kit é utilizado para estimular a ovulação em mulheres que não ovulam e que não
respondem a outros tratamentos (citrato de clomifeno).
- Na indução do desenvolvimento multifolicular (e, por conseguinte, de vários óvulos) em
mulheres submetidas a tratamentos de fertilidade.
A urofolitropina é uma hormona foliculostimulante altamente purificada que pertence a um grupo de medicamentos chamados gonadotropinas.
Este medicamento deve ser utilizado sob controlo do seu médico.
2. O que precisa saber antes de começar a usar Fostipur Kit
Antes de iniciar o tratamento, deve ser avaliada a fertilidade do casal.
Não use Fostipur Kit
- Se é alérgica à urofolitropina ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6).
- Aumento do tamanho dos ovários ou quistes no ovário sem ser consequência de um
trastorno hormonal (síndrome do ovário poliquístico).
- Hemorragia de origem desconhecida.
- Cancro dos ovários, útero ou mama.
- Inchaço anormal (tumor) da glândula hipofisária ou hipotálamo (no cérebro).
Não deve utilizar este medicamento em caso de que tenha distúrbios como menopausa prematura, malformação dos órgãos sexuais ou tumores próprios da matriz que lhe impeçam ter um embarazo normal.
Advertências e precauções
Embora não se disponha de informação sobre reações alérgicas com Fostipur Kit, deve comunicar ao seu médico se tem alguma reação alérgica a medicamentos semelhantes.
Este tratamento aumenta o risco de desenvolver uma doença conhecida como síndrome de hiperestimulação ovárica (SHO) (ver Possíveis efeitos adversos). Se se produzir hiperestimulação ovárica, deve interromper o tratamento e evitará ficar grávida. Os primeiros sinais da hiperestimulação ovárica são dor na região baixa do abdômen, bem como náuseas (malestar) vómitos e aumento de peso. Se aparecerem estes sintomas, deve ser examinada pelo seu médico o mais breve possível. Em casos graves, embora raros, os ovários podem aumentar de tamanho e pode acumular-se líquido no abdômen ou peito.
O medicamento utilizado para lograr a libertação final dos óvulos maduros (que contém a gonadotrofina coriónica humana, hCG) pode aumentar a probabilidade de padecer SHO. Por conseguinte, não é aconselhável utilizar hCG nos casos em que se está a desenvolver uma hiperestimulação ovárica e também não deve manter relações sexuais, mesmo utilizando métodos anticonceptivos de barreira, durante um mínimo de 4 dias.
Deve ter-se em conta que as mulheres com problemas de fertilidade têm um índice de abortos espontâneos superior ao da população normal.
A ocorrência de embarazos múltiplos e nascimentos em pacientes que recebem tratamento de indução à ovulação aumenta se comparada com a concepção natural. No entanto, este risco pode ser reduzido se for utilizada a dose recomendada.
Existe um ligeiro aumento do risco de embarazo ectópico (embarazo fora do útero) em mulheres com as trompas de Falópio danificadas.
Os embarazos múltiplos e as características dos pais submetidos a tratamentos de fertilidade (por exemplo, idade da mãe, características do esperma) podem estar associados a um maior risco de anomalias no nascimento.
O tratamento com Fostipur Kit, assim como o próprio embarazo, pode aumentar o risco de padecer trombose. A trombose é a formação de um coágulo de sangue num vaso sanguíneo, a maior parte das vezes nas veias das pernas ou nos pulmões.
Consulte-o com o seu médico, antes de iniciar o tratamento, especialmente:
- se já sabe que tem um risco maior de padecer trombose;
- se já sofreu ou um familiar próximo sofreu trombose;
- se tem um sobrepeso excessivo.
Este medicamento é preparado com urina de origem humana. O risco de transmissão de infecção ou doença para o organismo não pode ser eliminado por completo. No entanto, este risco fica limitado pelas fases de eliminação de vírus no processo de fabricação, particularmente SIDA, Herpes viruse Papillomavirus.
Não foram publicados casos de contaminação viral.
Uso de Fostipur Kit com outros medicamentos
Informa ao seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Embarazo e lactação
Fostipur Kit não deve ser utilizado se está grávida ou em período de amamentação.
Fostipur Kit contém sódio
Este medicamento contém menos de 1mmol de sódio (23 mg) por dose, isto é, é essencialmente “isento de sódio”.
3. Como usar Fostipur Kit
Dose e duração do tratamento:
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
Mulheres que não ovulam e têm menstruações irregulares ou incompletas:
Se você tiver a menstruação, o tratamento deve ser iniciado dentro dos 7 dias que seguem o início da menstruação (os primeiros 7 dias do ciclo menstrual).
A dose consiste em 1 injeção por dia, sob a pele (por via subcutânea).
A dose inicial comum é de 75 UI até 150 UI de FSH (Fostipur Kit) por dia. Esta dose pode ser aumentada se necessário, de 37,5 até 75 UI em intervalos de 7 dias ou, preferencialmente, 14 dias, para obter uma resposta adequada.
A dose máxima diária de FSH não deve exceder geralmente 225 UI.
Se o seu médico não encontrar uma resposta adequada após 4 semanas de tratamento, este ciclo de tratamento deve ser interrompido. Para o próximo ciclo, o seu médico indicará um tratamento com uma dose inicial mais alta.
Quando se obtém uma boa resposta (crescimento folicular satisfatório), será administrada apenas uma injeção de outro medicamento (hCG), utilizado para induzir a maturação folicular e a liberação dos ovócitos. Isso ocorrerá 24 a 48 horas após a última injeção de Fostipur Kit. Recomenda-se ter relações sexuais no mesmo dia da administração de hCG e no dia seguinte.
Se se obtém uma resposta ovárica excessiva, o tratamento deve ser interrompido e não se administrará hCG (ver Efeitos adversos possíveis). Para o próximo ciclo, o seu médico indicará uma dose inicial mais baixa.
Mulheres submetidas a estimulação ovárica por desenvolvimento folicular múltiplo prévio à fertilizaçãoin vitroou outras técnicas de reprodução assistida:
Situação 1 – Se você tiver a menstruação
O tratamento deve ser iniciado 2 ou 3 dias após o início da menstruação (os primeiros 2 ou 3 dias do ciclo menstrual).
A dose consiste em 1 injeção por dia por via subcutânea.
Uma dose habitualmente utilizada de superovulação consiste na administração de 150 a 225 UI de Fostipur Kit por dia. O tratamento prossegue, com o ajuste da dose de acordo com a resposta, até alcançar um desenvolvimento folicular adequado. Isso é geralmente alcançado no 10º dia de tratamento (média de 5 a 20 dias) e é avaliado por meio da coleta de amostras de sangue e/ou exames ecográficos.
A dose máxima é, em geral, de 450 UI/dia.
Uma vez alcançado o desenvolvimento folicular, será administrada uma única injeção de um medicamento utilizado para induzir a maturação folicular final; este medicamento contém até 10.000 UI de gonadotropina coriônica humana (hCG). Será administrado entre 24-48 horas após a última injeção de Fostipur Kit.
A punção dos ovócitos será realizada aproximadamente 35 horas depois.
Situação 2 - Quando se utiliza um agonista da hormona liberadora de gonadotropina (GnRH)
Fostipur Kit deve ser administrado aproximadamente 2 semanas após o início deste tratamento. Ambos os tratamentos são mantidos até alcançar o desenvolvimento folicular adequado. Será administrada uma injeção de Fostipur Kit por dia, por via subcutânea. Por exemplo, após 2 semanas de tratamento com um agonista de GnRH, serão administrados 150 a 225 UI de Fostipur Kit durante os primeiros 7 dias. A dose será ajustada então de acordo com a resposta ovárica
Instruções de administração:
Fostipur Kit é administrado por injeção sob a pele (por via subcutânea).
Cada frasco é de uso único e a injeção deve ser administrada imediatamente após a preparação.
Após aconselhamento e prática conveniente, o seu médico pode pedir que você se administre a injeção de Fostipur Kit.
Em primeiro lugar, o seu médico deve:
- Deixá-lo praticar administrando-se a injeção subcutânea.
- Indicar quais são as zonas possíveis para que você se administre a injeção.
- Indicar como preparar minuciosamente a solução para a injeção.
- Explicar como preparar a dose correta que deve ser administrada.
Antes de você se administrar a injeção de Fostipur Kit, leia cuidadosamente as seguintes instruções:
Como preparar e injetar 1 frasco de Fostipur Kit, utilizando 1 frasco de pó:
A solução deve ser preparada justo antes de aplicar a injeção. Cada frasco é utilizado para um único uso. O medicamento deve ser reconstituído sob condições assépticas.
Fostipur Kit deve ser reconstituído apenas com o diluente fornecido no kit.
Prepare uma superfície limpa e lave as mãos antes de reconstituir a solução. É importante que tanto as mãos quanto os utensílios que você vai usar estejam o mais limpos possível.
Estenda os seguintes materiais sobre uma superfície limpa:
- 2 pedaços de algodão com álcool (não vêm na caixa),
- 1 frasco que contém o pó de Fostipur Kit,
- 1 seringa pré-carregada com diluente,
- 1 agulha para preparar a injeção,
- 1 agulha fina para a injeção subcutânea.
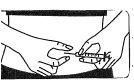
Reconstituição da solução para a injeção utilizando 1 frasco de pó.
Preparar a solução para a injeção:
|
|
|
|
|
NÃO AGITE, mas mova suavementeo frasco entre as mãos até que o pó esteja completamente dissolvido, tentando evitar a criação de espuma. |
|
Preparação de doses mais altas, utilizando mais de 1 frasco de pó
Se o seu médico recomendou doses mais altas, você pode consegui-las utilizando mais de 1 frasco de pó com uma seringa pré-carregada de diluente.
Quando se reconstitui mais de 1 frasco de Fostipur Kit, ao final da fase 4 descrita anteriormente, introduza o conteúdo reconstituído do primeiro frasco novamente na seringa, e injete lentamente em um segundo frasco. Repita as fases 2 a 4 para o segundo frasco e subsequentes até que se dissolva o conteúdo do número necessário de frascos equivalente à dose prescrita (dentro do limite da dose máxima total de 450 UI, correspondente a um máximo de 6 frascos de Fostipur Kit 75 UI, 3 frascos de Fostipur Kit 150 UI, ou 2 frascos de Fostipur Kit 225 UI).
O seu médico pode aumentar a dose em 37,5 UI, que representa a metade de um frasco de Fostipur Kit 75 UI.
Para isso, você deve reconstituir o conteúdo do frasco de 75 UI de acordo com as fases 2 a 3 descritas anteriormente e introduzir a metade dessa solução reconstituída (0,5 ml) na seringa de acordo com a fase 4.
Nessa situação, você terá duas preparações para injetar: a primeira preparação reconstituída em 1 ml e a segunda contendo 37,5 UI em 0,5 ml.
Ambas as preparações devem ser injetadas com suas próprias seringas de acordo com as seguintes fases.
A solução deve ser transparente e incolor.
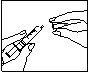
Injete o medicamento por via subcutânea:
|
|
|
|
O local da injeção:
- O seu médico ou enfermeira terão indicado em que parte do seu corpo você pode injetar o medicamento.
Os locaismais comuns sãoa coxa oua parede abdominal inferiorabaixo do umbigo.
- Limpe o local da injeção com um algodão com álcool.
Colocação da agulha:
|
|
Injeção da solução:
- Injete-a sob a pele como lhe ensinaram. Não a injete diretamente em uma veia. Empurre o êmbolo lentamente e de forma constante, de modo que a solução seja injetada corretamente e a pele não seja danificada.
Leve todo o tempoque precisarpara se injetar o volume da soluçãoprescrito.Como descrito na preparação da solução, dependendo da dose prescrita pelo seu médico, pode ser que você não precise usar o volume total da solução.
Retirada da agulha:
- Retire a seringa rapidamente e pressione no local da injeção com um algodão com desinfetante. Um suave massage na área, enquanto ainda mantém a pressão, ajuda a dispersar a solução de Fostipur Kit e alivia as dores.
Eliminação de todos os utensílios utilizados:
Qualquer produto não utilizado ou material de descarte deve ser eliminado de acordo com os requisitos locais (uma vez finalizada a injeção, todas as agulhas e seringas vazias devem ser descartadas em um contenedor apropriado).
Se você usar mais Fostipur Kit do que deve
Os efeitos de uma sobredose de Fostipur Kit são desconhecidos, embora se suponha que poderia ocorrer um síndrome de hiperestimulação ovárica (ver Efeitos adversos possíveis). Se você administrar mais Fostipur Kit do que deve, entre em contato com o seu médico ou farmacêutico.
Em caso de sobredose ou ingestão acidental, consulte imediatamente o seu médico ou farmacêutico ou o Serviço de Informação Toxicológica, telefone: 915 620 420, indicando o medicamento e a quantidade ingerida.
Se você esqueceu de usar Fostipur Kit
Coloque a próxima injeção no momento que estava previsto. Não use uma dose dupla para compensar as doses esquecidas.
Se você interromper o tratamento com Fostipur Kit
Não interrompa o tratamento por sua própria iniciativa. Consulte sempre o seu médico se você está considerando deixar de usar este medicamento. Se você tiver alguma outra dúvida sobre o uso deste medicamento, consulte o seu médico ou farmacêutico.
4. Efeitos adversos possíveis
Como todos os medicamentos, Fostipur Kit pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Os efeitos adversos seguintes são importantes e requererão ação imediata se você os experimentar.
Deve interromper a administração de Fostipur Kit e visitar o seu médico imediatamente se ocorrer o seguinte:
Frequentes, podem afetar entre 1 e 10 de cada 100 pessoas:
- Síndrome de Hiperestimulação Ovárica (ver Seção 2 da informação adicional)
Também foi relatado sobre os efeitos adversos seguintes:
Frequentes, podem afetar entre 1 e 10 de cada 100 pessoas:
- Dor de cabeça,
- sensação de inchaço no abdômen,
- prisão de ventre,
- dor na zona da injeção.
Pouco frequentes, podem afetar entre 1 e 10 de cada 1000 pessoas:
- Aumento da atividade da glândula tireoide,
- mudanças de humor,
- cansaço,
- tontura,
- dificuldade para respirar (dispnéia),
- sangramento pelo nariz,
- náuseas, indigestão, dor abdominal,
- vermelhidão, coceira,
- suores,
- cistite,
- aumento das mamas, dor de mamas,
- dificuldade para deter as hemorragias.
Pode ocorrer vermelhidão, dor e hematomas no local da injeção (frequência não estabelecida).
Ver seção 2 da informação adicional sobre o risco de coágulos sanguíneos, gravidez ectópica, gravidezes múltiplas e abortos.
Se você considera que algum dos efeitos adversos que sofre é grave ou se percebe qualquer efeito adverso não mencionado neste prospecto, informe o seu médico ou farmacêutico.
Comunicação de efeitos adversos:
Se você experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Você também pode relatá-los diretamente por meio do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: https://www.notificaram.es.
Ao comunicar efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Fostipur Kit
Mantenha este medicamento fora da vista e do alcance das crianças.
Não conserve a uma temperatura superior a 25ºC. Conservar o frasco e a seringa pré-carregada de diluente no embalagem exterior para protegê-lo da luz.
Não use este medicamento após a data de validade que aparece na caixa de cartão e no frasco.
Use imediatamente após a reconstituição.
Não use Fostipur Kit se você notar que a solução não parece transparente. Após a reconstituição, a solução deve ser transparente e incolor.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Dessa forma, você ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Fostipur Kit
O princípio ativo é urofolitropina.
Cada frasco contém 225 UI de urofolitropina (hormona foliculostimulante FSH): 1 ml de solução reconstituída contém 225 UI ou 450 UI de urofolitropina, quando se reconstitui 1 ou 2 frascos de produto, em 1 ml de diluente.
A atividade específica in vivoé igual ou superior a 5000 UI de FSH por mg de proteína.
Os demais componentes são:
Pó: lactose monohidrato.
Diluente: cloreto de sódio e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Fostipur Kit é apresentado em pó e diluente para solução injetável.
Caixas com 1, 5 ou 10 kits. Cada kit contém: 1 frasco com pó que contém 225 UI de urofolitropina, 1 seringa pré-carregada com 1 ml de diluente, 1 agulha para a reconstituição e 1 agulha para a injeção subcutânea.
O aspecto do pó é de uma massa endurecida branca a esbranquiçada, e o diluente é transparente e incolor.
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização
IBSA Farmaceutici Italia srl
Via Martiri di Cefalonia 2
26900 Lodi (Itália)
Responsável pela fabricação
IBSA Farmaceutici Italia Srl., Via Martiri di Cefalonia, 2 - 26900 Lodi (Itália)
Você pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do
titular da autorização de comercialização:
Instituto Bioquímico Ibérico IBSA S.L.
Avenida Diagonal 605,
Planta 8, Local 1,
08028 Barcelona (Espanha)
Este medicamento está autorizado nos estados membros do Espaço Econômico Europeu com os seguintes nomes (as concentrações e formas farmacêuticas são idênticas em todos os países, apenas os nomes comerciais mudam)
Áustria: Fostimon PFS
Bélgica: Fostimon
Chipre: Fostimon PFS
Dinamarca: Fostimon Set
Finlândia: Fostimon Set
França: Fostimonkit
Luxemburgo: Fostimon
Irlanda: Fostimon PFS
Holanda: Fostimon Set
Noruega: Fostimon Set
Espanha: Fostipur Kit
Suécia: Fostimon Set
Reino Unido: Fostimon PFS
Data da última revisão deste prospecto: fevereiro 2024
A informação detalhada e atualizada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FOSTIPUR KIT 225 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 150 UI urofolitropina/ mlSubstância ativa: urofollitropinFabricante: Ibsa Farmaceutici Italia S.R.L.Requer receita médicaForma farmacêutica: INJETÁVEL, 75 UI por 1 ml de solução / 5000 UI de FSH por mgSubstância ativa: urofollitropinFabricante: Ibsa Farmaceutici Italia S.R.L.Requer receita médicaForma farmacêutica: INJETÁVEL, 150 UI por 1 mL de solução reconstituídaSubstância ativa: urofollitropinFabricante: Ibsa Farmaceutici Italia S.R.L.Requer receita médica
Alternativas a FOSTIPUR KIT 225 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a FOSTIPUR KIT 225 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Polónia
Alternativa a FOSTIPUR KIT 225 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para FOSTIPUR KIT 225 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de FOSTIPUR KIT 225 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.



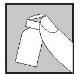

 Com a agulha ainda inserida, vire o frasco para baixo.
Com a agulha ainda inserida, vire o frasco para baixo.